生物样品中有机酸的离子排斥色谱测定方法进展
贾鹏禹,孙蕊,李良玉,周行,韩毅强,冯乃杰
(黑龙江八一农垦大学,大庆 163319)
生物样品是指动物、植物、微生物或其他相关领域研究中采集的动物体液和排泄物、植物组织和细胞、微生物培养液和发酵液等测试样品,具有基体复杂多样、水相背景等特点,常见的生物样品来源主要有动物生理体液、肠道内容物、微生物发酵品、酿造食品、青贮饲料和果汁等[1-4]。有机酸是一类含有羧酸基团的有机化合物,在生物样品中或来源于微生物代谢产物或来源于动植物自身生理代谢产物,是相关研究中重要的考察指标[5-6],例如通过检测瘤胃液中乳酸及短链脂肪酸的含量考察反刍动物的生理变化,通过检测青贮饲料中各有机酸含量监测青贮发酵品质等。生物样品中有机酸的检测工作因各种样品复杂的背景干扰不断受到挑战,分析人员不但需要针对实际情况制定样品前处理和仪器测试方法策略,而且要兼顾样品前处理与仪器检测方法的衔接工作。近年来,生物样品中有机酸的检测需求逐年扩大,研究人员在相关指标测试中亟待快速建立有效的检测方法,随着分离分析技术的进步,离子排斥色谱法逐渐成为分析有机酸的简捷有效方法。现对离子排斥色谱法分析有机酸的分离机制、方法的组成要素、方法的建立与优化和方法应用中的常见问题等加以综述。
1 有机酸的检测方法
有机酸的检测方法主要有气相色谱法、反相高效液相色谱法和离子色谱法等[7-11]。气相色谱法主要用于具有挥发性,热稳定性的有机酸化合物的检测,如短链脂肪酸的分析,对挥发性差的化合物不能直接测定,一般需要对其进行衍生化处理,此外在样品前处理时要避免生物样品中水对色谱柱使用寿命的影响,因此在一定程度上限制了气相色谱方法的应用范围。反相高效液相色谱结合紫外—可见检测器可用于多数有机酸化合物的分析,但对多目标化合物分离选择性的色谱优化工作相对复杂,需要精确调控流动相组成,方法可移植性不强[12-13]。此外在以C18 为主的反相高效液相色谱方法应用中,弱保留目标组分常受到样品基体中非目标组分的共流出干扰,使得在弱保留区目标组分的色谱峰信号失常,导致目标组分无法准确定量。离子色谱是分离有机酸的良好方法,适用于生物样品中有机酸的分析,该方法设备依赖性强,方法不易普及[11]。近年来逐渐得到广泛应用的离子排斥色谱是一种新颖、经济适用且分离选择性好的有机酸检测方法,其独特的分离机制使得方法在简单的仪器配置上即可实现多个目标化合物的高效分离,非常适合生物样品中有机酸化合物的检测[14-17]。课题组在有机酸的离子排斥色谱检测方面进行了多年的技术应用,针对反刍动物瘤胃液、实验动物粪便、微生物发酵液、青贮饲料及果汁等生物样品所建立的检测方法取得了良好的应用效果[14,17]。
2 离子排斥色谱的分离机制
离子排斥色谱一般采用表面键合磺酸基团的不同交联度聚苯乙烯/二乙烯基苯聚合物微粒(PS/DVB- SO3H)作为分离介质(色谱填料),键合相一端裸露的磺酸氢质子是产生分离选择性的主要官能结构。离子排斥色谱的分离机制广泛被认为是Donnan排斥理论[14,18],此外还可能包含空间排斥、吸附和配位体交换等机理,多种作用模式使分离介质具备良好的有机酸分离能力。由于分离介质表面存在大量质子,在Donnan 排斥过程中,分离介质与化合物间被假定存在一层Donnan 膜,强酸电解质向填料渗透时被膜排斥,而弱酸电解质可穿透膜进入填料,因此产生了色谱保留。在色谱分离过程中,一元羧酸的分离主要受Donnan 排斥和吸附作用,二元、多元羧酸的分离同时还受到空间排斥作用,上述作用使得不同性质的小分子有机酸和大分子有机酸得到了良好的分离。相比反相液相色谱而言,上述离子排斥色谱的分离机制充分体现了其对强弱电解质组分的分离选择能力,在实际应用中,样品基体中的强电解质干扰物在离子排斥色谱柱上被优先洗脱,同时对弱保留目标组分几乎不产生干扰,加强了对目标组分的定性定量能力,这种特殊的分离选择性在反相色谱柱上是很难实现的。离子排斥色谱的有机酸检测适用范围较广,几乎涵盖了生物样品中常见的有机酸化合物,常见有机酸化合物在美国Sepax 公司生产的Carbomix H 型色谱柱上的保留情况见表1。不同型号色谱柱对多种有机酸化合物均具有较好的分离选择性,这与其独特的分离机制密切相关,此外色谱条件只采用浓度极低的稀酸溶液作为等度洗脱的流动相,因此采用离子排斥色谱进行有机酸的检测具有经济、绿色环保、普适、简便等特点。
3 离子排斥色谱法的组成要素
3.1 色谱柱
在分析方法建立前,色谱柱的选择至关重要。目前市售的离子排斥色谱柱有多种品牌可供选择,见表2,与反相高效液相的硅胶基质色谱柱不同,离子排斥色谱柱尺寸多为300×7.8 mm ID 大尺寸色谱柱,这与采用聚合物为色谱填料有关。由于采用了相似的色谱柱填料类型,各品牌色谱柱对有机酸化合物的分离具有相似的分离选择性,化合物出峰顺序大致相同略同,所使用的流动相类型略有不同[15],此外相同化合物的保留时间也存在差异。在选定品牌后,填料粒径和交联度是两个重要的选择参数,要结合样品类型和目标化合物的性质进行选择,一般若同时分离多个目标化合物时,宜选择粒径小的填料,可以带来更高的分离柱效,对大多数化合物实现基线分离。若化合物中含有大分子化合物,宜选择交联度低的填料,容易对大分子目标物产生体积排阻效应,从而使分离效果更佳。需要注意的是,交联度低的填料刚性较差,容易受到流动相冲击发生柱头填料塌陷现象。分析小分子化合物一般应选择刚性适中的8%交联度色谱柱[14]。
3.2 仪器配置
离子排斥色谱分析方法一般采用简单的仪器配置,只需要等度色谱泵系统、温度可控的色谱柱箱和紫外—可见检测器或示差折光检测器,比早前采用抑制型电导检测方法所需的仪器配置更为简单易用[19],因此检测方法的建立在绝大多数仪器分析室即可快速实现。在不同检测器配置下的方法学应用中,紫外—可见检测下的相同浓度的目标组分峰面积或信号响应强度存在较大差异,原因可能在于不同目标组分的紫外—可见摩尔吸光系数不同[14,16],而采用示差折光检测器下的同类化合物组分信号响应强度差异相对较小。在检测灵敏度方面,示差折光检测器受固有因素影响较紫外—可见检测器还存在不足,因此在方法建立时要根据定量需求选择不同的仪器配置,或根据实验室已有的条件选择不同的定量方法,一般紫外检测器选择外标法,示差折光检测器选择内标法或外标法。此外,由于紫外检测器较示差折光检测器在某些有机酸组分上的灵敏度高,针对微量组分检测时,宜选用紫外检测器。
集中技训从大一下学期陆续开展,每学期不超过一次,具体时间安排结合各学院专业课程要求进行。实施中,每学期固定两个教学周停开其他课程单独进行集中技训教学。采用“带教带学”模式进行授课,教师“带教”,班级辅导员督促“带学”。通过近几年的实施,学校教务处及学院各专业有效的整合了教学资源,教学实践潜力得到挖掘,目前各专业都不同程度取得了成绩,运行状况良好。
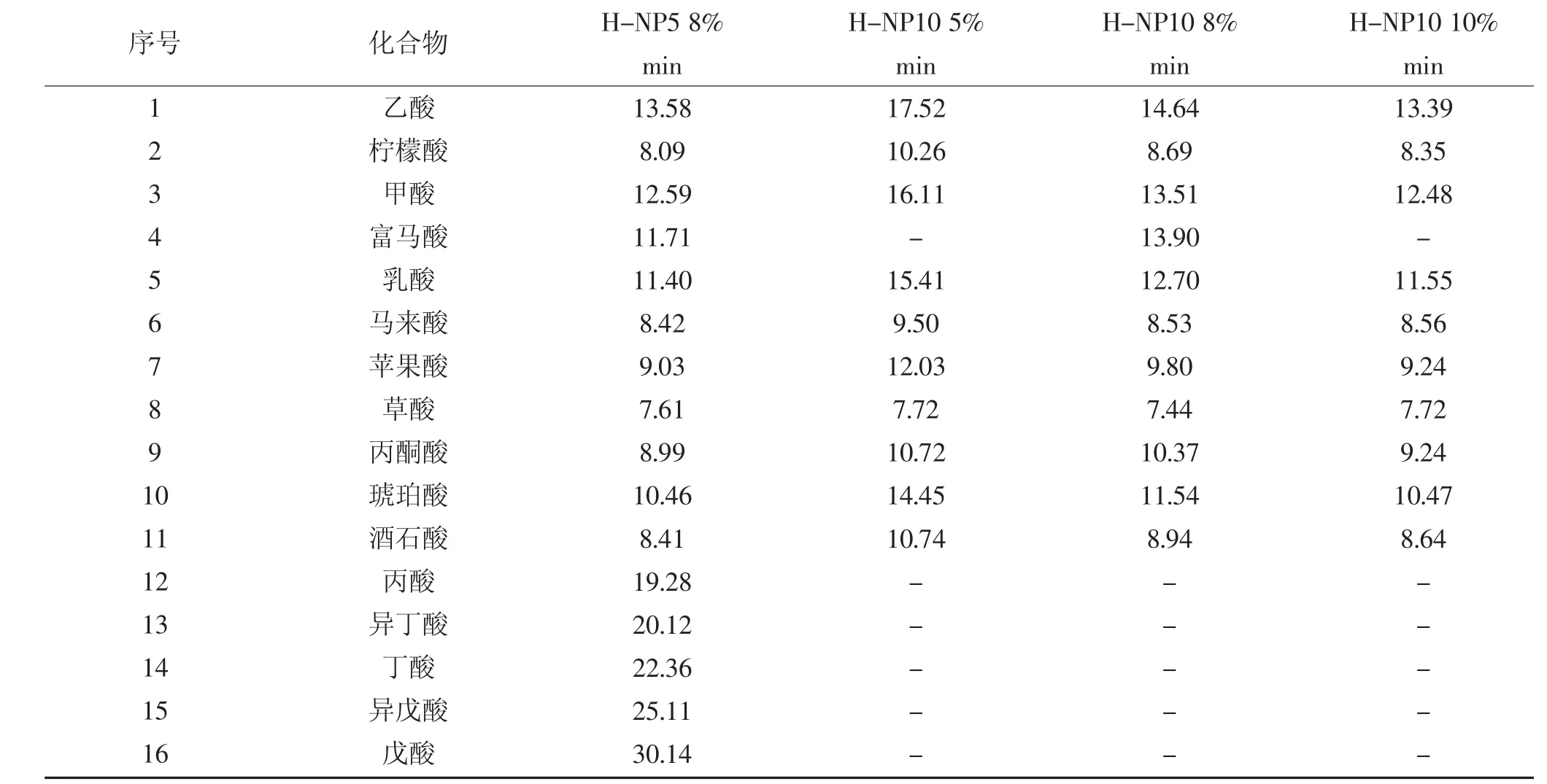
表1 Carbomix H 型色谱柱上不同有机酸保留时间Table 1 Retention time of different organic acids on carbomix H columns

表2 常见商用色谱柱Table 2 Common commercial chromatographic columns
4 离子排斥色谱法的方法建立及优化
4.1 色谱柱安装与仪器的启动
由于采用合成聚合物的离子排斥色谱填料交联度较低,类似软凝胶,在高流速下会产生高柱压,因此离子排斥色谱方法常在低流速下使用。尽管低流速会增加分析的时间,但这将有助于提高色谱柱的柱效。若有特殊研究需要,低的操作流速还允许将两根色谱柱串联起来,用于解决复杂样品中的目标组分的分析。在常规分析中,流速的设定要充分考虑填料交联度、色谱柱温度和色谱柱尺寸之间的关系,以获得最佳的分离效果和分析效率。
4.2 样品的前处理
在检测过程中,系统压力异常是常见的故障现象,易导致色谱出峰重现性变差。压力异常主要体现在三个方面:一是系统无压力,表现为泵正常工作而系统压力为零,其原因主要在于泵输液系统严重泄漏或输液系统单向阀故障,应检查系统是否存在漏点或清洗单向阀件。二是系统压力波动,表现为压力忽高忽低,其原因可能在于输液系统流动相初级过滤头或单向阀污染,应检查输液系统流动相过滤头或单向阀件是否存在脏污。三是系统压力过高,表现为系统高压运行甚至报警停泵,除需逐段检查输液管线是否堵塞外,还应着重检查色谱柱头筛板或色谱填料的堵塞,筛板脏污堵塞可采用超声清除或反冲色谱柱,填料堵塞若修补未能达到检测要求时需要更换色谱柱[28]。
4.3 流动相的优化
(1)触摸法:用手摸,粗的是 N a2CO3,细的是N aH CO3(N a2CO3为白色粉末或细粒, N aH CO3为白色细小晶体);
猪丹毒病原是猪丹毒杆菌,为一种革兰氏阳性的纤细小杆菌,在自然界分布甚广。该菌属有2个种,即红斑丹毒丝菌和扁桃体丹毒丝菌。红斑丹毒丝菌俗称猪丹毒杆菌,有血清型la、1b、2、4、5、6、8、11、12、15、16、17、19、21和N;扁桃体丹毒丝菌有血清型3、7、10、14、20和23;其他2个丹毒丝菌属血清型分别为13和18[3]。猪丹毒杆菌是一种兼性厌氧菌,细长,不运动,无芽孢,无鞭毛。目前,已发现的猪丹毒杆菌主要为1型(1a和1b)和2型。
4.4 色谱柱温度的优化
在样品检测完毕后,一般用10~20 倍柱体积的保存溶剂冲洗色谱柱,冲洗结束后,先将流速设定为0.10 mL·min-1并关闭柱温箱,待柱温降低至40 ℃以下后,方可取下色谱柱,色谱柱长期不用时,色谱柱需注入2.5~4.0 mmol·L-1的硫酸溶液,存于阴凉处并禁止低温冻结。为了防止柱床干涸,柱两端堵头需旋紧。此外色谱系统管路中的酸液应及时冲洗更换,避免仪器系统受到强酸或含卤素化合物的腐蚀[27]。
4.5 流动相流速的优化
由于离子排斥色谱柱所用聚合物基质相比硅胶基质刚性较差,可承受的色谱柱压较低,因此色谱仪器的启动要遵照“起步低,进阶缓”的原则。将色谱柱接入色谱仪器系统前,首先旋去两端的堵头,按色谱柱标记方向与流动相流动的方向保持一致将色谱柱接入管线。一般新的离子排斥色谱柱采用稀酸溶液进行封装,在长期储存和运输过程中,柱填料两端可能会干涸,应参照说明书使用10~20 倍柱体积的保存溶剂进行冲洗以活化色谱柱。系统启动时,先以0.10 mL·min-1流速启动恒流泵,开启柱温箱并设置到工作温度,待色谱柱温度升高并稳定30 min 后,以0.10 mL·min-1为步长,以3 min 为时间间隔缓慢升高流速至所需色谱条件。需要注意的是,色谱柱安装前一定要用方法所用的流动相充分置换仪器管路中的旧溶液,特别是有机溶剂,否则易导致有机溶剂进入色谱柱溶解填料损坏色谱柱。
思想的盛宴,智慧的汇萃,观点在碰撞中产生夺目的火花。这是一次高品位的学术研讨会,又是深层次的经验交流会,既有理论水平和前瞻思考,又有现实针对性。主题集中,精彩纷呈,与会代表的热烈讨论和诚恳建议,是此次会议最丰厚的收获。
5 方法应用中的常见问题
5.1 色谱柱使用后的保养
离子排斥色谱运行温度较常见的反相高效液相色谱模式运行温度高,且温度对离子排斥色谱柱的组分保留时间和分离效率有显著影响[24,25]。对大多数应用而言,在相同的化合物、填料类型和流动相条件下,随着柱温的升高保留时间将会缩短,柱效将会提高,同时柱压会随之降低。升高温度可减少固定相中慢传质过程所引起的谱带展宽效应,从而提高分离的效率。此外升高温度还能减小流动相的粘度,使溶质分子更容易地渗入树脂内部,从而获得高的分辨率,但是在优化条件时不宜超出最高温度上限(如85 ℃)或低于下限(如30 ℃),温度过高或过低都将可能对色谱柱造成损伤,其原因可能在于填料机械形态的不可逆转变[26]。
5.2 系统压力异常
样品前处理不但关系目标化合物的检测灵敏度和回收率,而且关系色谱柱的使用寿命,因此是分析工作的重点。生物样品一般为水基体样品,并含有蛋白、碳水化合物、无机盐和其他极性化合物等杂质,其中水溶性碳水化合物和无机盐对色谱柱及分离分析几乎无不良影响。由于离子排斥色谱方法对有机酸分离具有极好的专属性,在样品前处理时,一般只考虑蛋白等大分子杂质的去除[14,20-21],因此样品前处理过程十分简便。蛋白去除的方法有有机溶剂法、等电点法等,先前的研究发现,采用有机溶剂如乙腈等虽能有效去除样品中蛋白,但有机溶剂在上机样品中的残留或对目标物分离产生强烈干扰,或对色谱填料产生不可逆的损害,因此不适用于方法的建立[14]。实践证明,与离子排斥色谱相匹配的蛋白脱除方法主要为等电点法,即利用强酸去除样品中的蛋白杂质,主要试剂有偏磷酸、高氯酸、5-磺基水杨酸等,过量的强酸在色谱分离过程中受Donnan 排斥作用最先被洗脱出来,不对目标组分产生干扰,因此实现了样品前处理和仪器方法的良好衔接。在蛋白沉淀后一般选用万转以上离心转速澄清溶液,上清液上机前要选用0.22 或0.45 μm 滤膜进行过滤。
简单的洗脱剂组成和等度洗脱方式是离子排斥色谱的主要特点[18-23]。一般建议流动相为稀酸溶液(如2.5 mmol·L-1H2SO4、0.1% H3PO4或3 mmol·L-1HClO4),色谱柱适用的pH 范围为1~3,流动相氢离子的供体主要有苯磺酸、高氯酸、硫酸和磷酸等,在选择酸类型时要充分考虑所用试剂的经济性和安全性及色谱泵系统的耐受性。在某些特殊情况下,流动相中添加有机溶剂如乙腈等能够改善化合物的分离度[14,17],但流动相中有机改性剂的含量不应高于10%(v/v),防止有机相渗入色谱填料使其过分溶胀从而改变填料的性能,有机改性剂不推荐使用甲醇、四氢呋喃等对聚合物产生损害的溶剂。
5.3 无峰或倒峰
在检测过程中,出现无峰或倒峰现象主要集中在检测器工作异常方面,一般无峰原因可能在于检测器信号接收线路出现断点,应检查通讯线路是否稳固。倒峰现象原因可能在于通信信号线正负极接反或检测器极性设置错误。对于示差折光检测器,倒峰原因还可能在于参比池和测量池的管路连接存在问题,或参比池的清洗及零点玻璃的校正存在问题[29]。
5.4 峰型异常
峰型异常主要表现为拖尾、前伸以及峰底过分展宽。主要原因可能在于色谱柱前后管路死体积过大、流动相类型或浓度与目标组分不匹配、色谱柱未充分预热或流动相泄漏等[30]。要检查输液管线长度是否过长,管线接头与色谱柱是否匹配并是否插紧,尽量使用热传导良好的金属管线,以保证流动相在进入色谱柱前充分预热。
集团发挥产业优势,助力精准扶贫,形成了产业扶贫的“江城模式”“镇雄模式”“挖铜模式”“香格里拉模式”等,成为促进边疆社会和谐稳定的重要力量。江城公司自2014年来共投入1200余万元资金进行项目扶持培育,走出了一条被誉为“江城模式”农业产业扶贫的新路子。集团与昭通市政府合作成立了云南农垦昭通农业投资发展公司,正积极推进与楚雄、临沧和保山等州市成立垦地合作的农业产业投资(发展)平台,打造垦地合作和产业扶贫新模式。推进“云豆入沪精准扶贫”项目,计划到2020年在全国范围内铺设全自动智能咖啡机10万台,实现扶贫工作由输血功能向造血功能的转变。
5.5 色谱峰裂分
色谱峰裂分是聚合物基质色谱柱常见的故障之一,特别是在基体复杂的生物样品检测时,样品中的大分子杂质如残存蛋白不易洗脱,造成柱头筛板堵塞、柱头填料污染和柱头填料塌陷等问题,使得各组分在柱内传质过程中出现迟滞和涡流,导致同一组分色谱峰发生裂分影响组分定量[30]。主要解决办法是清除堵在色谱柱入口端的脏污,一般需要将色谱柱反接进行冲洗,在色谱柱反接冲洗时,色谱柱出口不接检测器,防止发生二次污染。冲洗流速一般采用0.20 mL·min-1,冲洗12 h 以上。
6 总结及展望
综述了离子排斥色谱在生物样品有机酸检测方面的研究进展。离子排斥色谱方法样品前处理简便,重现性好,所用试剂安全且价格低廉,所用仪器配置简单,采用10 万元仪器配置即可满足多数有机酸化合物的检测,方法应用广泛,是一种新颖、实用、可靠的检测手段[31]。尽管上述方法体现出了较好的优越性,但不难发现,该方法的应用还仅集中在在常量或微量有机酸分析方面,由于受系统自身灵敏度限制,针对样品中痕量或亚微量有机酸的检测,或针对微小或珍贵样品中有机酸的检测,例如细胞检测等,方法还存在应用局限,需要借助其他更为先进的手段[32-34]。未来几年中,生物样品中有机酸的高灵敏度及高通量检测技术将成为新的发展趋势,可能将通过改善分离通道或与质谱兼容实现上述目标。

