肺癌患者外周血及组织中γδT细胞的分布特征及意义*
尚文雯,徐 睿,陈 献,姚莎莎,金淑贤,张晓洁△
(1.南京医科大学第一附属医院检验学部/国家重点临床检验专科建设单位,江苏南京 210029;2.南京医科大学第一附属医院呼吸与危重症医学科,江苏南京 210029)
肺癌的发病率和病死率位居全球恶性肿瘤之首,发病率逐年上升。其中,非小细胞肺癌(NSCLC)占所有肺癌的85.00%左右,约75.00%的患者发现时已为晚期,5年生存率很低[1]。传统肿瘤疗法包括手术、化疗和放疗对NSCLC的治疗效果欠佳,不能有效改善患者的生存期和生活质量。近年来免疫治疗包括肿瘤浸润性T淋巴细胞疗法(TIL)、嵌合抗原受体T细胞疗法(CAR-T)、T细胞受体疗法(TCR-T)及免疫卡控点修饰法(CTLA-4、PD-1/PDL1)等免疫治疗方法已取得较大进展,逐渐应用于NSCLC的治疗,但由于NSCLC复杂的肿瘤免疫微环境,其治疗效果与预期仍有很大差距[2-3]。因此进一步深入研究肺癌的免疫抑制微环境,有助于打破肿瘤形成的免疫耐受,为肺癌的免疫治疗提供更为广阔的前景。
1 资料与方法
1.1一般资料 本研究经南京医科大学第一附属医院(下称本院)伦理委员会批准,所有患者或家属均签署知情同意书。病例纳入标准:(1)年龄20~70岁初诊患者,未曾接受过其他外科手术、放化疗及免疫抑制治疗;(2)临床诊断明确,且均经细胞学或组织学病理确诊;(3)无其他恶性肿瘤病史,无其他严重并发症;(4)健康对照者为同期体检健康者。本研究根据纳入标准收集了2017年7月至2018年10月就诊于本院的15例肺癌患者的癌组织及其相应癌旁正常组织(距癌>5 cm),并收集相对应的10例肺癌患者外周血,患者年龄35~70岁,平均61岁;男8例,女7例;其中肺腺癌13例,肺鳞癌2例;根据国际抗癌联盟(UICC)第8版肺癌TNM分期标准[4],Ⅰ期2例,Ⅱ期12例,Ⅲ 期1例;有淋巴结转移7例,无淋巴结转移8例。同时收集同期20例年龄匹配的体检健康者外周血作为健康对照组,健康对照组年龄32~70岁,平均58岁;男11例,女9例。
1.2单个核细胞制备 外周血用Ficoll淋巴细胞分离液(TBD,中国)密度梯度离心获得单个核细胞(PBMC)。新鲜的肺癌组织和癌旁正常组织用无菌外科剪剪碎,加入含有DNase Ⅰ(50 U/mL,Sigma)、透明质酸酶(100 μg/mL,Sigma)、胶原酶Ⅳ(1 mg/mL,Sigma)和L-谷氨酰胺(2 μmol/L,Sigma)的RPMI 1640培养基中室温摇床消化2 h。100 mm筛网(BD Falcon,美国)过滤后获得单细胞悬液,用Percoll细胞分离液(GE Health Care Life Sciences,美国)梯度离心得到组织浸润的单个核细胞。
1.3流式细胞术 取1×106个单个核细胞,加入 Alexa Fluor 750-anti-CD45,Alexa Fluor 700-anti-CD3,BV421-anti-TCRγδ,FITC-anti-Vδ1和PE-anti-Vδ2流式抗体(Biolegend,美国),室温下避光孵育20 min,进行细胞膜表面标记,洗涤后加入300 μL PBS重悬细胞,FACS Aria Ⅱ(BD Biosciences,美国)流式细胞仪检测。以FSC和SSC定义淋巴细胞,从CD45+阳性门里分析CD3+γδ+T细胞的比例,并从γδ+T阳性门里分析Vδ1 T、Vδ2 T细胞所占比例。
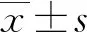
2 结 果
2.1肺癌患者外周血γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平 图1A、B分别显示1例健康对照者和1例肺癌患者外周血中γδT细胞、Vδ1 T、Vδ2 T细胞的流式检测图。以健康对照者为例,其外周血中γδT细胞比例为2.91%,Vδ1 T细胞比例为8.97%,Vδ2 T细胞比例为82.80%。图1C、D、E显示γδT细胞、Vδ1 T细胞、Vδ2 T细胞表达比例的统计学分析结果。健康对照组外周血中γδT细胞比例为(6.87±1.27)%,Vδ1 T细胞比例为(19.13±3.85)%,Vδ2 T细胞比例为(66.45±4.65)%;肺癌患者外周血中γδT细胞(5.87±1.38)%和 Vδ1 T细胞(11.50±3.70)%的表达水平与健康对照组比较差异无统计学意义(P>0.05);而Vδ2 T细胞(23.69±8.84)%表达水平则显著低于健康对照组,差异具有统计学意义(P<0.05)。
2.2肺癌患者癌组织浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平 图2A、B分别显示同1例肺癌患者癌组织和癌旁正常组织中γδT细胞、Vδ1 T、Vδ2 T细胞的流式检测图。以癌旁正常组织为例,其γδT细胞比例为25.10%,Vδ1 T细胞比例为47.90%,Vδ2 T细胞比例为1.65%。图2C、D、E显示γδT细胞、Vδ1 T细胞、Vδ2 T细胞表达比例的统计学分析结果。肺癌患者癌旁正常组织中浸润的γδT细胞比例为(23.25±2.06)%,Vδ1 T细胞比例为(48.80±4.23)%,Vδ2 T细胞比例为(4.10±1.34)%;癌组织中浸润的γδT细胞(32.68±2.83)%和 Vδ1 T细胞(63.92±4.17)%水平显著高于癌旁正常组织,差异具有统计学意义(P<0.05);而癌组织中浸润的Vδ2 T细胞表达水平(1.60±0.53)%则与癌旁正常组织比较差异无统计学意义(P>0.05)。
2.3肺癌患者外周血和癌组织中γδT细胞、Vδ1 T细胞和Vδ2 T细胞的分布特征 本文进一步比较肺癌患者外周血和癌组织中浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平,如图3A、B、C所示:肺癌患者癌组织中浸润的γδT细胞[(32.68±2.83)%vs. (5.87±1.38)%,t=7.319,P<0.001)]和 Vδ1 T细胞[(63.92±4.17)%vs. (11.50±3.70)%,t=8.815,P<0.001)]的水平明显高于外周血,而Vδ2 T细胞的水平则明显低于外周血,差异具有统计学意义[(1.60±0.53)%vs. (23.69±8.84)%,t=3.082,P<0.01)]。
2.4肺癌患者癌组织浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的水平与淋巴结转移的关系 本文进一步将15例肺癌患者分为有淋巴结转移组和无淋巴结转移组,并比较癌组织中浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平,如图4A、B、C所示:有淋巴结转移的肺癌患者浸润的Vδ1 T细胞水平显著高于无淋巴结转移的患者,差异具有统计学意义[(57.87±4.94)%vs. (40.86±5.44)%,t=2.289,P<0.05)];而浸润的γδT细胞[(24.79±1.95)%vs. (21.91±3.54)%,t=0.683,P>0.05)和Vδ2 T细胞的水平差异无统计学意义[(2.50±1.44)%vs. (5.51±2.14)%,t=1.131,P>0.05]。
注:健康对照组20例,肺癌组10例;***表示P<0.001;ns表示差异无统计学意义。
图1 流式细胞术检测肺癌组和健康对照组外周血中γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平

注:癌旁正常组织15例,癌组织15例,***表示P<0.001。
图2 流式细胞术检测肺癌患者癌组织和癌旁正常组织中浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平

注:癌组织15例,外周血10例;**表示P<0.01,***表示P<0.001。
图3 肺癌患者外周血和癌组织中γδT细胞、Vδ1 T细胞和Vδ2 T细胞的表达水平

注:有淋巴结转移7例,无淋巴结转移8例;*表示P<0.05,ns表示差异无统计学意义。
图4 肺癌患者癌组织浸润的γδT细胞、Vδ1 T细胞和Vδ2 T细胞的水平与淋巴结转移的关系
3 讨 论
γδT 细胞是一类广泛分布于外周血和黏膜上皮组织的非组织相容复合体限制性固有T淋巴细胞。既往研究表明,γδT 细胞可以通过多种机制介导抗肿瘤免疫效应,如释放穿孔素和颗粒酶介导靶细胞的凋亡;释放γ-干扰素等细胞因子参与抗肿瘤免疫调节;抗体依赖性细胞介导的细胞毒作用;通过乙型跨膜糖蛋白(FasL)和肿瘤坏死因子相关凋亡诱导配体(TRAIL)途径发挥抗肿瘤作用;NK细胞2D受体(NKG2D)直接识别并杀伤靶细胞[5-6],因此γδT 细胞具有广泛的抗肿瘤谱。然而,越来越多的证据表明,γδT细胞既可发挥细胞毒效应杀伤肿瘤细胞,又能介导肿瘤细胞的免疫逃逸[7]。
据报道,不同的γδT细胞亚群具有不同的免疫效应功能,其中Vδ1 T细胞在上皮性肿瘤中具有免疫抑制作用。RNG等[8]研究发现,直肠癌组织中浸润的Vδ1 T细胞比例显著增高,并与肿瘤分期呈正相关关系,而Vδ2 T细胞比例显著降低,与肿瘤分期呈负相关关系,Vδ1 T细胞具有免疫抑制作用,可以抑制初始CD4+T细胞的增殖,而Vδ2 T细胞具有杀伤活性,可以杀伤直肠癌细胞;MA等[9]研究表明,乳腺癌组织中γδT细胞的增高是其临床预后的独立危险因素,与肿瘤大小、临床分期、淋巴结转移、术后生存时间等不良临床结局相关,且Vδ1 T细胞可以抑制初始T细胞和效应T细胞的功能,阻滞抗原提呈细胞DC的成熟来参与肿瘤免疫抑制[10-11]。LU等[12]研究显示,Vδ2 T细胞与ATM/ATR通路联合可以增强对卵巢癌细胞的杀伤作用。与之相符,本研究发现,肺癌患者癌组织中以Vδ1 T细胞的细胞亚群为主,且γδT细胞和Vδ1 T细胞的比例较癌旁组织明显升高;而外周血中Vδ2 T细胞显著降低,说明γδT细胞的两种不同亚群可能在外周血和肿瘤组织中发挥着不同的效应功能。
肿瘤浸润的γδT细胞可以通过募集免疫抑制细胞等方式帮助肿瘤免疫抑制微环境的建立,促进肿瘤的发生发展。乳腺癌细胞分泌的趋化因子IP-10可招募外周γδT细胞到肿瘤局部,阻断IP-10介导的γδT的迁移可以增强肿瘤特异性T细胞的抗肿瘤效应[13]。对结直肠癌的研究发现,γδT17细胞可通过分泌多种细胞因子如白细胞介素-17A促进骨髓来源的抑制性细胞(MDSCs)的招募、增殖和存活,帮助维持肿瘤的免疫抑制微环境,促进肿瘤进展[14]。胰腺癌组织浸润的γδT细胞通过抑制αβT细胞的活化促进胰腺癌的进展[15]。本研究结果提示,肺癌患者癌组织中以Vδ1 T细胞亚群浸润为主,增高的Vδ1 T细胞与肺癌患者的淋巴结转移相关,表明癌组织中浸润的Vδ1 T细胞可能在促进肺癌的病程进展中发挥重要的作用。当然,有关γδT细胞及其亚群在肺癌组织中表达及与临床特征的关系还需要更大样本的研究,γδT细胞及其亚群在肺癌肿瘤微环境中发挥的免疫功能及机制也值得进一步深入探讨。
4 结 论
深入研究γδT细胞及其亚群可能有助于判断肺癌患者的免疫状况及预后,有望为肺癌免疫检测与免疫治疗提供潜在的靶点。本文的研究显示,肺癌患者癌组织表达高水平的Vδ1 T细胞,且与淋巴结转移相关,可能有望成为肺癌免疫治疗的潜在靶点。

