罗氏Cobas c702全自动生化分析仪检测项目性能验证*
郭东月,覃俊龙,刘小柳,张秀明△
1.广东省深圳市罗湖区妇幼保健院检验科,广东深圳 518019;2.广东省深圳市 罗湖区人民医院医学检验科,广东深圳 518001
随着医学检验技术的快速发展,全自动生化分析仪已成为临床生化检验的主要仪器之一。仪器性能的优劣直接关系检验质量。为配合实验室申请ISO15189认证[1],同时也为了验证2018年新购入的罗氏 Cobas c702全自动生化分析仪检测性能,本实验室依据美国临床和实验室标准协会(CLSI) EP15-A3[2]、美国临床实验室标准化委员会(NCCLS)EP6[3]、NCCLS C28-A2[4]和CLSI EP15-A2[5]文件要求并结合实验室实际情况对Cobas c702检测的共计41个项目的精密度、分析测量范围(AMR)、临床可报告范围(CRR)、参考区间验证及比对试验进行性能验证[6-8]。本文选择天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、α-羟丁酸脱氢酶(α-HBDH)、尿素(Urea)、肌酐(CREA)、尿酸(UA)、胱抑素C(CysC)9个项目为例,概述其具体验证过程,现报道如下。
1 资料与方法
1.1一般资料 选取来自深圳市罗湖区人民医院体检中心的体检者和患者的新鲜血清标本。
1.2仪器与试剂 罗氏公司生产的Cobas c702全自动生化分析仪及配套试剂,所有试剂均在有效期内使用。AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA和CysC检测试剂盒批号分别为350647、362473、373994、353486、357224、265554、370063、370063、354311。
校准品与质控品 Cobas c702全自动生化分析仪检测AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA和CysC均采用罗氏原装试剂配套的校准品,批号分别为305596、305596、305596、305624、305596、305596、305596、305596、277906。低、中、高值质控品由伯乐公司提供,批号分别为45801、45802、45803。所有校准品及质控品均在有效期内使用。
1.3方法 检测日当天先进行室内质控,只有在室内质控在控的情况下方进行后续的试验。
1.3.1精密度验证 按操作说明书对仪器进行维护保养、校准和质控检测。按照CLSI EP15-A3标准:使用2个水平质控品,每一水平每天做一批,每批每个水平重复测定5次,连续检测5天。计算批内精密度标准差(Sr)、总精密度标准差(S1)、变异系数(CV)。批内精密度值的确定:计算值Sr小于等于实验室质量目标设定的标准差,表明核实批内精密度与实验室质量目标一致,如大于实验室质量目标,则使用验证值核实实验室的批内精密度。总精密度值的确定:计算值S1小于等于实验室质量目标的标准差,表明核实总精密度与实验室质量目标一致,如大于实验室质量目标,则使用验证值核实实验室的总精密度。
1.3.2AMR验证 按操作说明书对仪器进行维护保养、校准和质控检测。按照CLSI EP6文件标准[9-11]:选取接近AMR下限及上限的个体样本各1个,确保每个个体样本量接近1.5 mL,分别对这两样本进行2次测量,取平均值作为预期值,然后对两样本按水平梯度进行稀释,配制成5L、4L+1H、3L+2H、2L+3H、1L+4H、5H共6个水平梯度的样本,分别进行2次重复测量,计算各水平的均值并与其对应的预期值进行线性回归分析,判断标准为R2>0.95,b要求在0.97~1.03范围内[3]。根据相关系数及随机误差的不精密度判断是否呈线性[12-15],从而核实此项目的AMR是否与厂商声明一致。
1.3.3CRR验证 按操作说明书对仪器进行维护保养、校准和质控检测。选取两例接近AMR上限的患者样本重复测量2次,并将样本稀释3、5、10倍(确保稀释后的水平在AMR内)后上机检测,每个稀释样本重复测量2次,通过其均值计算样本的回收率,回收率在90%~110%,且稀释的水平在AMR内则稀释倍数即为可接受。CRR=AMR的上限×最大可稀释倍数。
1.3.4参考区间验证 参考NCCLS C28-A2[4]文件,选择20份体检合格的健康人标本进行测定,对结果进行统计并对仪器说明书提供的参考区间进行验证,若20份标本的检测结果均在仪器说明书提供的参考区间内或超出给定参考区间的标本数量≤2,则验证通过,否则进行参考区间确立试验。
1.3.5比对试验验证 选取20例涵盖整个AMR的患者样本,水平覆盖试验系统的AMR,样本选取满足参考区间内、外所占比例相近。20例样本分别在罗氏 Cobas c702全自动生化分析仪及已有贝克曼库尔特AU5800全自动生化分析仪两个不同检测系统各进行1次检测,比对试验在3 d内完成,评估两仪器间的相对偏倚或者绝对偏倚,如偏倚在1/2的实验室质量目标内,或偏倚大于1/2实验室质量目标但小于偏倚验证值,视为比对试验通过,否则为比对试验未通过。
2 结 果
2.1批内精密度验证结果 AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC的批内精密度计算值Sr均小于实验室质量目标设定的标准差,表明核实批内精密度与实验室质量目标一致; AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC的总精密度计算值S1小于实验室质量目标的标准差,表明核实总精密度与实验室质量目标一致。见表1。
2.2AMR Cobas c702检测 AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC线性回归分析呈线性,结果均符合NCCLS EP6[3]的要求,见表2。
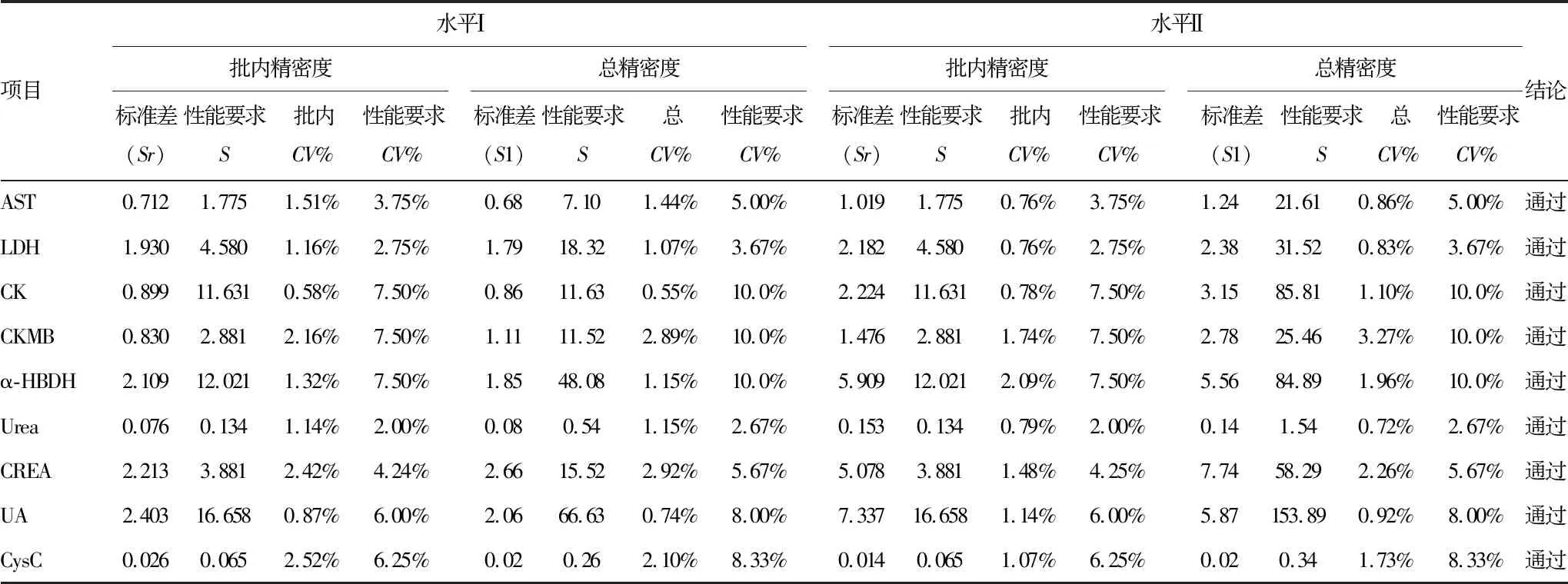
表1 精密度验证结果

表2 AMR验证结果
注:*表示结论根据NCCLS EP6[3]的要求进行判断。
2.3CRR验证结果 结果见表3。
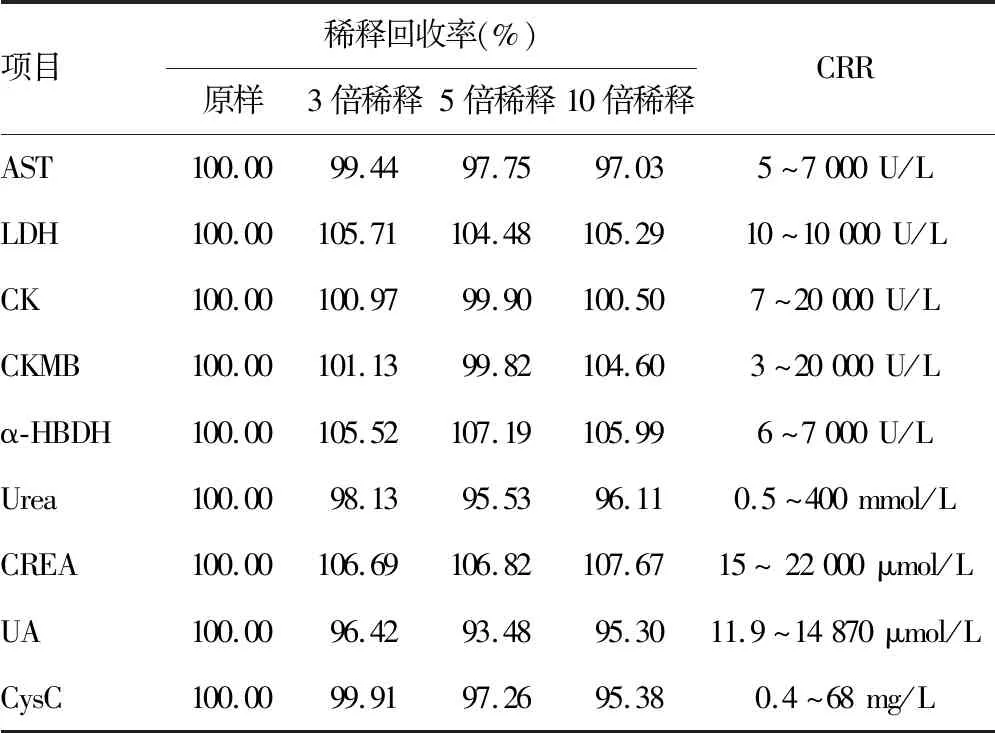
表3 CRR验证结果
2.4参考区间 20份体检合格的健康人标本AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC参考区间验证通过率均≥90%,验证通过。见表4。
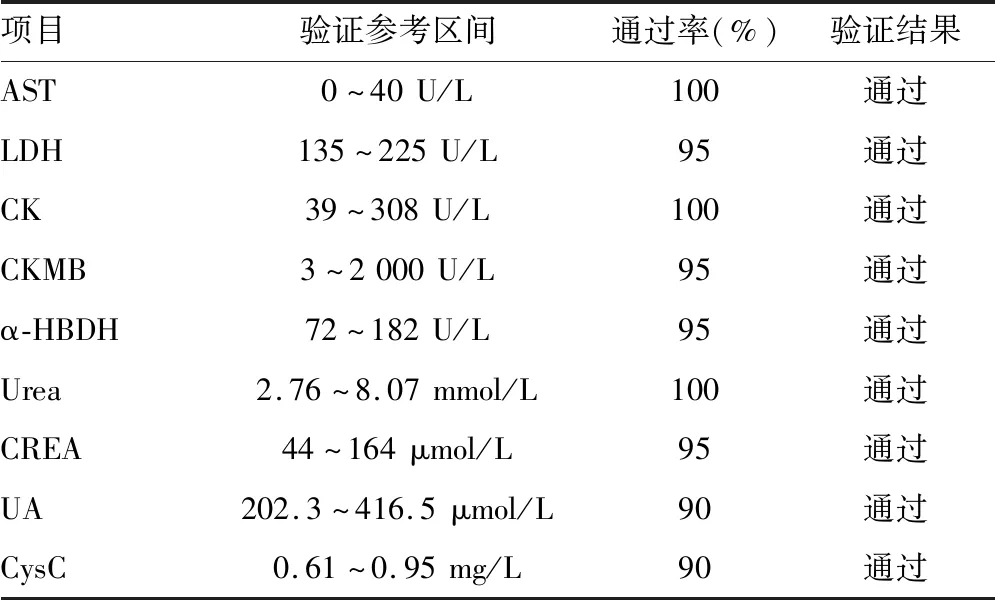
表4 参考区间验证结果
2.5比对试验 结果见表5。
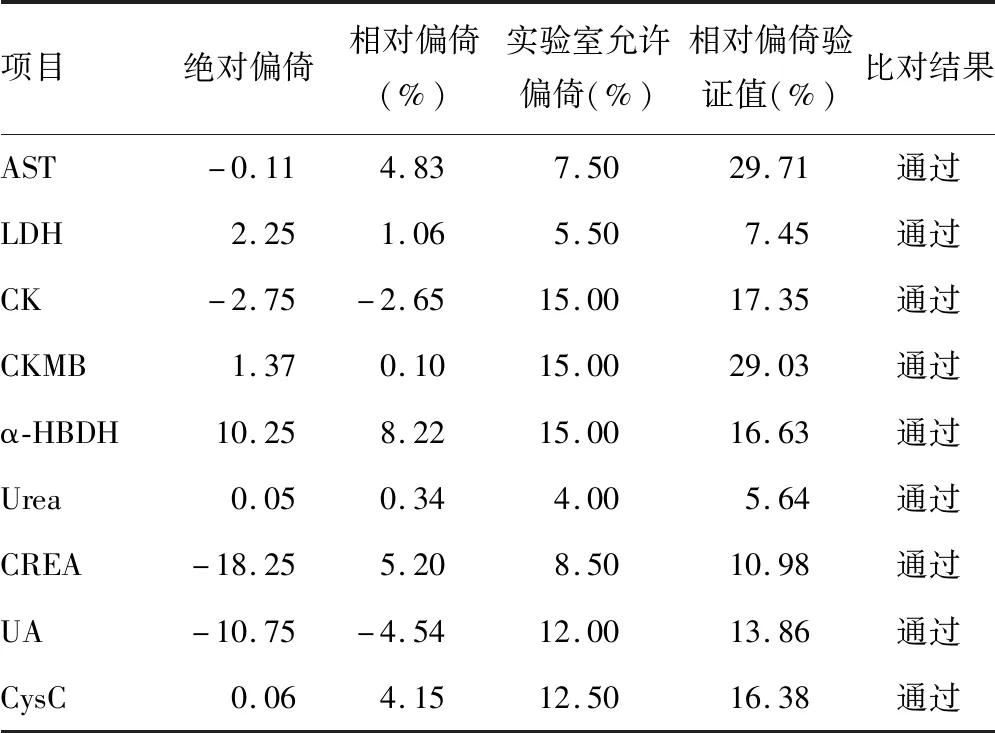
表5 比对试验验证结果
3 讨 论
AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC各项目的批内精密度计算值Sr均小于性能要求的标准差,总精密度计算值S1均小于性能要求的标准差可认为精密度验证通过。在确认检测系统精密度符合要求的基础上,进行AMR及CRR验证,结果显示,该仪器各项目检测线性范围较宽,线性范围基本涵盖了临床标本分布的水平范围,线性范围符合要求。AST、LDH、CK、CKMB、α-HBDH、Urea、CREA、UA、CysC的R2均大于0.95,线性验证符合NCCLS EP6-A[3]文件的要求。选择接近线性范围上限的高值标本作最大稀释度验证,因为在实际临床工作中经常会遇到检测结果超过该项目线性范围的情况,需要稀释标本获得检测结果,本试验以AMR的上限乘以最大的可稀释倍数作为CRR。该范围内的标本稀释后检验结果可靠,符合临床要求。验证罗氏原装配套试剂的参考区间是否适用于本实验室,经验证均适用。通过与参比系统的比对,相对或者绝对偏倚均小于1/2实验室质量目标,比对通过。
综上所述,罗氏Cobas c702全自动生化仪检测项目的精密度、AMR、CCR、参考区间验证和比对试验均通过验证,仪器能够满足医院临床检测需求。