抗磷脂综合征合并冠状动脉血栓1 例
王亮 叶益聪 张抒扬
作者单位:100730 北京,中国医学科学院 北京协和医学院 北京协和医院心内科
1 临床资料
患者 男,26岁。因“头痛8 d,胸痛6 d”2017年7月17日就诊于北京协和医院。2017年7月10日患者无明显诱因出现持续性头痛,左侧为著,伴头晕。7月12日患者劳累后出现胸痛,症状持续不缓解。7月16日患者就诊外院,查心电图示:窦性心律,Ⅱ、Ⅲ、aVF导联ST段压低、T波倒置。心肌损伤标志物示:肌酸激酶1087 U/L,肌酸激酶同工酶62.9 μg/L,心肌肌钙蛋白I 4.2 μg/L。头部核磁共振示:左侧小脑半球软化灶。7月17日患者至北京协和医院急诊就诊,测血压 88/59 mmHg(1 mmHg=0.133 kPa),心率 84次/分,余心肺腹查体(-)。心电图示:交界性自主心律,室率78次/分,Ⅲ导联Q波形成,Ⅱ、Ⅲ、aVF、V4~V6导联T波倒置(图1)。心肌损伤标志物示:肌酸激酶1240 U/L,肌酸激酶同工酶91.2 μg/L,心肌肌钙蛋白I 15.458 μg/L。考虑急性冠状动脉综合征可能性大,予阿司匹林、氯吡格雷及低分子肝素抗凝治疗。7月18日患者出现右下腹刺痛,与进食无关,不伴发热、恶心、呕吐、腹泻等不适,程度逐渐加重。既往患者10岁时当地医院诊断为血小板减少性紫癜,曾口服激素类药物(具体不详)约1年,复查血小板正常后停药。不嗜烟酒,否认冠心病家族史。入院诊断:急性心肌梗死。入院后完善相关检查,超声心动图示:左心室下后壁变薄、无运动,左心室收缩功能减低,左心室射血分数45%。冠状动脉造影+光学相干断层成像(optical coherence tomography,OCT)示:右冠状动脉远段可见血栓影(图2)。头核磁血管成像示:颈内静脉、乙状窦高信号,不除外血栓(图3)。主动脉CT血管成像示:右髂内动脉闭塞(图4)。红细胞沉降率85 mm/h,高敏C反应蛋白74.55 mg/L。免疫球蛋白、补体(-)。抗核抗体(-)、抗双链DNA(-)、抗可溶性抗原抗体(-)、抗中性粒细胞胞浆抗体(-)。抗心磷脂抗体(anticardiolipin antibody,aCL) 52PLIgG-U/ml,抗β2-糖蛋白1抗体(anti-beta 2 glycoprotein 1 antibody,抗β2-GP1抗体)>200 RU/ml,狼疮抗凝物(lupus anticoagulant,LA)2.79 s。免疫科会诊:抗磷脂综合征(antiphospholipid syndrome,APS)诊断明确。腹部CT示:阑尾肿胀,可见较多粪石,周围无明显渗出。外科会诊:急性阑尾炎明确。最终诊断:原发性APS,急性心肌梗死(下后壁),右髂内动脉闭塞,乙状窦血栓形成,急性阑尾炎。治疗方面:(1)抗栓治疗,继续阿司匹林100 mg、每日1次,加用低分子肝素抗凝过渡至华法林口服,使国际标准化比值(international normalized ratio,INR)在2.0~3.0;(2)急性阑尾炎,禁食水,抗感染。治疗后,腹痛症状、体征逐渐缓解,逐渐恢复饮食。随访2年余,患者坚持阿司匹林和华法林治疗,无任何不适症状。
2 讨论
本例患者的临床症状、心电图及心肌酶等结果均符合急性心肌梗死。但是患者为青年男性,无其他冠心病危险因素,临床考虑冠状动脉粥样硬化性心脏病的诊断证据不足。入院后完善冠状动脉造影及OCT检查,证实了冠状动脉多发血栓形成[1]。除了冠状动脉受累以外,患者还有其他脏器受累的表现,包括右髂内动脉闭塞,乙状窦血栓形成,急性阑尾炎及既往血小板减少性紫癜病史,所以诊断上需要考虑系统性疾病,特别是自身免疫性疾病的可能。患者抗磷脂抗体(antiphospholipid antibody,aPL)阳性,最终确诊APS。
APS是一种系统性自身免疫性疾病。临床上以动静脉血栓形成、病理性妊娠为主要表现,其血清中可存在aPL。APS可分为原发性APS和继发性APS,其中继发性APS多见于系统性红斑狼疮。目前诊断APS最常用的分类标准还是2006年悉尼国际APS会议修订的分类标准[2]。本例患者存在血管栓塞事件,包括冠状动脉血栓和乙状窦血栓,同时实验室检查提示aCL、抗β2GP1抗体及LA均阳性,临床明确诊断APS。已有APS合并阑尾炎的报道,APS合并阑尾炎的病理表现为炎症细胞浸润、累及小血管的纤维样坏死[3]。除此之外,APS还可以有其他系统受累的表现,包括皮肤:网状青斑、指(趾)坏疽、皮肤溃疡;血液系统:血小板减少、自身免疫性溶血性贫血;呼吸系统:肺栓塞、肺动脉高压、急性呼吸窘迫综合征;心血管系统:累及瓣膜,包括瓣膜增厚和瓣膜结节。

图 1 2017年7月17日急诊心电图
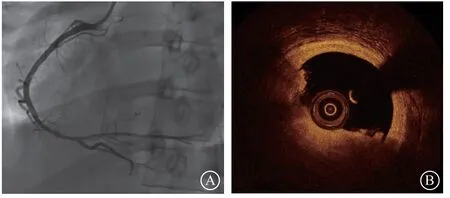
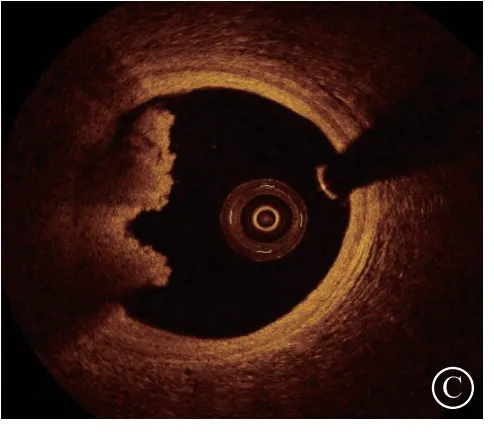
图 2 冠状动脉造影和光学相干断层成像(OCT)影像 A.冠状动脉造影可见右冠状动脉全程多发血栓影;B~C.OCT显示右冠状动脉远段管腔内可见大量血栓
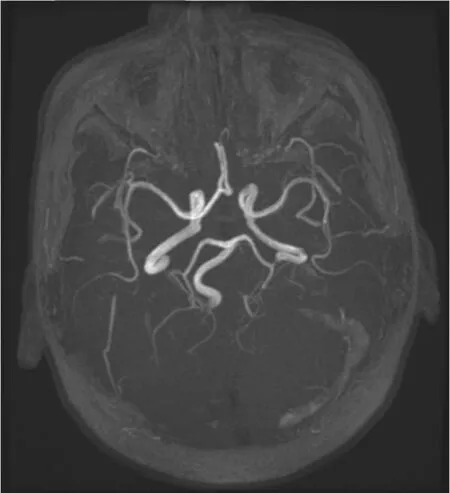
图 3 头核磁血管成像显示乙状窦血栓(箭头所示)
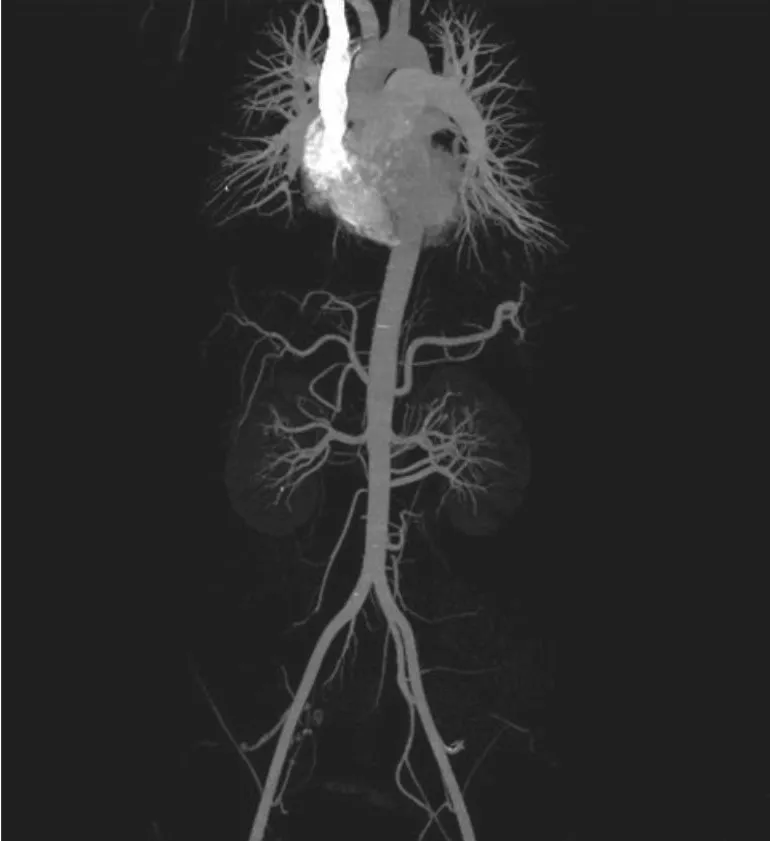
图 4 主动脉CT血管成像显示右髂内动脉闭塞(箭头所示)
APS的发病机制可能是由于aPL对凝血途径产生的多种作用,包括其作用于蛋白C、膜联蛋白V、血小板、血清蛋白酶、Toll样受体、组织因子以及通过受损的纤维蛋白溶解产生的促凝作用[4]。除了增加血栓形成风险,aPL还会增加血管张力,从而增加病理妊娠和神经系统损伤的易感性[5]。而aPL产生的原因目前还不太清楚,可能在某些基础疾病(如系统性红斑狼疮)或者感染后出现。本例患者的治疗方面主要是急性血栓的处理及长期的血栓二级预防。入院后给予患者低分子肝素抗凝及抗血小板治疗后,患者胸痛及头痛症状好转,考虑临床治疗有效。同时患者原发性APS诊断明确,临床存在多发动静脉血栓,需要行长期的血栓二级预防治疗,根据指南予以低剂量阿司匹林+标准强度华法林维持(INR 2.0~3.0)治疗。对原发性APS的治疗主要是对症处理、防止血栓和流产再发生,一般不需用激素或免疫抑制剂治疗。而继发性APS,如继发于系统性红斑狼疮或伴有严重血小板减少等特殊情况,可考虑激素或免疫抑制剂治疗。抗栓治疗主要应用于aPL阳性伴有血栓的患者,或aPL阳性又有反复流产史的孕妇。对无症状的aPL阳性患者不宜进行抗栓治疗[6-7]。
本例患者以典型的急性心肌梗死表现起病,但是患者为青年,而且存在其他系统受累表现,提示背后可能存在某个系统性疾病。进一步检查证实全身多发动静脉血栓,随后完善APS相关抗体筛查后明确诊断。APS是一种临床罕见疾病,经过仔细的病史采集和辅助检查,能够早期诊断、早期治疗,才能给患者带来更好的预后。

