基于地衣芽孢杆菌表达系统搭建左旋多巴新合成体系
李乐云,李由然,许银彪,张梁,顾正华,丁重阳,石贵阳*
1(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
左旋多巴(3,4-dihydroxylphenylalanine,L-DOPA)是一种人体内L-酪氨酸(L-tyrosine, Tyr)的氨基酸类似物,是多巴胺、黑色素、生物碱等许多物质的前体,是治疗帕金森病的特效药[1-3]。目前合成L-DOPA的方法主要有化学合成法[4]、植物提取法[5]和酶催化法[6-7]。化学合成法多以香草醛和乙内酰脲为原料,经过8步反应得到L-DOPA[4],过程复杂且对应选择性低,不符合绿色生产的发展趋势。植物提取法的主要原材料是猫豆[5],但是其中L-DOPA含量最高仅有9%,原料来源限制难以满足市场需求。酶催化法是一种环境友好、简便高效的新型合成途径,受到越来越多的关注[7]。
目前用于催化合成L-DOPA的酶主要有4种:酪氨酸酚解酶[8-10]、4-羟基苯乙酸酯3-单加氧酶(4-hydroxyphenylacetate 3-monooxygenase, 4HPA3H)[11]、酪氨酸酶[12]以及酪氨酸羟化酶(tyrosine hydroxylase, TH)[13-14]。酪氨酸酚解酶以邻苯二酚、氨水以及丙酮酸为底物合成L-DOPA,其中邻苯二酚是一种蛋白质变性剂,可导致酪氨酸酚解酶发生不可逆失活[15-16]。4HPA3H、酪氨酸酶、酪氨酸羟化酶均以L-Tyr为底物催化合成L-DOPA。4HPA3H是一种由hpaB,hpaC基因编码的双组分酶,催化过程需要一种膜相关的细胞色素P450酶,而该酶很难在原核系统中功能表达[17]。酪氨酸酶具有单酚氧化酶和二酚氧化酶作用,前者将L-Tyr羟基化合成L-DOPA,后者可将L-DOPA氧化为多巴醌,进一步转化为黑色素,对L-DOPA产物得率有较大影响。TH是一种以四氢生物蝶呤(tetrahydrobiopterin, BH4)和Fe2+为辅因子的单加氧酶,在L-Tyr的邻位羟基化,不具有二酚氧化酶活性[18],减少了L-DOPA的氧化,应用前景较好。
目前关于TH的研究主要集中于昆虫和哺乳动物来源[19],随着基因数据库以及基因合成技术的发展,酶基因挖掘更加快捷和可靠。通过筛选不同来源的TH基因,分析其保守序列及催化机制,对拓展酶催化法合成L-DOPA具有重要意义。其中筛选出稳定高效的TH基因以及实现辅因子BH4的供给是L-DOPA合成中的主要限制因素。
Bacilluslicheniformis是一种重要的工业生产菌株,具有酶系丰富、产酶量高、耐热、代谢改造可积累L-Tyr等诸多优点[20],同时也是一种食品安全级(generally recognized as safe, GRAS)菌株[21]。值得注意的是,地衣芽孢杆菌存在BH4前体物质6-丙酮酰四氢蝶呤的合成途径,仅需一步墨蝶呤还原酶催化即可获得BH4,为基于B.licheniformis表达系统过表达TH合成L-DOPA奠定基础(https://www.genome.jp/kegg/pathway.html)。作为GRAS工业菌株,B.licheniformis生产的L-DOPA具有更广阔的应用前景,目前尚未有利用B.licheniformis合成L-DOPA的报道。
本研究通过生物信息学方法基于动物来源的TH基因保守序列分析,挖掘到StreptosporangiumroseumDSM 43021来源TH基因(srth),利用B.licheniformis表达系统其进行胞内外的重组表达,并结合本实验室保藏的墨蝶呤还原酶重组菌以L-Tyr为底物进行全细胞转化,并对TH功能及催化过程进行初步探究。构建B.licheniformis的L-DOPA合成体系,为基于GRAS菌株酶催化法合成L-DOPA的工业应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用菌株和质粒见表1。

表1 本研究所用的菌株及质粒Table 1 Strains and plasmids used in this study
1.1.2 主要试剂
限制性核酸内切酶(NdeI,NheI,KpnI,SalI)、T4DNA连接酶,美国Thermo Fisher;2×TaqPCR Master Mix、2×PfuPCR Master Mix,杭州宝赛公司;质粒DNA提取试剂盒、DNA纯化试剂盒、DNA凝胶回收试剂盒,康宁生命科学有限公司(上海);卡那霉素、氨苄青霉素、四环素,Sigma公司;L-Tyr、L-DOPA、BH4,生工生物工程(上海)股份有限公司;蛋白胨、酵母粉、琼脂粉,英国OXOID公司;其他试剂均为国产或进口分析纯。
1.1.3 培养基及培养条件
LB培养基 (g/L): 蛋白胨10,酵母粉5,NaCl 10,LB固体培养基另加入质量分数2%的琼脂粉。
发酵培养基I (g/L): 乳糖 30,蛋白胨12,酵母粉24,甘油 5,K2HPO4·3H2O 16.43,KH2PO42.3,pH 7.0。
发酵培养基II (g/L): 葡萄糖 30,蛋白胨FP321 20,酵母粉FM408 10,玉米浆干粉 5,K2HPO4·3H2O 9.12,KH2PO41.36,无水CaCl20.50,MgSO4·7H2O 0.50,(NH4)2HPO410。
发酵培养条件I:
种子培养:接1环平板活化后的单菌落至LB培养基,添加终浓度为30 μg/mL卡那霉素,37 ℃、250 r/min 摇床培养12~16 h。
发酵培养:将种子液按照体积分数3%接种量转接至30 mL发酵培养基I,加入终浓度为30 μg/mL卡那霉素,37 ℃、250 r/min摇床培养48 h。
发酵培养条件II:
种子培养:接1环平板活化后的单菌落至LB培养基,添加终浓度为20 μg/mL四环素,37 ℃、250 r/min 摇床培养12~16 h。
发酵培养:按照体积分数3%接种量将种子液转接至30 mL发酵培养基II,加入终浓度为20 μg/mL四环素,于37 ℃、250 r/min 摇床培养8~12 h至OD600为0.4~0.6,加入体积分数1.5%D-山梨醇诱导,于28 ℃、250 r/min摇床诱导36 h。
1.2 实验方法
1.2.1 氨基酸序列分析
依据NCBI数据库中Streptosporangiumroseum来源的TH氨基酸序列(登录号:ACZ90985.1),利用ExPASy ProtParam、ProtScale、Compute pI/Mw在线工具分析编码蛋白分子质量、等电点、氨基酸组成、疏水性能、不稳定指数等;进一步在NCBI数据库获得动物来源及其他微生物来源的TH氨基酸序列,利用DNAMAN进行序列比对和保守序列分析;最后利用MEGA 6.0 绘制系统进化树,分析同源性。
1.2.2 重组TH表达质粒的构建
依据B.licheniformis密码子偏好性优化合成srth,以合成的基因为模板,利用SnapGene软件设计2对引物,第一对引物两端引入酶切位点NdeI、NheI以及保护碱基,在后引物前端引入His标签;第二对引物两端引入酶切位点KpnI、SalI以及保护碱基,2对引物序列及酶切位点见表2。利用合成的引物扩增基因序列,扩增的基因序列回收之后加A尾后,再连接至pMD19-T载体上,命名为pMD19-T-srth1、pMD19-T-srth2,连接产物转入感受态JM109。测序正确后用NdeI和NheI同时酶切pMD19-T-srth1和pMA5载体,用KpnI和SalI同时酶切pMD19-T-srth2和pHY载体,酶切后回收目的片段SrTH1、线性化的pMA5、srth2和线性化的pHY。按照基因和载体摩尔质量比3∶1的比例各配制连接体系10 μL,在16 ℃干式恒温器中过夜连接。将连接产物pMA5-srth、pHY-srth转入JM109,分别命名为Eco/pMH、Eco/pHH,涂布氨苄青霉素抗性平板,挑取转化子、提取质粒,经单双酶切验证正确后,将2个重组质粒采用电转化的方法转入表达宿主B.licheniformis9945a,分别命名为Bl/pMH(胞内表达)、Bl/pHH(胞外表达)。Bl/pMH涂布卡那霉素抗性平板,Bl/pHH涂布四环素抗性平板,挑取转化子、提取质粒,经酶切验证及测序正确后,保藏菌种。

表2 构建TH表达质粒所用引物Table 2 Primers for the construction of plasmids carrying tyrosine hydroxylase
注:下划线为酶切位点
1.2.3 重组SrTH的表达和纯化
1.2.3.1 SrTH的表达
SrTH重组菌Bl/pMH(胞内表达)按照发酵培养条件I培养48 h后4 ℃、12 000 r/min离心10 min收集细胞,50 mmol/L磷酸钠缓冲液(pH 7.0) 洗涤细胞2次,缓冲液重悬细胞至OD600为10,加入溶菌酶于37 ℃培养箱反应30 min后超声破碎菌液,离心得到的上清液即为粗酶液。Bl/pHH菌株(胞外表达)在发酵培养基II中诱导结束后,4 ℃、12 000 r/min离心10 min,上清液即为粗酶液。
1.2.3.2 SrTH粗酶液的纯化
(1)浓缩:粗酶液置于-70 ℃冷冻后,于冷冻干燥机中冻干,用50 mmol/L磷酸钠缓冲液(pH 7.0)重悬,使粗酶液浓缩10倍。
(2)(NH4)2SO4沉淀:在冰浴状态下缓慢加入饱和(NH4)2SO4溶液,至(NH4)2SO4质量浓度为500 g/L,边加边搅拌使其在酶液中快速混合均匀,然后将溶液磁力搅拌6 h,使蛋白质充分沉淀。
(3)重悬沉淀:4 ℃、12 000 r/min离心10 min收集沉淀部分,用等体积50 mmol/L磷酸钠缓冲液(pH 7.0)重悬。
(4)透析:将重悬液放入透析袋中透析24 h,每隔6 h更换透析液除去(NH4)2SO4,收集透析后溶液,离心留上清液,透析液为20 mmol/L磷酸钠缓冲液(pH 7.0)。
(5)镍柱亲和层析:①40 mL结合缓冲液平衡镍柱,流速2 mL/min;②上样,流速1 mL/min;③40 mL结合缓冲液洗脱杂蛋白,流速2 mL/min;④100 mL解析缓冲液梯度洗脱重组蛋白,分别设置咪唑浓度为200、300、500 mmol/L三个梯度,流速2 mL/min。收集蛋白峰,将纯化后样品进行SDS-PAGE分析。其中,结合缓冲液: Tris-HCl (pH 7.4) 25 mmol/L、NaCl 0.5 mol/L;解析缓冲液: Tris-HCl (pH 7.4) 25 mmol/L、NaCl 0.5 mol/L、咪唑500 mmol/L。
1.2.4 全细胞转化
TH重组菌Bl/pMH与墨蝶呤还原酶重组菌Bl/pMF分别在发酵培养基I中发酵结束后检测OD600,然后于4 ℃、12 000 r/min离心10 min,收集菌体,用50 mmol/L磷酸钠缓冲液(pH 7.0)洗涤细胞2次,再用缓冲液重悬菌体至菌体浓度OD600为20。将重悬后的Bl/pMH与Bl/pMF按照1∶1的菌体浓度比例混合,加入2 g/LL-Tyr,在37 ℃、250 r/min进行全细胞转化36 h。以等菌体浓度的Bl/pMA、Bl/pMH和Bl/pMF菌株单独转化为对照。
1.2.5 酶活力检测
TH酶活力检测方法参考VERMEER等[22]的方法,稍作修改。
样品检测:①将酶液与终浓度为0.25 mmol/L的BH4、2.5 μmol/L Fe2+混合,冰浴10 min;②加入L-Tyr,37 ℃反应20 min;③加入终浓度为2 mmol/L的高碘酸钠,混匀后常温反应10 min,酶标仪检测37 ℃、475 nm的吸光值。总反应体系为200 μL。
标准曲线测定:用50 mmol/L磷酸钠缓冲液配制一系列不同浓度的L-DOPA标准样品与2 mmol/L高碘酸钠混合液,相同条件下反应10 min,检测475 nm下的吸光值,绘制标准曲线(y=0.000 4x+0.014 6,R2=0.99。式中,y,A475nm;x,L-DOPA浓度,μmol/L)。
酶活力定义:每1 min生成1 nmolL-DOPA所需的酶量为1个酶活力单位,记为U:
(1)
式中:ρ,L-DOPA质量浓度,g/L;V,酶反应体系体积,L;M,L-DOPA相对分子质量,197.19;t,反应时间,min。
1.2.6L-DOPA[23]与BH4[24]检测
样品经三氯乙酸沉淀,4 ℃、12 000 r/min离心10 min,取上清液进行HPLC测定。HPLC液相检测条件如下:
L-DOPA:色谱柱(4.6 mm×250 mm,XSelect®HSS T3,Japan);柱温30 ℃;波长280 nm;流动相为0.08%甲酸/乙腈;流速1 mL/min。配制一系列浓度的L-DOPA标准样品,在相同条件下检测,以确定出峰时间并制作峰面积-浓度的标准曲线(y=27.6x,R2=0.999。其中:y,峰面积,μAU·s;x,L-DOPA浓度,μmol/L)。
BH4:色谱柱(4.6 mm×250 mm,XSelect®HSS T3,Japan);柱温40 ℃;波长246 nm;流动相为30 mmol/L乙酸钠,体积分数3%甲醇;流速:1 mL/min。配制一系列浓度的BH4标准样品,在相同条件下检测,以确定出峰时间并制作峰面积-浓度的标准曲线(y=27.697x+0.809,R2=0.99。其中:y,峰面积,mAU·min;x,BH4浓度,mmol/L)。
1.2.7 TH催化过程探究
将酶液与终浓度为0.3 mmol/L的BH4、2.5 μmol/L Fe2+混合,冰浴10 min;加入一定浓度的L-Tyr,置于37 ℃培养箱反应,每隔10 min取样。样品加入终体积分数为5%的三氯乙酸,在4 ℃放置3 h,然后4 ℃、12 000 r/min离心10 min取上清液,进行HPLC测定。
2 结果与讨论
2.1 TH的氨基酸序列分析
在B.licheniformis中构建L-DOPA合成途径的关键是筛选出合适的TH基因。本研究选择Streptosporangiumroseum来源的TH基因,并对其进行氨基酸序列分析。查找NCBI数据库可得,srth全长894 bp,编码297个氨基酸残基。通过ExPASy在线工具分析可知,srth基因编码的SrTH蛋白分子式为C1511H2311N411O445S5,预测分子质量约为33.5 kDa,等电点为5.00。在组成SrTH蛋白的所有氨基酸中,丙氨酸(Ala) 比例最高,占氨基酸总量的11.8%;其次是亮氨酸(Leu),占氨基酸总量的10.1%;半胱氨酸(Cys)比例最低,仅为总氨基酸量的0.3%;带负电荷残基总数(Asp+Glu)为46个,带正电残基总数(Arg+Lys)为28个;脂肪族氨基酸指数90.40,亲水性的总平均值为-0.208,属于亲水性蛋白;计算失稳指数(II)为35.62,归类为稳定蛋白质。
为了解SrTH与动物来源TH的亲缘关系,在NCBI数据库下载获得不同微生物及动物来源TH氨基酸序列,利用MEGA 6.0 绘制了TH系统进化树(图1)。由进化树分析发现,微生物来源和动物来源的TH在进化树中各自聚集在一起,SrTH与TbTH(ThermobisporabisporaDSM 43833)的进化距离最近,与动物来源的TH较远,与人类来源的TH进化距离最远,因此难以断定该基因是否具有与动物来源基因相同的生物学功能,有必要进行氨基酸序列比对,根据保守性初步判定其是否具备催化L-Tyr合成L-DOPA的功能。因此,利用DNAMAN进行氨基酸序列比对分析(图2)。
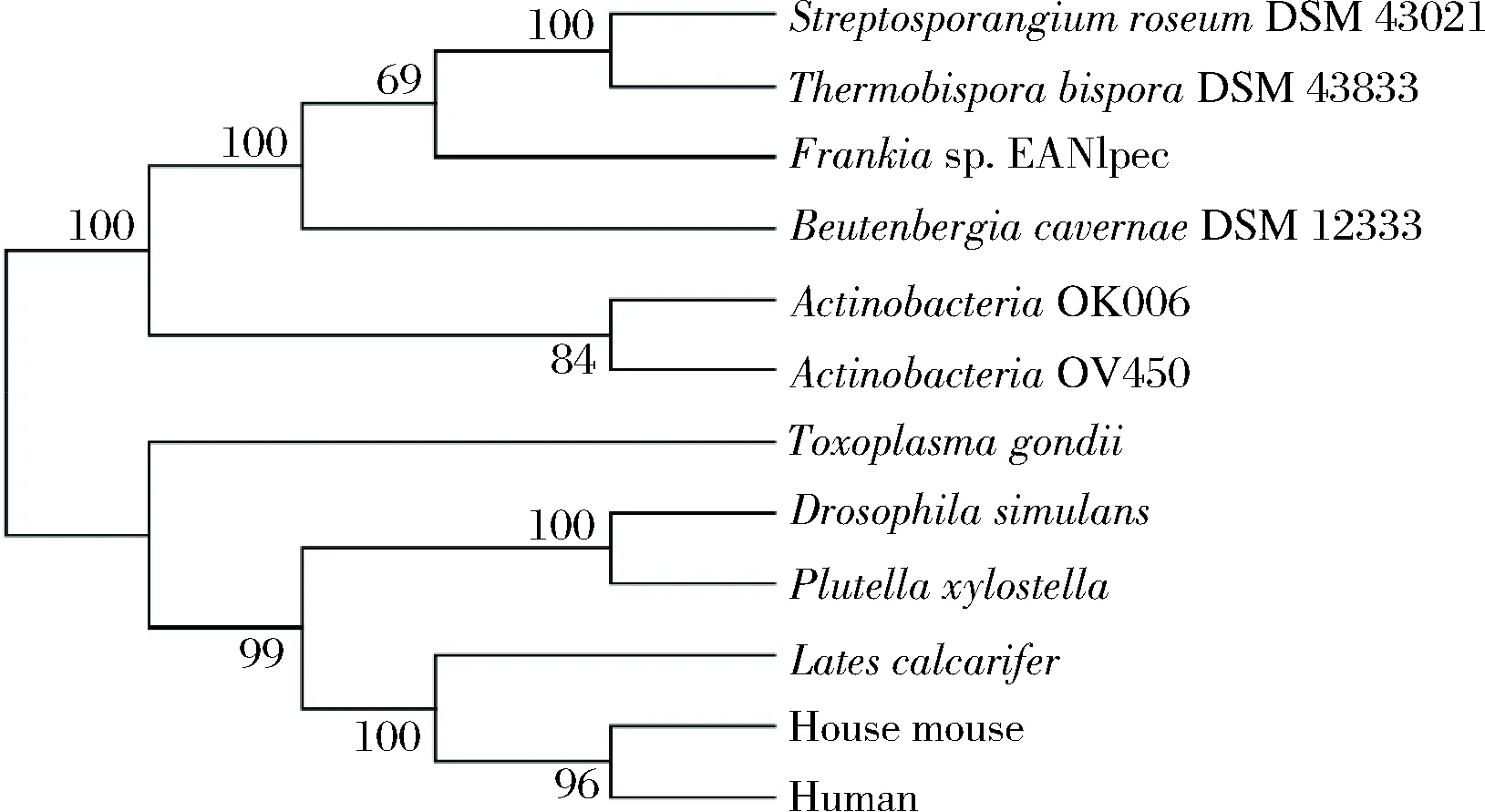
图1 SrTH与其他来源的TH的系统进化树Fig.1 Phylogenetic tree of SrTH and TH from other sources
研究表明,动物来源TH的活性受到N端的Ser19、Ser31、Ser40的磷酸化调节,具有铁原子和底物蝶呤结合的氨基酸残基[25-27]。根据氨基酸序列比对分析发现,SrTH中存在参与铁元素结合的保守氨基酸残基His162、His167和Glu208以及参与底物喋呤结合氨基酸残基Gly124、Leu126、Phe131、Glu163和 Glu208,与家蚕来源的TH一致[27]。此外,比对发现微生物来源与动物来源的TH在参与底物喋呤结合的氨基酸残基区域存在一定差异(动物来源TH:Leu125、Tyr203;微生物来源TH:Val125和Phe203)。该差异残基是否影响对酶与底物喋呤亲和力,需进一步验证。

“▲”、“★”分别表示与铁离子和底物蝶呤结合的保守氨基酸残基图2 SrTH与其他来源的TH氨基酸序列比对Fig.2 Comparison of the amino acids sequences ofSrTH and TH from other sources
以上研究表明,SrTH与动物来源TH存在基本一致的底物结合位点,具备基于B.licheniformis表达系统合成L-DOPA的功能基础,接下来将SrTH在B.licheniformis中异源表达验证其酶功能。
2.2 SrTH重组表达菌构建
按照1.2.2的方法构建TH重组质粒pMA5-srth、pHY-srth,重组质粒的大小分别为7 954、6 314 bp;将2个重组质粒分别用NdeI、NheI和KpnI、SalI双酶切。Bl/pMH酶切后理论条带大小是912和7 042 bp,Bl/pHH酶切后理论条带大小是894和5 420 bp,结果如图3所示,电泳条带大小与理论值一致,说明TH重组质粒pMA5-srth、pHY-srth构建成功。
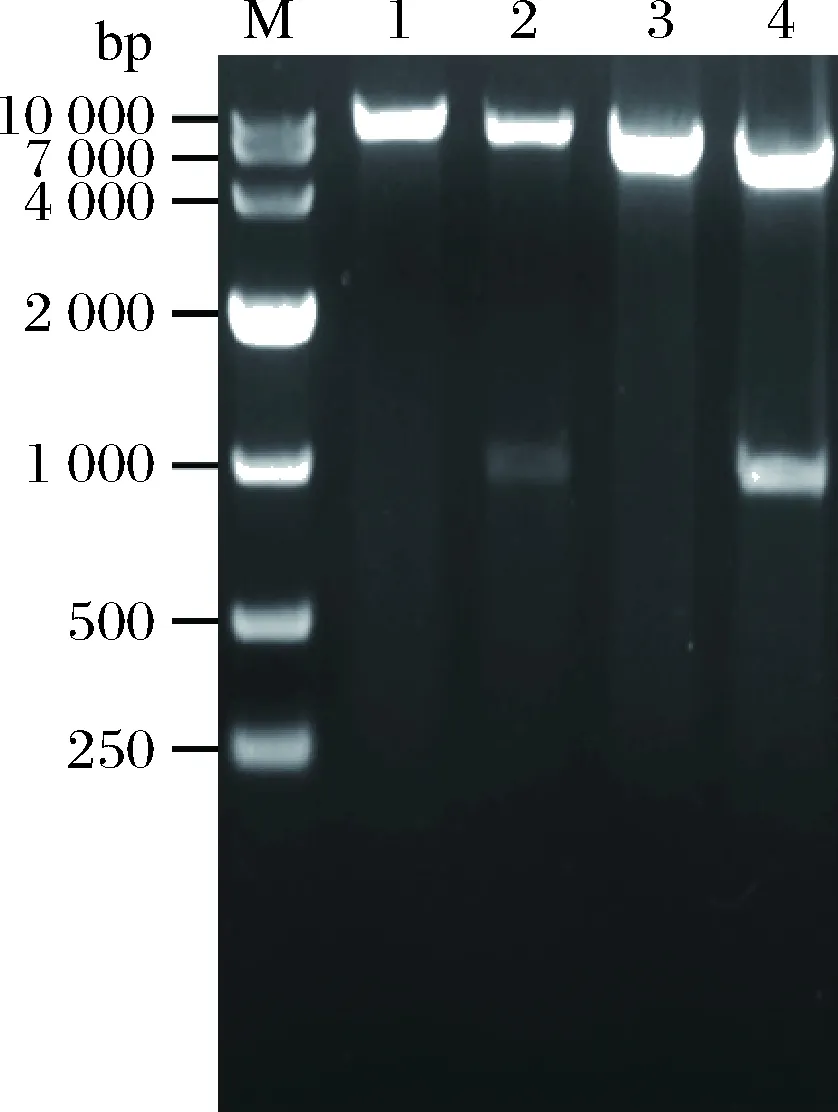
M-DNA marker;1~2-重组质粒pMA5-srth单、双酶切;3~4-重组质粒pHY-srth单、双酶切图3 重组质粒pMA5-srth、pHY-srth单双酶切验证Fig.3 Verification of recombinant plasmids pMA5-srthand pHY-srth through enzyme digestion reactions
2.3 地衣芽孢杆菌中TH功能探究
2.3.1 胞内酶活力的测定
将对照菌Bl/pMA及重组表达菌株Bl/pMH按1.2.3分别进行摇瓶发酵。按照1.2.5酶活性检测方法检测粗酶液酶活力。结果显示,空载菌株Bl/pMA未检测到酶活力,重组菌株Bl/pMH胞内检测到酶活力。以Bl/pMA为空白对照,重组表达菌株Bl/pMH胞内粗酶酶活性为30.7 U/mL。由此可知,酪氨酸羟化酶SrTH可在B.licheniformis中正常表达并具有酶活力。然而其是否具有生物学功能,有待进一步验证。
2.3.2 全细胞转化
如图4所示,在B.licheniformis中,L-DOPA的合成在TH、L-Tyr、辅因子BH4的共同参与下完成。由于B.licheniformis自身基因组中存在从GTP合成BH4前体的代谢途径,通过表达墨蝶呤还原酶即可实现BH4的合成。因此,在底物L-Tyr的存在下,只需提供墨蝶呤还原酶即可在重组菌Bl/pMH中实现L-DOPA合成。将酪氨酸羟化酶重组菌Bl/pMH与墨蝶呤还原酶重组菌Bl/pMF进行混合,便可直接快速高效地利用全细胞联合催化合成L-DOPA。
将Bl/pMH与Bl/pMF菌株混合,以L-Tyr为底物进行全细胞联合转化,并与空载及Bl/pMH、Bl/pMF单独转化进行对照,结果如图5所示。
全细胞转化36 h后,Bl/pMH与Bl/pMF全细胞联合转化反应体系变成黑色,而在相同的培养条件下,空载及Bl/pMH、Bl/pMF的全细胞转化反应液未发生颜色变化(图5-a)。

虚线方内框为B. licheniformis中BH4前体物质6-丙酮酰四氢蝶呤合成途径图4 地衣芽孢杆菌中TH催化L-Tyr合成L-DOPA途径Fig.4 The biosynthesis of L-DOPA via L-tyrosine catalyzed by tyrosine hydroxylase in B. licheniformis
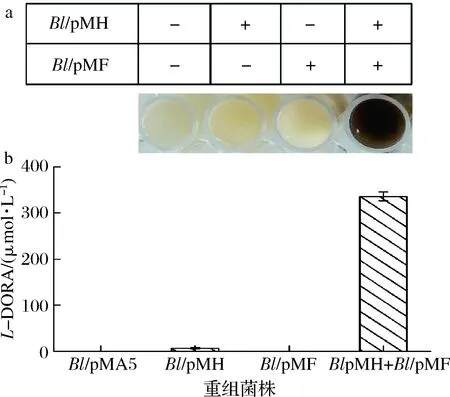
a-L-DOPA的氧化;b-L-DOPA的液相检测图5 不同重组菌株的全细胞转化Fig.5 Whole-cell biotransformation of differentrecombinant strains
由于L-DOPA很容易被氧化成多巴醌并进一步氧化成黑色素[28],因此我们推断,B.licheniformis中srth基因成功表达,并在墨蝶呤还原酶的存在下,实现L-DOPA积累,并一定程度上被空气氧化为黑色素[30],使得发酵液变为黑色。
进一步将发酵液进行HPLC检测,结果如图5-b所示。空载菌株Bl/pMA5、Bl/pMF单独全细胞转化均没有L-DOPA产生,Bl/pMH与Bl/pMF全细胞联合转化后L-DOPA产量为335.92 μmol/L。分析其原因是B.licheniformis具有从GTP合成BH4前体6-丙酮酰四氢蝶呤的代谢途径,墨蝶呤还原酶的过表达成功催化前体6-丙酮酰四氢蝶呤合成BH4,为TH催化L-Tyr合成L-DOPA提供了辅因子。同时,该结果说明BH4在TH催化L-Tyr合成L-DOPA过程中至关重要,这与文献报道相一致[29]。在不存在BH4下,SrTH可以催化L-Tyr合成少量L-DOPA,具体原因有待进一步研究。
由以上结果可知,在墨蝶呤还原酶重组菌Bl/pMF辅助下,SrTH在B.licheniformis中具有催化L-Tyr合成L-DOPA的能力。但是催化过程中底物L-Tyr与辅因子BH4需求量及消耗比例尚不可知,后续使用纯化后SrTH对底物与辅因子比例进行初步探索,为后期B.licheniformis“从头”合成L-DOPA代谢改造奠定基础。
2.4 地衣芽孢杆菌中TH的分离纯化与酶活性分析
为了更加清晰明了表达后的SrTH酶催化过程底物与辅因子的消耗比例关系,选择用纯化后的酶进行探究。为便于酶的分离纯化和酶活性分析,选择重组菌Bl/pHH进行胞外表达。将按照1.2.3获得纯化后的SrTH蛋白。将纯化后酶液进行SDS-PAGE,结果如图6所示。

M-蛋白质marker;1-空载Bl/pHY;2-Bl/pHY-srth纯化后重组蛋白图6 重组蛋白SrTH SDS-PAGE结果Fig.6 SDS-PAGE results of recombinant protein SrTH
在35 kDa位置有目的蛋白条带,与SrTH预测分子质量33.5 kDa相符,获得了纯度较高的目的蛋白,可用于进一步研究。
将目的蛋白经镍柱亲和层析纯化并收集洗脱组分进行透析复性,结果如表3所示。SrTH蛋白酶活力为22.79 U/mL,总酶活力为113.94 U,回收率为10.67%,比酶活力为70.77 U/mg,纯化倍数达33.38。相比于桂江[19]在大肠杆菌中异源表达家蚕来源TH基因,同样以L-Tyr为底物,仅获得0.13 U/mg的比酶活力,SrTH蛋白具有较好的表现。

表3 酶纯化过程中酶活力及蛋白浓度Table 3 Enzyme activities and protein concentrationsduring purification proces
2.5 TH催化过程探究
在TH转化L-Tyr合成L-DOPA过程中,L-Tyr在BH4存在下转化为L-DOPA,同时BH4参与反应后转化为4a-OH-BH4[30],因此若要实现B.licheniformis中TH转化L-Tyr合成L-DOPA过程的持续进行,保证L-Tyr与BH4的充足供给,有必要探究催化过程中底物L-Tyr与辅因子BH4的消耗比例。利用纯化后的SrTH和商业来源的BH4标准样品设计酶反应实验。对酶反应过程中L-Tyr、L-DOPA、BH4以及4a-OH-BH4的变化情况进行分析。结果如图7所示。

图7 SrTH催化L-Tyr合成L-DOPA过程图Fig.7 The process of the synthesization for L-DOPAvia L-tyrosine catalyzed by SrTH
从图7可以看出,随着反应的进行,底物L-Tyr与辅因子BH4不断被消耗,产物L-DOPA与4a-OH-BH4逐渐增多。在0~20 min内,L-Tyr浓度迅速由1 681 μmol/L降至1 498 μmol/L,随后基本不再变化,L-DOPA逐渐积累至13 μmol/L,20 min后出现略微降低,这是因为L-DOPA在空气中不稳定,逐渐被氧化为黑色素导致的[28]。同时观察到BH4由302 μmol/L降至较低水平,在30 min时已基本检测不到,因此推测是辅因子BH4不足导致反应无法继续进行。在第40 min补加BH4至728 μmol/L,L-Tyr在10 min内减少了145 μmol/L,证明辅因子BH4是限制酶反应进行的重要因素;60~70 min 反应逐渐停止,该阶段L-DOPA 最高积累量为25 μmol/L。然而此时酶反应体系尚存在BH4,我们猜测反应的停止是酶量不足所致。因此酶反应80 min同时补加酶液和BH4,L-Tyr在30 min内减少量为224 μmol/L,L-DOPA增加量为20 μmol/L,BH4减少量为437 μmol/L。由此可知,BH4是酶反应进行的重要限制性因素,通过补充BH4和酶液可以使反应持续进行,计算可知L-Tyr的消耗量与辅因子BH4的需求量之比约为1∶2。同时,根据酶反应的结果推测,全细胞转化中Bl/pMF合成的BH4在 TH的催化过程中也可能是不充足的。
3 结论
本研究通过生物信息学方法筛选出一种具有底物保守结合位点的微生物来源TH基因,在B.licheniformis中成功表达,胞内外酶活性分别为30.7和22.79 U/mL。进一步通过B.licheniformis重组菌(Bl/pMH与Bl/pMF)全细胞转化法成功实现L-DOPA的积累。其次,通过在TH/墨蝶呤还原酶催化Tyr合成L-DOPA过程中进行辅因子补给,我们得出L-DOPA合成过程中底物L-Tyr与四氢生物蝶呤之间供给比例关系,为后续TH法催化L-Tyr合成L-DOPA提供可靠的理论支持。

