miR-141-3p靶向CBX1抑制乳腺癌细胞增殖和细胞迁移侵袭
盛树海 郑进 佟易凡 (唐山工人医院乳腺外科,河北 唐山 063000)
乳腺癌是女性常见恶性肿瘤之一,发病率较高〔1〕。手术联合放疗、化疗及内分泌治疗的综合治疗是乳腺癌的主要治疗手段〔2〕;近年来分子靶向药物治疗因其特异性强,毒副作用小,基本上不损伤正常组织等优势得到越来越多的关注,随着药理学和分子生物学的深入研究,靶向药物的研究和应用取得了突破性进展〔3〕。MicroRNA(miRNA)是非编码RNA,可调节基因表达,在细胞分化、发育及凋亡中发挥重要作用。研究表明miRNA在乳腺癌中多种异常表达,其与肿瘤浸润、转移及耐药性有关,可作为早期筛查、诊断和预后评价的生物标志物〔4~6〕。研究发现miR-141-3p在乳腺癌组织和细胞中低表达,下调lncRNA-ATB通过增加miR-141-3p表达可抑制乳腺癌细胞的上皮-间质转化〔7〕。但还未见miR-141-3p对乳腺癌细胞增殖、迁移侵袭影响的报道。
本文旨在研究miR-141-3p与染色体同源物(CBX)1的靶向关系及其对乳腺癌细胞增殖、迁移侵袭的影响。
1 材料与方法
1.1材料 乳腺癌细胞MCF-7、MDA-MB-231、BT474和正常人乳腺上皮细胞株HBL-100购自中国科学院上海细胞库;胎牛血清、RPMI1640培养基、胰蛋白酶购自上海源叶生物科技有限公司;MTT试剂盒购自上海晶抗生物工程有限公司;聚氰基丙烯酸正丁酯(BCA)试剂盒、RIPA蛋白裂解液购自上海沪震实业有限公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;Trizol试剂、反转录试剂盒、荧光定量试剂盒购自北京百奥莱博科技有限公司;Transwell小室、Matrigel胶购于美国BD公司。
1.2方法
1.2.1细胞培养 乳腺癌细胞MCF-7、MDA-MB-231、BT474和正常人乳腺上皮细胞HBL-100培养于RPMI1640培养基(10%胎牛血清)中,放置在37℃、5%CO2培养箱,待细胞融和至80%左右时,加入胰蛋白酶消化传代,取对数生长期细胞进行实验。
1.2.2细胞转染与分组 取对数生长期细胞MDA-MB-231,用无血清培养基同步化12 h,随后进行转染。将miR-con、miR-141-3p、si-con、si-CBX1、anti-miR-con、anti-miR-141-3p分别转染至MDA-MB-231细胞中,记为miR-con组、miR-141-3p组、si-con组、si-CBX1组、anti-miR-con组、anti-miR-141-3p组;将miR-141-3p分别与pcDNA、pcDNA-CBX1共转染至MDA-MB-231细胞中,记为miR-141-3p+pcDNA组、miR-141-3p+pcDNA-CBX1组。未经任何处理的细胞作为空白对照组。
1.2.3实时荧光定量聚合酶链反应(qRT-PCR)检测miR-141-3p和CBX1 mRNA表达水平 将培养24 h后的细胞提取RNA,测定RNA纯度和浓度后反转录成cDNA,按照荧光定量试剂盒说明进行PCR,循环条件为95 ℃变性30 s,60 ℃退火30 s;72 ℃延伸30 s,共40个循环;最后60 ℃延长5 min。相对表达量采用2-△△Ct法计算。miR-141-3p和CBX1分别以U6和β-actin为内参。
1.2.4Western印迹检测蛋白的表达 将培养24 h后的细胞提取总蛋白,测定蛋白浓度,进行十二烷基硫代硫酸钠(SDS)-聚丙烯酰胺凝脉电泳(PAGE),转膜,封闭1 h,加入一抗(1∶1 000),4℃孵育过夜;加入二抗(1∶2 000)室温孵育2 h,暗室曝光显影,定影,Quantity One凝胶软件处理,测定各组蛋白条带的灰度值,以目的条带和β-actin条带的比值作为蛋白表达水平。每个蛋白样品设3个重复。
1.2.5MTT检测细胞增殖 各组细胞培养至24、48、72、96 h时每孔分别加入20 μl MTT溶液,37℃孵育4 h后加入每孔150 μl DMSO,振荡反应10 min,然后将样品放置在酶标仪上,检测490 nm处的吸光度(A)值。细胞活性(%)=实验组A值/空白对照组A值×100%。
1.2.6Transwell检测细胞迁移和侵袭 调整细胞浓度为2×104个/ml。分别取200 μl细胞悬液接种于Matrigel胶包被和未包被的Transwell小室上室中,下室加入培养液,培养24 h后分别用4%多聚甲醛固定和0.1%结晶紫染色,然后在显微镜观察拍照,并随机选取5个视野拍照,结晶紫染色细胞数即为细胞侵袭和迁移数。
1.2.7荧光素酶报告基因检测实验检测miR-141-3p对CBX1的靶向调控 使用PCR扩增包含miR-141-3p结合位点的CBX1序列片段,并构建至荧光素酶表达载体中,获得CBX1野生型载体(WT-CBX1),将circPRKCI序列 CCAAUAGUGUUA突变为GGUCUGUCACAAU,获得CBX1突变型载体(MUT-CBX1),将WT-CBX1、MUT-CBX1分别与miR-con、miR-141-3p用脂质体法共转染至细胞中,转染48 h后,根据双荧光素酶报告基因检测试剂盒说明检测荧光素酶活性。
1.3统计学分析 采用SPSS20.00统计学软件进行t检验、单因素方差分析。
2 结 果
2.1乳腺癌细胞和正常乳腺细胞中miR-141-3p和CBX1的表达 qRT-PCR检测结果显示,与正常乳腺细胞HBL-100相比,乳腺癌细胞MCF-7、MDA-MB-231和BT474中miR-141-3p mRNA表达水平显著降低,CBX1 mRNA的表达水平显著升高(P<0.05),见表1。Western印迹检测结果(图1)显示,与正常乳腺细胞HBL-100相比,乳腺癌细胞MCF-7、MDA-MB-231和BT474中CBX1蛋白的表达水平显著升高(P<0.05)。可见,乳腺癌细胞中miR-141-3p低表达,CBX1高表达。
2.2转染miR-141-3p表达对乳腺癌MDA-MB-231细胞增殖和相关蛋白表达的影响 qRT-PCR检测结果显示,与空白对照组相比,miR-141-3p组乳腺癌细胞中miR-141-3p mRNA的表达水平显著升高(P<0.05)。MTT法检测结果显示,从48 h起,与空白对照组相比,miR-141-3p组乳腺癌细胞活性显著降低(P<0.05)。Western印迹检测结果显示,与空白对照组相比,miR-141-3p组乳腺癌细胞中细胞周期蛋白依赖性激酶(CDK)4和细胞周期蛋白(Cyclin)D1蛋白的表达水平显著降低(P<0.05)。可见,miR-141-3p过表达对乳腺癌MDA-MB-231细胞增殖及相关蛋白CDK4和CyclinD1的表达。见图2,表2。
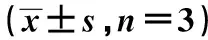
表1 miR-141-3p和CBX1在乳腺癌细胞和正常乳腺细胞中表达比较
与HBL-100组比较:1)P<0.05

1~4:HBL-100、MCF-7、MDA-MB-231、BT474图1 正常乳腺细胞与乳腺癌细胞中CBX1蛋白表达

1~3:空白对照组、miR-con组、miR-141-3p组图2 转染miR-141-3p表达对乳腺癌MDA-MB-231细胞增殖相关蛋白表达的影响

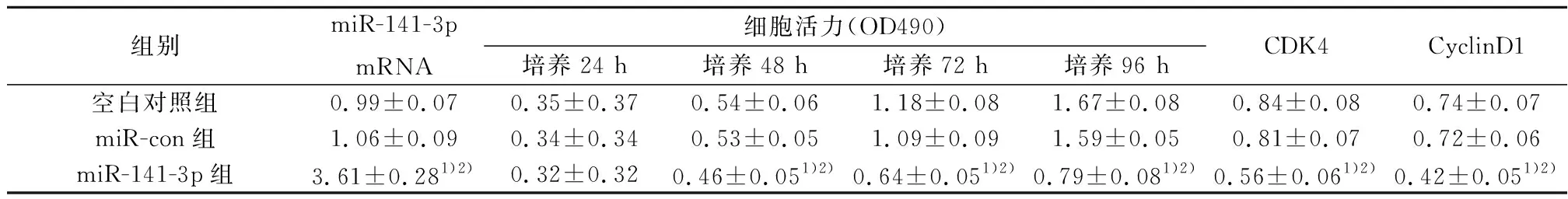
组别miR-141-3p mRNA细胞活力(OD490)培养24 h培养48 h培养72 h培养96 hCDK4CyclinD1空白对照组0.99±0.070.35±0.370.54±0.061.18±0.081.67±0.080.84±0.080.74±0.07miR-con组1.06±0.090.34±0.340.53±0.051.09±0.091.59±0.050.81±0.070.72±0.06miR-141-3p组3.61±0.281)2)0.32±0.320.46±0.051)2)0.64±0.051)2)0.79±0.081)2)0.56±0.061)2)0.42±0.051)2)
与miR-con组相比较:1)P<0.05;与空白对照组比较:2)P<0.05,下表同
2.3转染miR-141-3p表达对乳腺癌MDA-MB-231细胞迁移和侵袭及相关蛋白表达的影响 Transwell 法检测结果(图3)显示,与空白对照组相比,miR-141-3p组乳腺癌细胞迁移和侵袭数量显著降低(P<0.05)。
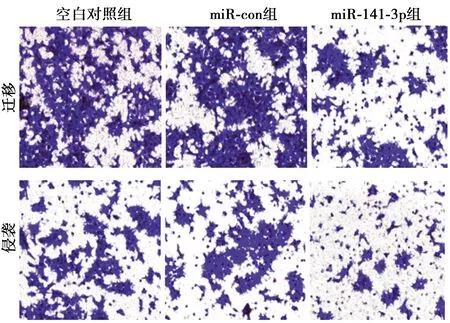
图3 转染miR-141-3p表达对乳腺癌MDA-MB-231细胞迁移和侵袭的影响(结晶紫染色,×200)
Western印迹检测结果(图4)显示,与空白对照组相比,miR-141-3p组乳腺癌细胞中基质金属蛋白酶(MMP)-2和MMP-9蛋白的表达水平显著降低(P<0.05)。可见,miR-141-3p过表达抑制乳腺癌MDA-MB-231细胞迁移和侵袭及相关蛋白MMP-2和MMP-9的表达。见表3。
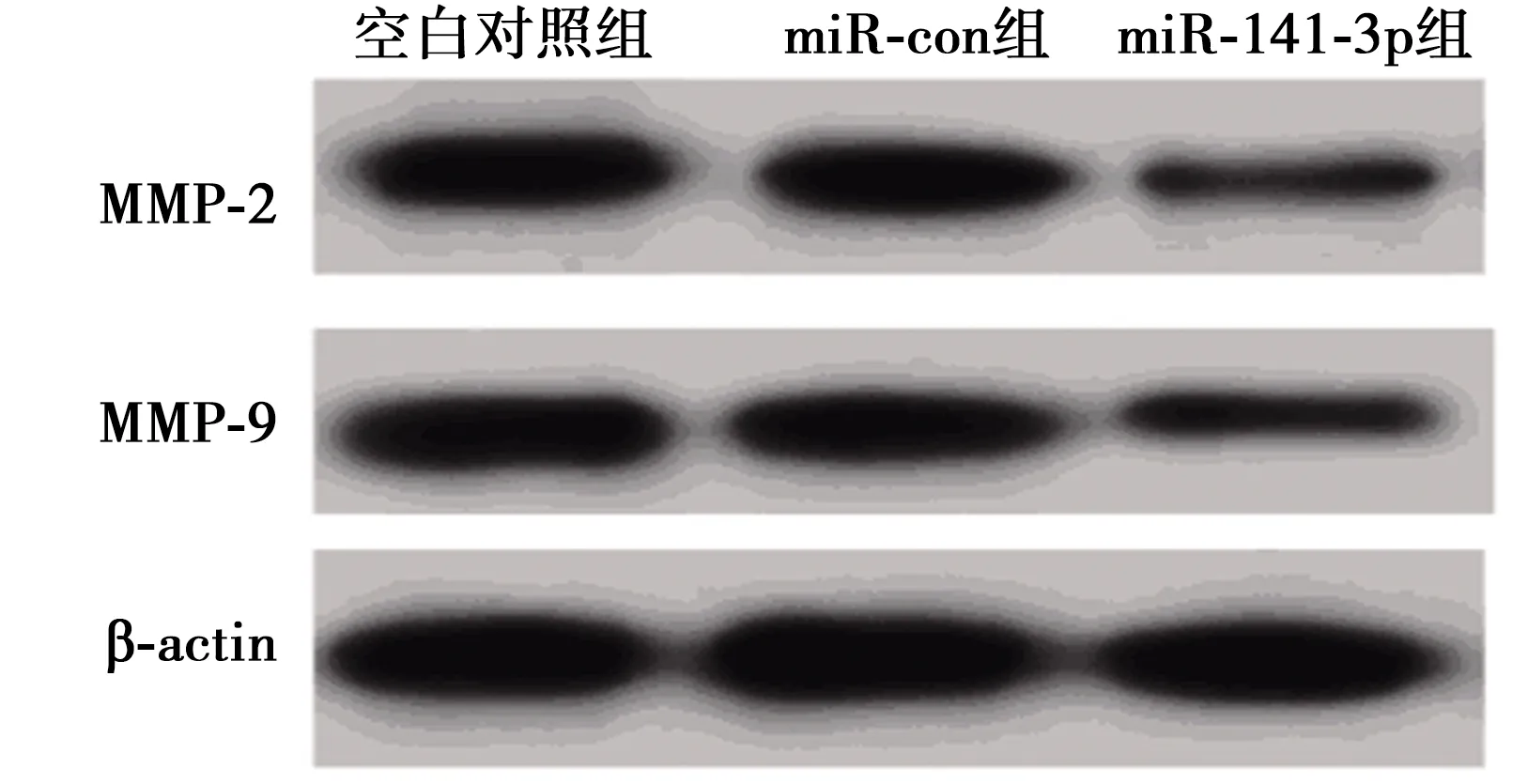
图4 转染miR-141-3p表达对MMP-2、MMP-9蛋白表达的影响
2.4miR-141-3p可以靶向调控CBX1的表达 通过TargetScan数据库预测到CBX1与miR-141-3p存在结合位点(图5)。荧光素酶报告基因检测实验结果显示,转染WT-CBX1基因表达载体后,相较于miR-con组,miR-141-3p组WT-CBX1乳腺癌细胞的荧光素酶活性显著降低(P<0.05);而转染MUT-CBX1基因表达载体后,相较于miR-con组,miR-141-3p组MUT-CBX1乳腺癌细胞的荧光素酶活性差异不显著(P>0.05)。见表4。Western印迹检测结果(图6)显示,相较于miR-con组,miR-141-3p组乳腺癌细胞中CBX1的表达水平显著降低;相较于anti-miR-con组,anti-miR-141-3p组乳腺癌细胞中CBX1的表达水平显著升高(P<0.05)。可见,miR-141-3p可靶向调控CBX1的表达。


组别MMP-2MMP-9细胞迁移数(个)细胞侵袭数(个)空白对照组0.63±0.070.78±0.06125.24±12.5378.74±6.85miR-con组0.59±0.060.75±0.07118.62±10.6784.72±6.64miR-141-3p组0.34±0.051)2)0.37±0.051)2)58.87±4.941)2)37.42±4.561)2)
2.5si-CBX1抑制乳腺癌MDA-MB-231细胞增殖、迁移和侵袭 MTT法检测结果显示,与si-con组相比,从48 h起,si-CBX1组乳腺癌细胞活性显著降低(P<0.05)。Transwell 法检测结果显示,与si-con组相比,si-CBX1组乳腺癌细胞迁移和侵袭数量显著降低(P<0.05),见表5。Western印迹检测结果显示,与si-con组相比,si-CBX1组乳腺癌细胞中CBX1、CDK4、CyclinD1、MMP-2和MMP-9蛋白的表达水平显著降低(P<0.05),见表5,图7。可见,沉默CBX1抑制乳腺癌MDA-MB-231细胞增殖、迁移和侵袭。
2.6过表达CBX1部分逆转miR-141-3p对乳腺癌MDA-MB-231细胞的抑制作用 MTT法检测结果显示,与miR-con组相比,从48 h起,miR-141-3p组乳腺癌细胞活性显著降低;与miR-141-3p+pcDNA组相比,miR-141-3p+pcDNA-CBX1组乳腺癌细胞活性显著升高(P<0.05)。Transwell 法检测结果显示,与miR-con组相比,miR-141-3p组乳腺癌细胞迁移和侵袭数量显著降低(P<0.05);与miR-141-3p+pcDNA组相比,miR-141-3p+ pcDNA-CBX1组乳腺癌细胞迁移和侵袭数量显著升高(P<0.05)。Western印迹检测结果显示,与miR-con组相比,miR-141-3p组乳腺癌细胞中CBX1、CDK4、CyclinD1、MMP-2和MMP-9蛋白的表达水平显著降低(P<0.05);与miR-141-3p+pcDNA组相比,miR-141-3p+ pcDNA-CBX1
组乳腺癌细胞中CBX1、CDK4、Cyclin D1、MMP-2和MMP-9蛋白的表达水平显著升高(P<0.05),见图8、表6。可见,过表达CBX1可部分逆转miR-141-3p对乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭的抑制作用。

图5 miR-141-3p与CBX1的互补序列信息
表4 双荧光素酶实验
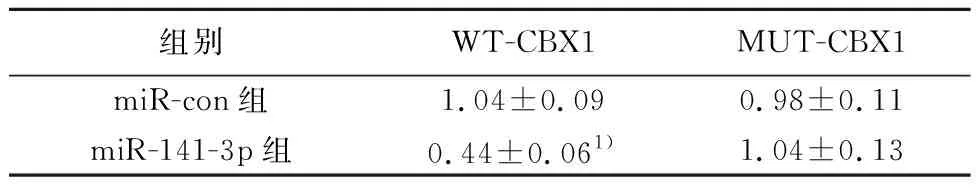
组别WT-CBX1MUT-CBX1miR-con组1.04±0.090.98±0.11miR-141-3p组0.44±0.061)1.04±0.13
与miR-con组比较:1)P<0.05

1~4:miR-con组、miR-141-3p组、anti-miR-con组、anti-miR-141-3p组图6 miR-141-3p调控CBX1蛋白表达

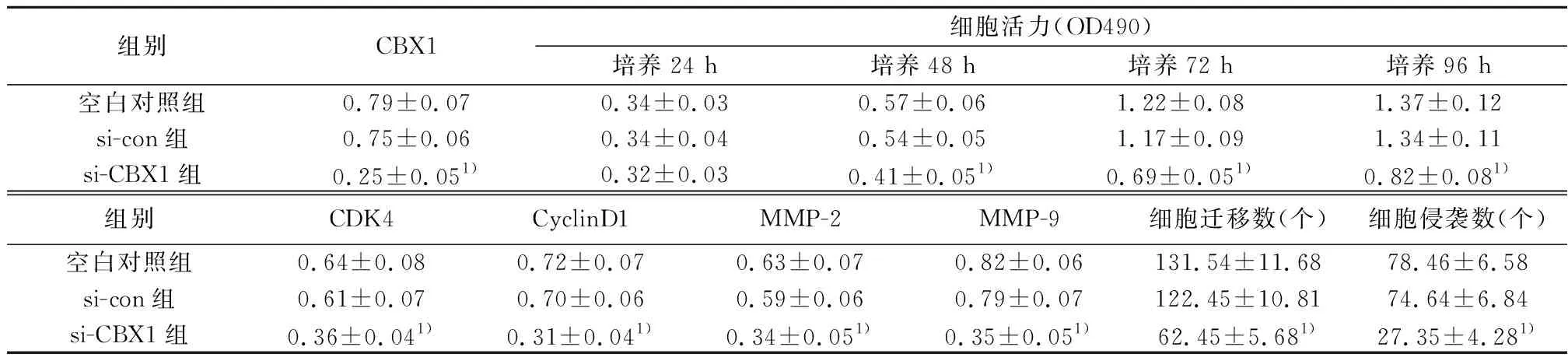
组别CBX1细胞活力(OD490)培养24 h培养48 h培养72 h培养96 h空白对照组0.79±0.070.34±0.030.57±0.061.22±0.081.37±0.12si-con组0.75±0.060.34±0.040.54±0.051.17±0.091.34±0.11si-CBX1组0.25±0.051)0.32±0.030.41±0.051)0.69±0.051)0.82±0.081)组别CDK4CyclinD1MMP-2MMP-9细胞迁移数(个)细胞侵袭数(个)空白对照组0.64±0.080.72±0.070.63±0.070.82±0.06131.54±11.6878.46±6.58si-con组0.61±0.070.70±0.060.59±0.060.79±0.07122.45±10.8174.64±6.84si-CBX1组0.36±0.041)0.31±0.041)0.34±0.051)0.35±0.051)62.45±5.681)27.35±4.281)
与si-con组相比较:1)P<0.05

图7 si-CBX1对乳腺癌MDA-MB-231细胞中相关蛋白表达的影响
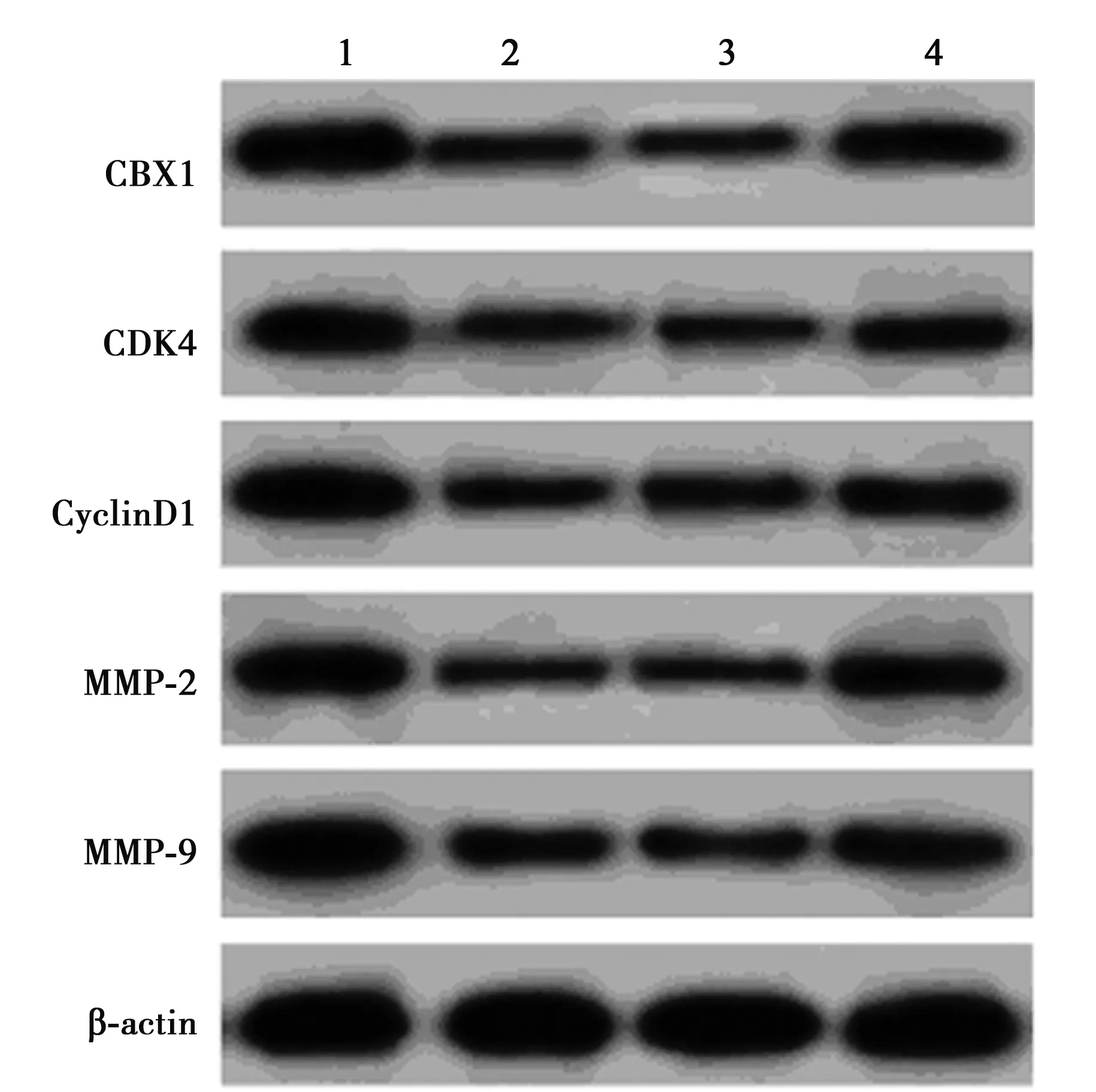
1~4:miR-con组、miR-141-3p组、miR-141-3p+pcDNA组、miR-141-3p+pcDNA-CBX1组图8 过表达CBX1部分逆转miR-141-3p对乳腺癌MDA-MB-231细胞相关蛋白表达的影响


组别CBX1细胞活力(OD490)培养24 h培养48 h培养72 h培养96 hmiR-con组0.76±0.050.35±0.030.59±0.051.23±0.091.39±0.10miR-141-3p组0.41±0.041)0.33±0.030.42±0.041)0.65±0.081)0.77±0.081)miR-141-3p+pcDNA组0.35±0.040.34±0.040.43±0.030.67±0.060.74±0.07miR-141-3p+pcDNA-CBX1组0.59±0.052)0.36±0.040.52±0.052)0.89±0.072)1.12±0.092)组别CDK4CyclinD1MMP-2MMP-9细胞迁移数(个)细胞侵袭数(个)miR-con组0.67±0.080.76±0.070.64±0.070.78±0.06136.87±12.9482.64±6.37miR-141-3p组0.41±0.051)0.42±0.041)0.38±0.051)0.42±0.041)76.37±11.641)28.28±4.461)miR-141-3p+pcDNA组0.38±0.050.40±0.060.39±0.040.39±0.0372.25±10.6724.64±4.84miR-141-3p+pcDNA-CBX1组0.52±0.062)0.61±0.042)0.54±0.052)0.58±0.052)97.28±7.642)52.64±6.672)
与miR-con组比较:1)P<0.05;与miR-141-3p+pcDNA组比较:2)P<0.05
3 讨 论
乳腺癌是威胁女性生命健康的一大恶性肿瘤,新型靶向治疗可以选择性杀死肿瘤细胞,减少对正常细胞的损伤,是当前抗癌研究的热点〔8〕。miRNA广泛参与肿瘤的发生发展过程,与乳腺癌的生物调控过程更是密切相关〔9〕。研究发现miR-141-3p在化疗耐药的上皮性卵巢癌中显著高表达,参与化学耐药过程〔10〕。miR-141-3p在前列腺癌中上调表达,可通过抑制KLF9表达促进前列腺癌细胞增殖〔11〕。LncRNA TP73-AS1调控miR-141-3p促进胰腺癌细胞的迁移和侵袭〔12〕。胃癌组织中miR-141低表达,miR-141抑制胃癌细胞增殖、侵袭的作用机制与下调MMP-2、MMP-9蛋白表达有关〔13〕。miR-141-3p可通过靶向表皮生长因子受体(EGFR)并影响其下游途径蛋白抑制骨肉瘤细胞的生长和转移〔14〕。miR-141-3p可抑制成纤维细胞的增殖和迁移〔15〕。miR-141-3p通过靶向GLI2抑制骨肉瘤细胞的增殖并促进细胞凋亡〔16〕。本研究结果显示,miR-141-3p在乳腺癌细胞中表达水平显著降低,过表达miR-141-3p可抑制乳腺癌细胞MDA-MB-231增殖、迁移和侵袭。
CBX1是CBX家族成员之一,CBX1 mRNA高表达与乳腺癌患者的无复发生存(RFS)恶化相关,还与化学抗性相关〔17〕。研究发现CBX1在短暂性脑缺血发作和脑梗死患者中血清中高表达〔18〕。CBX1的过表达促进了垂体瘤细胞增殖和迁移〔19〕。本研究结果显示,CBX1在乳腺癌细胞中表达水平显著升高,沉默CBX1可抑制MDA-MB-231细胞增殖、迁移和侵袭。miR-141-3p靶向调控CBX1的表达。过表达CBX1能逆转miR-141-3p对乳腺癌细胞MDA-MB-231增殖、迁移、侵袭的抑制作用。
细胞周期的失调是肿瘤生长和转移的典型标志之一,CyclinD1参与细胞周期进展,它在乳腺癌组织中过表达导致细胞周期调控失调,引起细胞生长失控、转化和癌变〔20〕。CDK4抑制剂可联合内分泌治疗晚期乳腺癌〔21〕。MMP-2及MMP-9在乳腺癌组织中异常高表达,与乳腺癌的发生发展、浸润侵袭和转移等密切相关〔22〕。MMP-2和MMP-9活性增加可促进三阴性乳腺癌细胞的迁移和侵袭〔23〕。
综上所述,过表达miR-141-3p和沉默CBX1能抑制CDK4、CyclinD1、MMP-2、MMP-9蛋白的表达,进而抑制乳腺癌细胞MDA-MB-231增殖、迁移和侵袭。

