趋化因子CXCL4L1及其受体CXCR3在胰腺癌转移中的作用机制
韩静绮 张易青 冶俊玲 郭新建 王丰梅 (青海大学附属医院病理科,青海 西宁 810001)
CXC趋化因子配体(CXCL)4L1为血小板衍生的趋化因子CXCL4的同源物质〔1〕,CXCL4L1和CXCL4有34%的氨基酸序列不同,这种不同主要存在于编码信号分子序列的C末端氨基酸序列。并且,当肽链进一步折叠成成熟的蛋白质后发现,两种物质结构比对仅有4.3%的不同。相对于CXCL4来说,CXCL4L1具有更大的潜力抑制细胞的增殖和转移〔2,3〕。通过移植肺癌细胞A549、小鼠肺癌细胞LLC和小鼠黑色素瘤细胞B16的裸鼠喂食重组CXCL4L1后,裸鼠的成瘤性降低〔4〕。虽然CXCL4L1和CXCL4的分泌与作用机制不同,但是这两种细胞因子具有相似的功能。与CXCL4相比,CXCL4L1具有更低的多糖结合亲和性,而且不论在体内还是体外研究中,CXCL4L1具有更好的扩散性。这些不同主要是由于单个氨基酸的不同所引起的〔5〕。CXCL4L1不仅在血小板巨核细胞家族中有表达,在免疫细胞和其他细胞中也可以表达,例如平滑肌细胞和上皮细胞。同时趋化因子受体CXCR3也在多种细胞中表达,包括免疫细胞,血管细胞和肿瘤细胞〔6,7〕。CXCR3具有多种异构体,包括CXCR3-A、CXCR3-B和CXCR3-alt。其中CXCR3-A主要在Th1-CD4+T细胞、CD8+T细胞和自然杀伤细胞中表达,并且表现为促进肿瘤发展的功能。CXCR3-B与CXCR3-A相比,具有一个氨基酸末端的延伸,主要具有抑制血管生成的作用〔8〕。有报道表明CXCL4L1通过和CXCR3-B相结合可以抑制角膜新生血管的发展,当用抗CXCR3-B的单克隆抗体作用于小鼠时,可以有效解除CXCL4L1对于角膜新生血管发展的抑制作用〔9,10〕。有研究已经报道关于外源性的CXCL4L1或者CXCL4L1的C末端片段在皮下肿瘤模型中的作用,但是有关它在肿瘤发展和转移中的作用未做进一步分析。本文研究CXCL4L1和CXCR3的表达及二者在肿瘤转移中的作用。
1 材料和方法
1.1实验试剂 Hoechst33342,RNA提取试剂盒(美国,Thermo Scientific),DMEM培养液,血清(美国,gibco),兔抗人CXCL4L1抗体(ab97799),鼠抗人CXCR3抗体(ab64714),兔抗人GFP标记CXCR3抗体(ab71864),兔抗人藻红蛋白(PE)标记CXCL4L1抗体(ab83123)(美国,Abcam),transwell小室(中国,碧云天)。
1.2细胞培养 人胰腺腺癌细胞BxPC3,胰腺导管癌细胞Panc-1和成肌纤维细胞(MF)C2C12购买于中国科学院上海细胞库,培养于含10%胎牛血清(FBS)和双抗的DMEM和MEM培养基中,放入5%CO2,37℃培养箱中培养。
1.3共培养 2×105胰腺腺癌细胞BxPC3接种于transwell小室的上层,3×105个MF接种于transwell小室的下层于6孔板中,添加20%FBS的DMEM培养基,培养24 h进行免疫荧光染色实验。
1.4临床样本 胰腺癌早期患者20例,其中胰腺腺癌肺转移患者10例,胰腺导管癌肺转移患者10例(术前未经任何治疗)。其中男8例,女12例,年龄60~85岁,平均年龄(68.32±5.31)岁。组织样本(术后取下经液氮冻存)均经过病理证实。
1.5实验方法
1.5.1RT-PCR 从Genbank数据库中获取目的基因CXCL4(Hs0090185_m1)和CXCL4L1(Hs99906_m1)的mRNA序列,引物由上海生工设计并合成。取对数期长势良好胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1,消化计数后,以105个细胞每孔的数目接种于六孔板内,贴壁培养24 h。按照RNA提取试剂盒说明书提取RNA,并检测RNA含量。将所得RNA逆转录为cDNA(42℃ 30 min,85℃ 5 min)。对样品进行梯度稀释,得到6个浓度的模板,冰上加样SYBR Premix EX TapⅡ(10 μl),底漆混合物(1.6 μl),cDNA(1.5 μl),dH2O(6.9 μl)。离心,在Rt-PCR仪(Thermo,7900HT)上进行扩增,根据标准曲线,计算扩增效率。
1.5.2免疫荧光 BxPC3和经MF共培养的BxPC3细胞,胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1培养于24孔板中,待细胞长到80%左右开始进行荧光染色。用醋酸-乙醇固定液固定细胞,磷酸盐缓冲液(PBS)摇床上漂洗5 min,分别加入Hoechst 33342工作液,GFP-CXCR3抗体(1∶500),PE-CXCL4L1抗体(1∶800)进行染色,室温15 min,PBS漂洗3次,每次5 min,加入甘油与PBS(1∶9)的混合液,荧光显微镜(日本,Nikon,Ti-s)下观察,荧光显微镜下拍片,采用ImagePlus 7.0 软件对各组细胞中的荧光表达进行定量分析。
1.5.3免疫组化 制备胰腺癌早期患者组织样本切片,在载玻片上将切片固定好之后进行干燥处理。在二甲苯(Ⅰ)(Ⅱ)中进行脱蜡,后置于100%的纯酒精(Ⅰ)(Ⅱ)和梯度为95%、80%、70%的酒精和水中各5 min进行水化。水化完成后的片子置于3%的H2O2中,室温孵育10 min,PBS洗涤3次。将片子置于柠檬酸缓冲液(0.01 mol/L,pH6.0)中加热,待沸腾后改中火(92℃以上),室温下复温,PBS洗涤3次。吸干多余液体,滴加山羊血清封闭液,在37℃的温度下孵育30 min。滴加异硫氰酸荧光素(FITC)-CXCR3抗体(1∶600)和PE-CXCL4L1抗体(1∶800),在4℃的温度下过夜,取出后置于37℃烤箱中复温30 min,用磷酸盐吐温缓冲溶液(PBST)洗3次。滴加生物素标记的羊抗兔IgG二抗,在37℃的温度下孵育1 min,PBST洗涤3次。用3,3-二氨基联苯胺(DAB)试剂盒进行显色30 min,显色终止后清洗切片。滴加苏木素室温染液3 min,清水冲洗,盐酸酒精分化1 s,氨水返蓝5 min。将片子分别放入70%、80%的酒精各1 min,90%的酒精2 min,95%的酒精3 min,100%的酒精(Ⅰ)(Ⅱ)各3 min。二甲苯(Ⅰ)(Ⅱ)中各放置15 min,晾干,中性树胶封片。每个标本的阴性对照只滴加PBS液,在显微镜(CK30-F200,日本Olympus公司)下观察。
1.6统计学方法 采用SPSS21.0行成组t检验。
2 结 果
2.1RT-PCR检测CXCL4和CXCL4L1胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1中的表达 CXCL4在胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1中均有表达,其mRNA相对表达量分别为1.75±0.21、1.59±0.19,二者比较差异无统计学意义(t=1.384,P=0.196);CXCL4L1在胰腺导管癌细胞Panc-1中 mRNA相对表达量为(2.05±0.23),而在胰腺腺癌细胞BxPC3中几乎不表达,mRNA相对表达量仅为(0.03±0.01),两者比较差异具有统计学意义(t=4.237,P=0.032)。
2.2免疫荧光检测CXCL4L1在BxPC3和经MF共培养的BxPC3细胞中的表达 图1结果表明,CXCL4L1在胰腺腺癌细胞BxPC3中不表达,但在MF共培养的BxPC3细胞中高表达。BxPC3与培养的MF中CXCL4L1的相对荧光表达量为(27.80±0.43)%,与单独BxPC3细胞培养的相对荧光表达量(1.07±0.02)%比较,差异有统计学意义(t=6.223,P=0.004)。
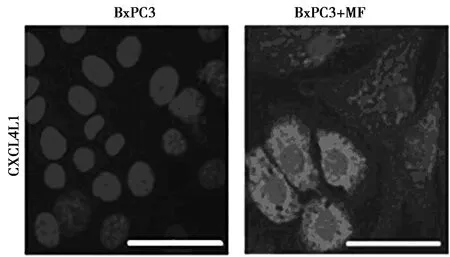
图1 CXCL4L1在BxPC3和经MF共培养的BxPC3细胞中的表达(×200)
2.3免疫荧光检测CXCR3在胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1中的表达 图2结果表明,CXCR3在胰腺腺癌细胞BxPC3中几乎不表达,相对荧光表达量为(1.03±0.02)%,在胰腺导管癌细胞Panc-1中高表达,相对荧光表达量为(15.73±0.52)%,差异有统计学意义(t=7.005,P=0.000)。
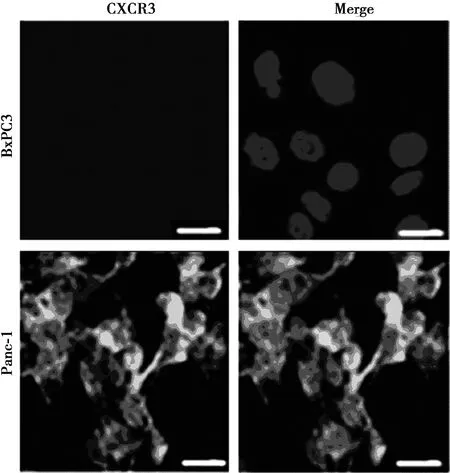
图2 CXCR3在胰腺腺癌细胞BxPC3和胰腺导管癌细胞Panc-1中的表达(×400)
2.4免疫组化检测CXCL4L1在胰腺癌组织和肺转移的组织中的表达 胰腺腺癌原发肿瘤组织中CXCL4L1的阳性表达与肺转移比差异无统计学意义(χ2=3.333,P=0.068);相比于胰腺导管癌原发肿瘤组织,CXCL4L1在肺转移胰腺导管癌组织中高表达(χ2=5.051,P=0.025),见图3和表1。
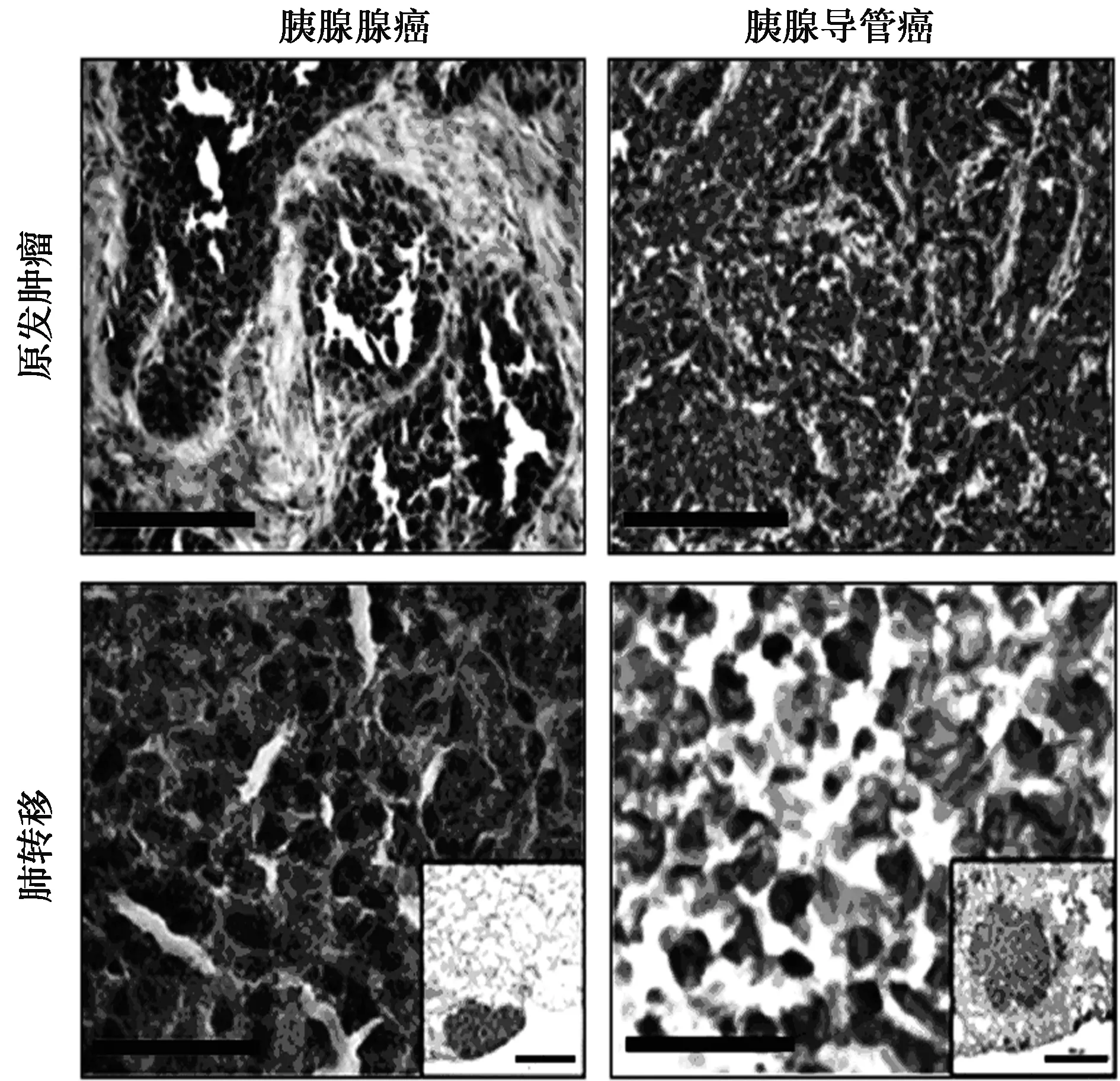
图3 免疫组化检测CXCL4L1在胰腺癌组织和肺转移的组织中的表达(×400)
2.5免疫组化检测CXCR3在胰腺癌组织和肺转移的组织中的表达 在胰腺腺癌原发肿瘤组织中CXCR3不表达,而在肺转移组织中CXCR3高表达(χ2=8.571,P=0.003)。在胰腺导管癌原发肿瘤组织中CXCR3低表达,而在肺转移组织中CXCR3高表达(χ2=9.899,P=0.002)。见表2、图4。
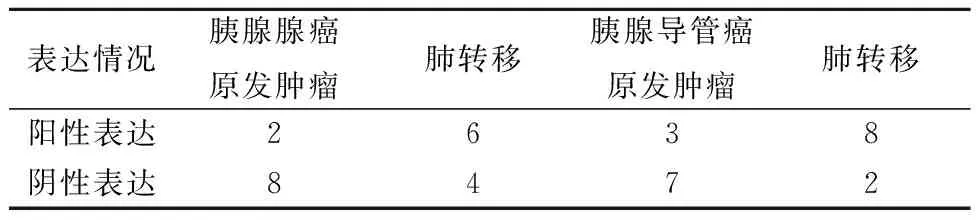
表1 CXCL4L1在胰腺癌组织中的表达情况(n,n=10)
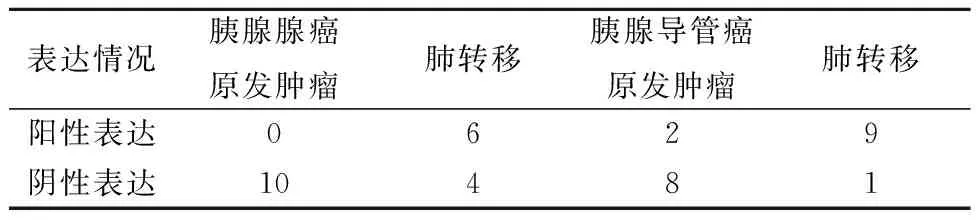
表2 CXCR3在胰腺癌组织中的表达情况(n,n=10)

图4 免疫组化检测CXCR3在胰腺癌组织和肺转移的组织中的表达(×200)
3 讨 论
胰腺癌是全球第五大癌症,其治愈率低,死亡率高〔11,12〕。根据胰腺癌的病理类型,胰腺癌可分为导管腺癌(导管腺癌占胰腺癌的80%~90%),腺鳞癌,腺泡细胞癌(仅占1%),小腺体癌(为少见类型的胰腺癌),小细胞癌(占胰腺癌的1%~3%)〔13,14〕。因此本文主要研究了常见的胰腺导管癌和胰腺腺癌。在胰腺癌细胞中,CXCL4L1和CXCL4的表达水平并不是完全一致的。例如,体外的胰腺癌细胞或者在肿瘤移植后的细胞BxPC3和Panc-1中,CXCL4L1的表达水平增加,而CXCL4的表达水平并没有增加。CXCL4也许在人胰腺导管癌细胞系PDAC的病理学过程中可能起到重要作用,但其具体的机制还需实验进一步证明。研究表明,CXCL4L1在结肠癌和食管癌中均有表达〔15,16〕。而在子宫内膜移位结合的卵巢癌中CXCL4L1和 CXCL4的表达水平看起来低于其在正常子宫内膜和子宫内膜移位的组织中的表达,但是这仅仅发生于肿瘤结合的巨噬细胞中〔17〕。CXCL4L1抗体可以将肿瘤转移灶作为靶点,但在人体中,如果将CXCL4L1作为靶点,可能同时会影响正常细胞的功能,所以CXCL4L1作为肿瘤细胞的靶点还存在着争议。由于CXCL4L1的扩散能力要远远强于CXCL4,所以CXCL4L1并不会仅仅存在于肿瘤组织中〔18,19〕。因此,需要进一步试验证明CXCL4L1作为肿瘤靶点的合理性。本研究结果表明,CXCL4L1在胰腺腺癌细胞BxPC3中不表达,但在经MF共培养的BxPC3细胞中CXCL4L1却高表达。MF可以模拟体内微环境,说明当肿瘤细胞处于一个稳定的微环境中,肿瘤细胞可以上调CXCL4L1的表达。CXCR3 作为CXCL4L1的受体,二者结合后可促进肿瘤细胞的增殖,转移和存活。本研究结果说明CXCR3在胰腺癌的转移中发挥着重要的作用。CXCL4L1作为胰腺癌发展的一个新颖的调节因子,不仅在肿瘤的微环境中发挥作用,同时还在转移的肿瘤组织中高表达〔20〕。可能表达有CXCL4L1的肿瘤细胞受到基质肿瘤细胞的接触控制,同时受到表观遗传学的调节有关。为了进一步了解特异的肿瘤微环境和表观遗传学基质对于肿瘤细胞表达CXCL4L1以及CXCL4L1在肿瘤细胞转移中的调节作用,本文通过实验模拟体内微环境,表明可以上调CXCL4L1的表达,CXCR3在胰腺导管癌原癌组织中低表达,而在肺转移组织中高表达,为胰腺癌的转移机制提供理论基础。

