肝脏类器官构建及其对小鼠部分肝切除术后肝再生的作用
薛瑞丰,汤宁,,潘晨燕,董春龙,蔡佳晖,袁献温,王经琳,,,任昊桢,,,施晓雷,,
(1.南京医科大学附属鼓楼临床医学院 普外科,江苏 南京 210005;2.南京大学医学院附属鼓楼医院 普外科,江苏 南京 210008;3.南京中医药大学中西医结合鼓楼临床医学院 普外科,江苏 南京 210029)
肝脏是参与能量合成,储存代谢的中心器官,具有强大的再生能力,增强肝脏的再生能力对肝脏疾病患者具有重要意义[1]。肝祖细胞是位于肝脏Hering区域的、具有向肝胆管上皮细胞和肝细胞分化能力的一类干细胞[2-3]。在轻度损伤的肝脏中,肝再生通常是以肝细胞的增殖和肥大来实现[4-5]。而当肝细胞增殖受到抑制或者肝脏损伤严重的情况下,肝祖细胞会分化为肝细胞和胆管上皮细胞,促进肝再生[6-7]。肝祖细胞从受损区域的门静脉向外扩展,形成导管样的簇状结构,称为导管反应[8]。研究证明,在慢性肝脏疾病中,肝祖细胞能介导肝再生。而肝脏类器官具有分化成功能性肝细胞、保护肝细胞和促进肝再生的作用[9]。那么在急性肝脏损伤如肝部分切除术后,外源性植入肝脏类器官是否发挥类似肝祖细胞的促进肝脏再生作用?目前尚无相关的报道。本研究基于这个问题进行初步的探讨。
1 材料和方法
1.1 类器官的构建
6~8周龄雄性C57BL/6小鼠肝脏在预冷DMEM/F-12培养基(Glibco)中剪碎至1 mm大小,转移离心管中静置去上清,加入消化液(Dispase、Collagenase type IV、Advance DMEM F12按1:1:6配比)10 mL,37 ℃水浴消化20 min,机械吹打静置去上清。继续重复消化,收集后面5次的组织上清液。分别用100、30 μm细胞筛网过滤,收集30 μm筛网截留的肝细胞。300 g,5 min离心收集细胞沉淀,基质胶重悬细胞种板,加入750 μL肝脏类器官诱导培养基hepaticult OGM mouse Supplement,于37 ℃ CO2培养箱培养。
1.2 实时定量聚合酶链反应(RT-qPCR)
从类器官中提取总RNA,将纯化的RNA反向转录成cDNA,应用生物系统7500快速实时PCR系统进行定量。资料采用2-ΔΔCT法进行分析。使用的引物序列见表1。

表1 引物序列
1.3 免疫荧光检测CK8、Desmin、AFP、PCNA表达情况
制作类器官冰冻切片进行鉴定。将切片先吹干,室温下多聚甲醛固定20 min,1×PBS洗3次,封闭液室温封闭1 h,一抗4 ℃过夜,清洗3次,避光孵育二抗,清洗3次,对细胞核进行染色,清洗3次,封片。荧光显微镜下观察。一抗分别是兔抗鼠CK8、Desmin、单克隆鼠源性AFP、兔抗鼠PCNA,二抗分别是山羊抗小鼠IgG H&L和山羊抗兔IgG H&L。
1.4 小鼠70%肝切模型的建立及肝脏类器官移植
雄性C57BL/6小鼠6~8周龄,随机分为2组,每组18只,以肝切除术后第1、4、7天为观察时间点,每个时间点6只[10]。对照组:行肝左、中叶切除术(占全肝70%)+肝包膜注射200 μL PBS;治疗组:行肝左、中叶切除术(占全肝70%)+肝包膜移植200 μL类器官悬液(1×106)。肝包膜下移植类器官方法如下:用钝性镊子提起肝包膜,用注射器将约400 μL的0.9%氯化钠注入肝包膜下,使其肝包膜和肝实质表明分离,再将其抽回,将200 μL肝脏类器官悬液注入肝包膜下。观察有无出血、漏液,缝合皮肤[11]。于术后第1、4、7天处死小鼠,取肝脏,用10%中性甲醛固定,石蜡包埋用于进一步组织学分析。
1.5 HE染色和免疫组化分析检测Ki67
取石蜡包埋的肝组织切片5 μm用苏木精和伊红(HE)染色进行形态学检查,用Ki67(abcam)进行免疫组化评估肝脏再生增殖情况。
1.6 Western blotting检测PCNA蛋白水平
剪取适宜肝脏组织,置于磷酸酶抑制剂、蛋白酶抑制剂和RIPA一定比例混合的蛋白裂解液,于冰上研磨后离心取蛋白上清。BCA法测蛋白浓度后,取20~30 μg蛋白加样,经聚丙烯酰胺凝胶电泳分离蛋白并将其转移至PVDF膜上,于5%脱脂奶粉中摇床封闭1~2 h,将PVDF膜置于一抗PCNA、4 ℃孵育过夜,用Tris缓冲洗膜3次,10 min/次,再用二抗室温孵育2 h,Tris缓冲盐水加吐温洗膜3次,10 min/次。凝胶成像系统显色曝光,用Imaje J对结果进行灰度分析。
1.7 肝功能评估
小鼠70%肝切模型建立后,于术后第1、4、7天摘除眼球取血,同时收取正常未手术小鼠血样标本作为正常组。用南京大学附属鼓楼医院自动化生化分析仪测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)水平。
1.8 统计学分析
2 结果
2.1 类器官构建
肝脏类器官具有高度克隆性,在特定的培养条件下,可以从少量起始细胞快速扩增,且扩增后的肝脏类器保留了分为成熟肝细胞的能力[12]。因此我们首先从细胞形态方面观察,发现肝细胞经3天诱导悬浮培养后从直径20 μm左右囊性结构聚集组装形成125 μm的类器官(P<0.05),直径扩增近6倍。当类器官直径超过200 μm时,类器官逐渐出现皱缩现象。因此在皱缩发生前,类器官能保持较好的传代活力。由此可见,我们构建的肝脏类器官具有较强的自我增殖和组装能力。见图1。
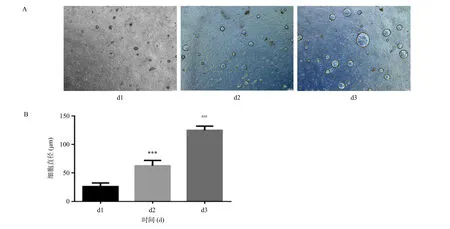
图1 肝脏类器官形态及其细胞直径量化
2.2 肝脏类器官表型鉴定
类器官培养技术开始于肠道组织的研究,之后迅速在其他器官中应用普及,Huch等[13]从人源性肝脏中分离出EPCAM(+)上皮细胞和肝细胞,体外三维培养,EPCAM(+)的上皮细胞大量扩增为肝脏类器官,在扩增过程中保持高度的遗传稳定性,且具有双分化潜能,可分化为肝细胞和胆管细胞。因此我们将传代前后的类器官与肝组织进行对比,发现类器官中肝脏干细胞的标志基因EPCAM、SOX9和CK19较肝组织呈明显上调(P<0.05),且传代前后EPCAM、SOX9、CK19、TBX3、AFP、SOX17、FOXA2、HNF4A、CEBPA和CEBPB未见明显改变。免疫荧光发现CK8和Desmin、AFP、PCNA呈阳性表达,说明肝脏类器官具有肝脏上皮细胞部分属性和增殖能力。由上述结论可以证明:我们成功将肝细胞诱导成具有肝脏干细胞属性和增殖能力的肝脏类器官。见图2。
2.3 肝脏类器官移植能保护70%肝切除术后的肝细胞,促进肝再生

图2 肝脏类器官表型鉴定
HE显示对照组和治疗组小鼠在术后第1天肝索结构消失,细胞排列紊乱,炎性细胞浸润,存在大量的脂肪空泡,且治疗组肝脏脂肪空泡更严重。再生的第4天,对照组小鼠肝细胞核仁染色加深,仍有炎性细胞浸润,部分区域存在肝细胞坏死区。治疗组小鼠肝细胞形态大小基本恢复正常,形态较清晰,无炎症细胞浸润,无脂肪或气球样变。在术后第7天,两组小鼠肝再生结束,小鼠肝细胞呈条索状规则,肝血窦间隙清晰,肝细胞形态大小正常,无脂肪或气球样变,Ki67结果显示,70%肝切除术后第1天,对照组小鼠增殖明显强于治疗组,第4天两组均显示增殖状态,为了确认在70%肝切除术后第4天增殖状态的差异,我们通过Western blotting检测PCNA水平再一次确认,量化结果显示在术后第4天治疗组增殖显著上调,接近对照组3倍(P<0.05)。这说明肝脏类器官有促进肝细胞增殖作用。见图3。
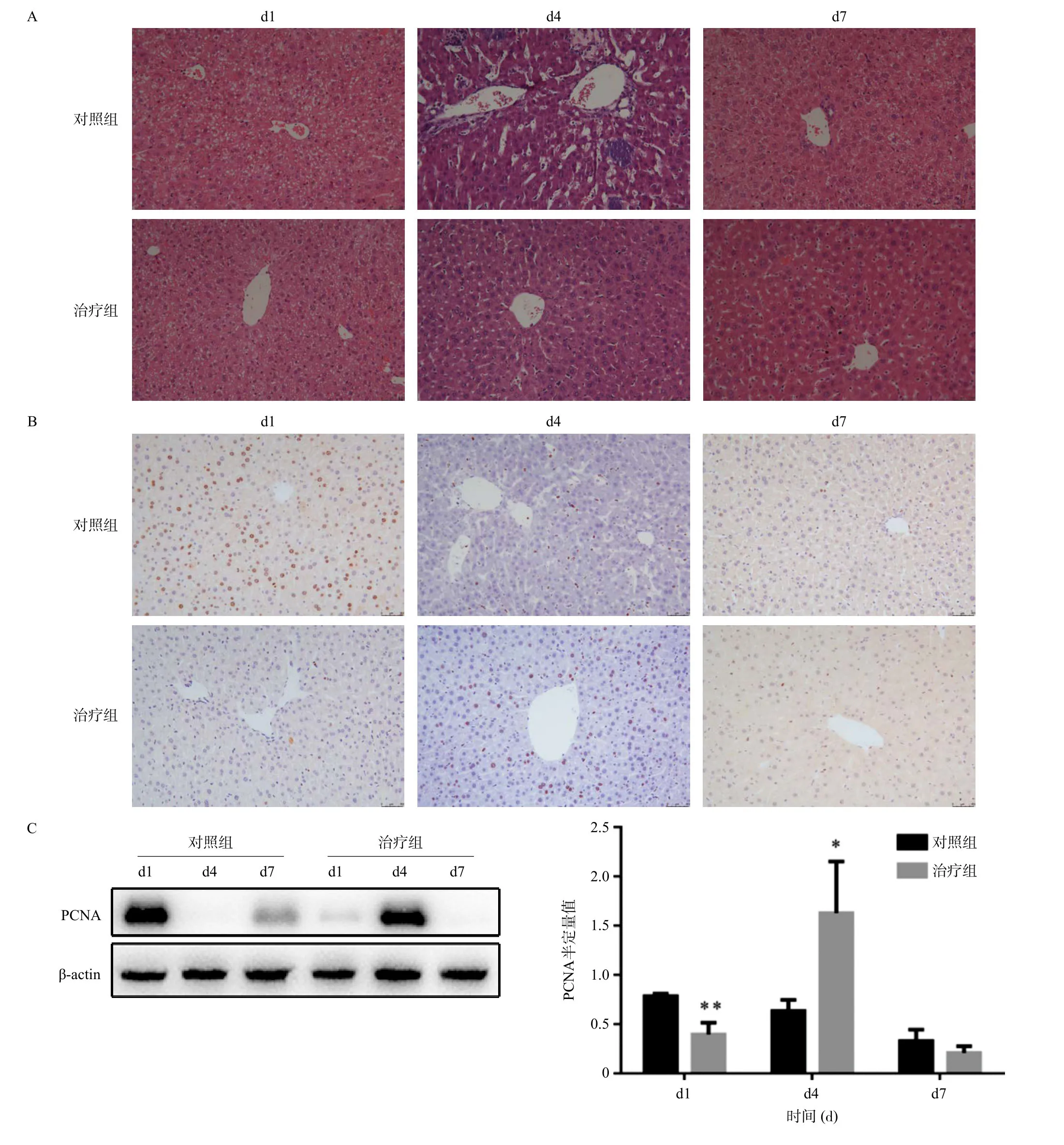
图3 肝脏损伤及增殖情况
2.4 肝脏类器官移植改善70%肝切除术后肝功能
既往研究表明,70%肝切除术后小鼠肝脏损伤严重,肝酶会显著升高。因此我们对两组小鼠70%肝切除术后肝功能进行检测,发现术后第1天两组ALT、AST、TBIL和DBIL均显著升高,且治疗组ALT高于对照组。但在术后第4天,治疗组ALT、AST、总胆红素(direct bilirubin direct,TBIL)和直接胆红素(direct bilirubin,DBIL)明显下降,同时肝脏ALB明显升高(P<0.05)。因此判断肝脏类器官对70%肝切除术后小鼠肝功能有改善作用。见图4。

图4 肝功能相关指标随时间恢复情况
3 讨论
肝脏部分肝切除术之后,剩余功能正常的肝细胞会响应再生诱导信号如肿瘤坏死因子(tumour necrosis factor-alpha,TNF-α)和白介素-6(interleukin-6,IL-6)等,在经过一周时间增殖再生恢复到器官的初始重量[14-15]。既往研究表明,在毒素介导的肝脏损伤或慢性肝病中,肝再生主要是肝祖细胞激活通过导管反应,增殖分化重新填充肝脏[16-19]。那么在急性肝损如肝部分切除术后,肝脏类器官是否能发挥类似肝祖细胞的促进肝再生作用,尚无相关的报道。单纯的肝干细胞移植面临植入效率低,植入后细胞存活时间短、植入后无法保证固定在理想位置等问题[20-21]。有研究表明,3D立体结构有利于细胞的增殖、分化[22],这也是我们选择肝脏类器官作为切入点的另一个原因。
首先我们对体外构建的肝脏类器官进行初步的鉴定。镜下对肝脏类器官形态进行初步的观察,发现经过3天的诱导培养,肝脏类器官从囊性结构转变成球状团块,直径扩增了近5倍,说明其具有快速增殖扩增的能力,与既往研究基本吻合[23]。进一步将传代前后的类器官与肝组织进行基因表型鉴定,发现类器官显示代表肝脏干细胞属性的基因明显上调,且在传代前后均基因未见明显差异[24-25]。免疫荧光显示,肝脏上皮细胞标记物CK8、Desmin、AFP、PCNA为阳性,以上结论说明我们体外构建的肝脏类器官具有肝脏干细胞、上皮细胞属性、具有增殖能力、基因能稳定遗传。
其次进行70%肝切除再生小鼠模型构建。肝脏再生整个周期大约是7 d。此前主要观察时间点集中在第1、2、7天。在没有外界干预的条件下,肝细胞增殖将在术后第2天将达到一个峰值[26]。经过前期预实验的摸索,我们发现,治疗组增殖在第4天达到峰值,因此本实验观察的时间点选在70%肝切除术后第1、4、7天。HE显示,在术后第1天时,两组均呈现一个典型的肝细胞损伤表现,出现大量的脂肪空泡,细胞基本结构消失。同时出现治疗组较对照组损伤严重的现象,初步判断可能是外源性移植导致的短暂的免疫排斥,加重损伤现象。而在第4天的时候,治疗组小鼠肝细胞基本结构率先恢复正常,形态较清晰,无炎症细胞浸润,无脂肪或气球样变。免疫组化和Western blotting显示,治疗组在术后第1天增殖减弱,术后第4天增殖达到峰值,是对照组的近3倍,整体趋势与HE显示的损伤恢复相同。
最后通过血清肝功能指标来进行进一步的验证。本研究发现,治疗组在术后第4天ALT、AST、TBIL和DBIL明显下降,ALB合成明显增加,说明治疗组肝脏整体的损伤恢复情况较对照组好。综上所述,具有肝脏干细胞属性和增殖能力的肝脏类器官,能通过保护肝细胞、改善部分肝切除术后小鼠肝功能,进而发挥促进肝再生作用,但是否通过类似肝祖细胞的导管反应还需要进一步论证。