α-硫辛酸对缺血再灌注诱导的PC12细胞应激性凋亡抑制作用的研究*
谢鹏, 任真奎, 吕菊, 胡玉梅, 吴昌学*, 禹文峰*
(1.贵州医科大学 分子生物学重点实验室,贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族疾病教育部重点实验室,贵州 贵阳 550004; 3.黔西南州人民医院 检验科,贵州 兴义 562400)
缺血再灌注损伤是缺血性脑卒中的主要病因,研究表明,缺血再灌注导致的细胞损伤可能是由于缺血和再灌注阶段引起的神经炎症、氧化应激、过度自噬激活、细胞能量耗竭和氨基酸兴奋性中毒等原因造成的[1-2]。内质网是机体内重要的细胞器,负责细胞内蛋白质、脂质等的生物合成、折叠修饰以及运输等[3],蛋白质及脂质的合成和正确折叠对细胞的存活以及蛋白质发挥正确功能是至关重要的。当内质网的稳态被打破时,会触发内质网应激反应,也称折叠蛋白反应,发挥调节细胞稳态的作用进而促进细胞的生存[4]。研究表明,缺血再灌注会触发机体细胞的内质网应激反应,但持续的内质网应激反应会诱导细胞凋亡[5-6]。因此,以缺血再灌注导致的内质网应激为脑卒中的治疗靶点的研究受到越来越多的关注。α-硫辛酸(alpha-lipoic acid,α-LA)是一个短链脂肪酸,是机体内诸多重要酶的辅助因子,也是万能的抗氧化剂,参与了很多细胞内的重要代谢过程[7-8]。有研究报道,α-LA在MCAO大鼠模型上通过mTOR信号通路降低大脑的缺血再灌注损伤[9],在人的肝移植研究中发现α-LA可以改善肝移植的再灌注后综合征[10]。可见,α-LA在缺血再灌注损伤中发挥着有效的保护作用,其深入的分子机制理论需要更多的证据支持。因此,本研究利用体外氧糖剥夺/再灌注(OGD/R)的大鼠肾上腺嗜铬神经瘤细胞(PC12细胞)模型,探讨缺血再灌注诱导细胞损伤的分子机制以及α-LA对缺血再灌注细胞模型的影响。
1 材料与方法
1.1 细胞与试剂
PC12细胞系购买自中国科学院典型培养物保藏委员会细胞库,胎牛血清(FBS)、高糖DMEM培养基、无糖DMEM培养基和0.25%胰酶消化液购至美国Gibco公司,1×磷酸盐缓冲液(1×PBS)购至以色列Biological Industries,蛋白酶抑制剂(PMSF)、兔抗葡萄糖调节蛋白78(GRP78)、兔抗裂解型胱天蛋白水解酶3(Cleaved-caspase3)和抗兔二抗购至美国CST,环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)购至Absion,兔抗B淋巴细胞瘤-2相关X (Bax)购至美国Abcam,细胞活性检测试剂盒-8(CCK-8试剂盒)购至日本同仁,ECL-Plus化学发光液和PVDF膜购买至美国Millipore公司。
1.2 方法
1.2.1PC12细胞培养及缺血再灌注模型建立 高分化的PC12细胞用1%双抗+10%FBS +89%DMEM培养基配方进行培养,长至80%~90%密度时进行传代培养。以每孔2×105的细胞密度接种在六孔板内,当细胞密度达到70%时进行缺血再灌注模型建立。合适密度的细胞吸弃原培养基,预冷PBS洗细胞两遍后加无糖培养基(不含血清)2 mL,置于三气培养箱(37 ℃,1%O2+94%N2+5%CO2)进行OGD处理,OGD 4 h后弃原培养基,PBS洗细胞两遍加高糖培养基(不含血清)2m L置于正常培养箱(37 ℃,5% CO2)行复氧糖处理以模拟再灌注,再灌注不同时间段(0、6、12、18和24 h)后进行后续干预处理。
1.2.2实验分组及干预处理 实验分为正常组(Control)、OGD 4 h组(OGD4)、OGD 4 h后复氧不同时间段4组(OGD4+R6、OGD4+R12、OGD4+R18、OGD4+R24)、α-硫辛酸给药OGD/R组(OGD/R+α-LA)。Control组细胞在完全培养基、正常氧培养箱中培养,OGD/R组细胞按上述方法进行培养处理,OGD/R+α-LA组细胞先OGD处理后在复氧时给予不同浓度(0.01、0.05、0.10、0.25、0.50、1.00、2.00、5.00和10.00 mmol/L)α-LA共同处理细胞24 h。
1.2.3CCK-8试剂盒检测细胞的存活率 生长至合适密度的细胞,将细胞以每孔5×103的密度接种至96孔板,长到50%~60%密度时,吸弃旧培养基,每孔分别加入无糖DMEM培养基100 μL,置于三气培养箱(1%O2+5%CO2+95%N2)中培养4 h模拟缺血缺氧处理。缺氧处理后用高糖无血清培养基配置含不同浓度(0.01、0.05、0.10、0.25、0.50、1.00、2.00、5.00和10.00 mmol/L) α-LA的培养基置于正常培养箱培养24 h行复氧处理。复氧24 h后,每孔加入CCK-8 10 μL工作液反应1 h,以空白孔调零,每组六个复孔,酶标测定仪测定450 nm波长下的吸光度值(OD)。细胞存活率=(OD给药-OD空白)/(OD对照-OD空白)×100%。
1.2.4检测内质网应激和凋亡相关分子GRP78、CHOP、Bax及Cleaved-caspase3表达 各组细胞分别接种于六孔板内,长到合适密度后经过干预处理,吸弃培养基,PBS洗细胞两遍,尽量吸弃PBS后按每孔120 μL的量加裂解液(RIPA)置于冰上,裂解细胞5 min后,用细胞刮刀收集细胞至1.5 mL干净离心管中,置于冰上继续裂解20 min后,12 000 r/min离心收集上清至新的干净1.5 mL离心管,BCA蛋白定量试剂盒定量分析蛋白浓度,5×SDS buffer,100 ℃,5~10 min变性蛋白后,按每孔30 μg等量上样30 mA恒流电泳分离蛋白,220 mA恒流转膜120 min,转膜结束后5%脱脂奶粉室温封闭膜1.5 h,PBST洗膜5 min后孵育一抗,4 ℃摇床过夜;次日,1×TBST每10 min洗膜3次,室温孵育二抗2 h,TBST每10 min洗膜3次,ECL-Plus发光液于GeneGnome XRQ曝光,β-actin作为内参,ImageJ软件进行蛋白定量分析。
1.3 统计学分析
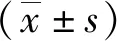
2 结果
2.1 PC12细胞GRP78、CHOP、Bax和Cleaved-caspase3蛋白的表达
与Control组比较,OGD4、OGD4+R6、OGD4+R12、OGD4+R18、OGD4+R24组细胞内质网应激相关的分子GRP78和CHOP表达逐渐升高(P<0.05),其中GOGD4+R24升高最明显(P<0.05);同时相关的凋亡蛋白Bax、Cleaved-caspase3表达也逐渐升高(P<0.05),在OGD4+R24组升高最高(P<0.05)。见图1。

注:A为蛋白免疫印迹法条带;B为各蛋白相对表达量统计柱状图; (1)与control组比较,P<0.05。图1 各组PC12细胞GRP78、CHOP、Bax和Cleaved-caspase3蛋白的表达Fig.1 Expression levels of GRP78, CHOP, Bax and Cleaved-caspase 3 in the different groups
2.2 α-LA 对OGD/R处理后PC12细胞存活率的影响
与Control组比较,OGD4+R24组PC12细胞存活率降低(P<0.05)。与OGD4+R24组比较,OGD/R+α-LA组除0.01 mmol/L α-LA浓度外,其余浓度α-LA 下的PC12细胞存活率均升高(P<0.05);当α-LA 浓度为0.50 mmol/L时PC12细胞存活率最高(P<0.05)。当α-LA浓度为10.00 mmol/L时,PC12细胞的存活率较OGD4+R24组明显降低(P<0.05),表明α-LA在此工作浓度下对PC12具有较强的毒性。见图2。

注: (1)与control组比较,P<0.05;(2)与OGD4+R24组比较,P<0.05。图2 各组PC12细胞的存活率Fig.2 Comparison of cell survival rates in the different groups
2.3 α-LA 对OGD/R处理后PC12细胞凋亡相关蛋白Bax和Cleaved-caspase3表达的影响
与Control组比较,OGD4+R24组的细胞凋亡蛋白Bax和Cleaved-caspase3的表达明显升高(P<0.05);与OGD4+R24组比较,OGD/R+α-LA(0.5 mmol/L)组凋亡分子Bax和Cleaved-caspase3的表达明显降低(P<0.05)。见图3。

注:A为Western blot条带图,B为相对表达量统计柱状图;(1)与control组比较P<0.05;(2)与OGD4+R24组比较,P<0.05。图3 α-LA对缺血再灌注后PC12细胞凋亡蛋白Bax和Cleaved-caspase3表达的影响Fig.3 The effect of α-LA on OGD/R-mediated expression levels of Bax and Cleaved-caspase 3
2.4 α-LA降低缺血再灌注诱导的内质网应激相关分子GRP78和CHOP表达
与Control组比较,OGD4+R24组内质网应激分子GRP78和CHOP的表达明显升高(P<0.05);OGD/R+α-LA(0.5 mmol/L)组内质网应激相关分子GRP78和CHOP的表达明显减少(P<0.05)。见图4。

注:A为Western blot条带图,B为相对表达量统计柱状图;(1)与control组比较,P<0.05;(2)与OGD4+R24组比较,P<0.05。图4 α-LA对缺血再灌注后PC12细胞内质网应激相关蛋白GRP78和CHOP表达的影响Fig.4 The effect of α-LA on the expression levels of OGD4/R-mediated GRP78 and CHOP
3 讨论
心脑血管疾病严重威胁人类生命安全,影响人类生活质量,其中脑卒中是全球排名第二的死亡原因。脑血管破裂及阻塞所导致缺血再灌注损伤是脑卒中发病的主要原因。缺血再灌注损伤复杂的病理分子机制为脑卒中的预防及治疗带来了困难,研究缺血再灌注损伤的分子机制及开发有效的药物干预治疗靶点具有重要意义。OGD/R模型是体外模拟缺血再灌注损伤的经典模型,是缺血再灌注损伤分子机制研究、药物药效、药理及药动学的经典研究模型。PC12细胞因其神经元和肿瘤无限增殖传代的特性,故而成为体外研究缺血再灌注损伤分子机制及药物药效学研究的重要载体。
内质网是生物有机体细胞内重要的细胞器,其主要的功能是合成蛋白质、蛋白质修饰折叠加工、脂质的生物合成等[11-13]。其自然进化而来的适应系统—内质网应激反应,对维持细胞的正常存活以及发挥正常生物学功能是至关重要的[14-15]。内质网应激反应参与许多的生理病理过程[16-17]。有研究证实,缺血再灌注诱导的钙离子升高、ROS释放、能量耗竭等病理过程都会促发内质网应激反应[18-20]。过度激活的内质网应激反应会加剧缺血再灌注损伤对神经细胞、心肌细胞以及肾细胞等损害作用[21-22]。因此,寻找有效的药物干预内质网过度激活的内质网应激反应可能是脑卒中、心肌梗死等疾病的有效治疗策略。
α-LA是万能的抗氧化剂。诸多研究证实,α-LA在糖尿病、糖尿病并发类神经疾病中发挥着积极保护的作用[23- 24]。本课题组前期的研究结果显示,α-LA能有效降低6-OHDA诱导的PC12细胞活性下降[25]。为探讨其对缺血再灌注损伤作用的保护机制,本研究进行了相关的实验研究。
本研究运用高度诱导分化的PC12细胞OGD 4 h再灌注不同时间段观察缺血再灌注对PC12细胞内质网应激及细胞凋亡的影响。有趣的是,实验发现与正常组比较,缺血再灌注的不同时间段诱导了PC12细胞内质网应激及细胞凋亡水平的同步持续升高。表现为内质网应激相关的分子GRP78和CHOP的表达逐步增加,凋亡相关分子Bax和Cleaved-caspase3的表达相应增加,凋亡和内质网应激表达升高最为显著的是OGD4+R24组。据此,推断缺血再灌注诱导了PC12细胞发生应激性的细胞凋亡。为了探讨α-LA对PC12细胞缺血再灌注损伤的保护作用,通过CCK-8细胞活性试剂盒筛选得到了α-LA发挥保护作用的最适有效工作浓度为0.50 mmol/L,并以此浓度在再灌注阶段共同作用于PC12并分析了其相关的凋亡及内质网应激分子(Bax、Cleaved-caspase3、GRP78和CHOP)的表达量变化。值得欣喜的是,实验发现α-LA可以有效降低缺血再灌注诱导的相关凋亡分子的升高,其表现为裂解型的caspase3和促凋亡蛋白Bax的表达减少。为了进进一步探讨其发挥将降凋亡作用的机制,在同样的处理模型上,检测内质网应激相关的分子GRP78和CHOP的表达变化,发现α-LA可以显著减少OGD/R组内质网应激相关蛋白的表达。
综上所述,缺血再灌注诱导了PC12细胞内质网应激性的凋亡,α-LA可以减少缺血再灌注诱导的细胞损伤,其可能的机制是α-LA通过减少缺血再灌注诱导的过度激活的内质网应激水平进而发挥保护细胞免于缺血再灌注诱导的细胞损伤。本研究为缺血再灌注损伤的分子机制提供了一定的理论证据,为α-LA的临床用药或药效学提供了理论指导。
——疾病防治的新靶标

