长期魔芋低聚甘露糖处理可改善小鼠焦虑样行为
王晓琴, 马艳芳, 唐湘华, 王功伍
(1. 云南师范大学 体育学院 国家级高原训练实验教学中心; 2. 云南师范大学 生命科学学院 生物能源持续开发利用教育部工程研究中心 云南省生物质能与环境生物技术重点实验室, 昆明 650500)
魔芋低聚甘露糖(Konjac mannan-oligosaccharides, KMOS),又称魔芋葡甘露低聚糖,是由魔芋块茎中含量丰富的葡甘露聚糖通过降解得到的一类主要由二糖到十糖等低聚糖的混合物[1]。KMOS具有促进肠道益生菌增殖[2-5]、维持肠道正常形态功能[3, 6-7]、提高机体抗氧化和免疫[7-9]、降血脂[10]等多种作用。而肠道功能和机体免疫的增强以及益生菌可通过肠-脑轴(Gut-brain axis)促进认知相关脑区海马内脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)表达和神经元增殖[11],并具有抗抑郁效应[12-13]。KMOS作为益生元和食品添加剂已广泛使用,但尚不清楚长期食用是否具有抗焦虑和抗抑郁作用。本研究以小鼠为实验动物,研究了长期饲喂KMOS对小鼠抑郁和焦虑相关情绪行为及情绪相关脑区腹侧海马(Ventral hippocampus, VH)神经元密度的影响,为KMOS的心理健康效应研究和应用提供实验证据。
1 材料和方法
1.1 实验动物及分组
清洁级健康成年雄性昆明(KM)小鼠50 只用于本实验(4周龄,购自成都达硕实验动物公司,实验动物生产许可证号:SCXK(川)2015-030)。动物共分为5组,包括对照组和4个给药组,分笼饲养,每笼10只。自由饮食。饲养间保持12 h /12 h 的明暗周期变化,室内温度保持在(22±1) ℃。给药前动物先在实验室适应一周。KMOS(纯度≥95%,由生物能源持续开发利用教育部工程研究中心提供)每天处理1次,每次0.2 mL[剂量分别为0(对照组)、650、1400、3000和6500 mg/kg,生理盐水溶解,灌胃给药],连续处理30 d。本研究总体实验流程如图1所示。

KMOS: Konjac mannan-oligosaccharides; OFT: open field test; EPM: elevated plus maze; FST: forced swimming test
图1本研究实验流程图
Figure 1 Timeline flow chart of experiments in present study
1.2 行为学实验方法
1.2.1 旷场实验(Open field test, OFT)
实验箱是规格为60 cm×60 cm×50 cm的浅灰色PVC塑料敞口箱。将动物放入中央区域,观察5 min,并用动物行为视频软件(北京天鸣宏远)记录并分析其行为数据。在软件中将箱底平均分为16个正方形小格(边长15 cm),外周12个格子为周围区,中央4个格子为中央区。分析指标包括直立次数、理毛、排便及其在中央和四周区域活动的时间和路程以及进出中央区域的次数。测完用75%酒精擦拭旷场箱。
1.2.2 高架十字迷宫(Elevated plus maze, EPM)
迷宫为木制,由闭臂、开臂各一对及中央平台组成。闭臂长75 cm,宽7.5 cm,高10 cm;开臂仅有底板。中央平台为边长7.5 cm的正方形区域。迷宫距地面60 cm。实验时,将小鼠放入中央平台区域,头向开臂,让其自由探索。用视频软件记录5 min动物活动轨迹,并分析其在闭臂和开臂中的时间、路程、进入次数、潜伏期、速度、静止时间等指标。测完用75%酒精擦拭迷宫。
1.2.3 强迫游泳测试(Forced swimming test, FST)
该测试采用敞口的圆筒状透明玻璃水缸(高30 cm,直径15 cm)。缸内注入清水,深20 cm,水温维持在(23±1) ℃。将小鼠尾部向下,置于水中。小鼠会在缸中挣扎和游动,但无法逃脱。记录5 min内小鼠漂浮不动的时间。若其为维持身体平衡,仅仅轻轻摆动肢体仍算作不动。
1.2.4 脑组织学检查
待所有行为学实验完成后,将动物深度麻醉(4%戊巴比妥钠,80 mg/kg,腹腔注射)后,生理盐水经主动脉灌流,4%甲醛溶液固定,取脑后将其在4%甲醛溶液中继续固定至少7 d。从固定后的脑上切取海马部分,用振动切片机行冠状切片(20 μm),经焦油紫染色、脱水透明后封片。在20倍物镜下选取脑切片的VH-CA3亚区拍照,在固定位置选取长30 μm的主细胞条带,使用ImageJ 1.52k软件计数神经元数目。
1.2.5 数据分析
2 结果与分析
2.1 脑组织学检查
在本研究整个饲喂和实验中,KMOS组小鼠总体状态良好。脑组织学检查结果表明,VH-CA3亚区神经元数目存在组间差异(ANOVA:F(3,34)=10.265,P=0.000)。KMOS组神经元形态正常,但密度增大,条带增宽,6500 mg/kg组动物的神经元数目较对照组增加(P=0.000,图2)。Pearson相关分析也表明,各组VH-CA3亚区神经元数目与KMOS剂量间存在显著的正相关(R2=0.699,P=0.000),提示KMOS应能促进该亚区神经元增殖或存活。
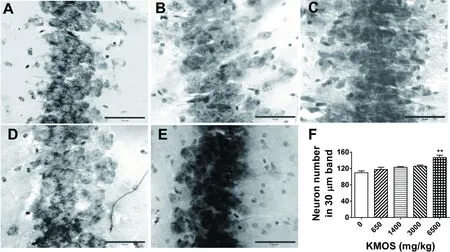
A:对照(control);B:650 mg/kg;C:1400 mg/kg;D:3000 mg/kg;E:6500 mg/kg; F:神经元计数分析结果(Result of neuron number analysis)。**P<0.01,vs.对照相(vs. control);在显微照片中,比例尺代表10 μm (the scale bar is 10 μm in the microphotographs)
图2小鼠腹侧海马CA3亚区显微照片(焦油紫染色,20×,A-E)及KMOS对该亚区神经元数目(30μm条带)的影响(F)
Figure 2 Microphotographs of ventral hippocampal CA3 subarea (cresyl violet staining, 20×, A-E) and the effect of KMOS on its neuron number (in 30 μm cell band) in mice (F)
2.2 OFT
在OFT实验中,计数数据(图3)显示,除了排便颗数无明显组间差异(F(4,41)=0.938,P=0.452)外,见图3-D,各组在中央区进入次数(F(4,39)=5.384,P=0.002,见图3-A,直立次数(F(4,40)=4.765,P=0.003,见图3-B及理毛次数(F(4,41)=4.935,P=0.002),见图3-C方面均有明显差异。多重比较表明,KMOS 650 mg/kg组理毛次数(P=0.048)及1400、3000 mg/kg组的中央进入次数(均P≤0.002)和直立次数(均P≤0.003)均高于对照组。
在计量数据方面,与周围区相比,各组动物在中央区的时间、路程、速度及静止时间方面均有差异显著性(GLM-RM,均F(1,4)≥33.518,P=0.000),见图4,且无明显区域×药物处理交互效应(均F(1,4)≤1.663,P≥0.179),说明所有动物具有正常的感觉、运动和动机能力,能明确分辨旷场环境并作出倾向性行为反应。GLM-RM同时表明,除静止时间(F(1,4)=0.995;P=0.422)外,其余各参数的统计结果(均F(1,4)≥2.734;P≤0.043) 均提示有显著的药物处理效应。配对T检验表明,除对照组外(P=0.097),KMOS处理组动物在中央区的速度均明显高于周围区(均P≤0.044)。ANOVA分析提示,速度指标存在组间差异显著性(F(4,39)=3.002,P=0.030),其余指标无明显差异(均P≥0.124);多重比较表明,KMOS_1400 mg/kg组中央区速度显著高于对照组(P=0.007),见图4-D。

A:中央区进入次数(central area entries);B:直立次数(rearing times);C:理毛次数(grooming times);D:排便颗数(defecation number); #P<0.05, ##P<0.01,vs.对照组(vs. control)
图3KMOS对小鼠旷场一般行为(计数指标)的影响
Figure 3 Effect of KMOS on general behaviors (count data) of open field test in mice

A:时间(time);B:路程(pathway);C:静止时间(static time);D:速度(speed)。*P<0.05,**P<0.01与周围区相比(vs. peripheral area);#P<0.05,vs.对照组(vs. control)
图4KMOS对小鼠旷场水平运动(计量指标)的影响
Figure 4 Effect of KMOS on horizontal motor of in open field behavior (measurement data) mice
2.3 EPM
GLM-RM分析表明,动物在总体上的开臂时间、路程、进入次数和潜伏期、速度、静止时间方面均明显低于闭臂(均F(1,4)≥10.579,P≤0.020),见图5。开闭臂×药物处理交互效应方面,除静止时间一项交互效应较为明显(F(1,4)=3.339,P=0.020)外,其余各参数均无显著性(均F(1,4)≤2.261,P≥0.080)。药物处理方面,除进入次数存在明显差异(F(1,4)=4.776,P=0.003)外,其余各参数均无显著性(均F(1,4)≤2.485,P≥0.060)。ANOVA分析发现,开臂进入次数(F(4,41)=3.591,P=0.013)和闭臂静止时间(F(4,38)=3.093,P=0.027)存在明显组间差异,见图5-C、F,其余各数据组间差异不显著(均P≥0.080);多重比较表明,KMOS_3000 mg/kg组开臂进入次数高于对照组(P=0.012),见图5-C;而各KMOS组闭臂静止时间与对照组相比差异不显著(均P≥0.095),提示组间差异应主要由KMOS组间产生。
2.4 FST
在FST实验中,所有组动物的不动时间如图6所示。ANOVA分析表明,各组间差异不显著(F(4,42)= 0.141,P=0.996),提示KMOS处理对小鼠FST行为无明显影响。

A:时间(time);B:路程(pathway);C:进入次数(entries);D:进入潜伏期(latency);E:速度(speed);F:静止时间(static time)。CA:闭臂(close arms);OA:开臂(open arms);*P<0.05, **P<0.01,vs.闭臂(vs. CA);#P<0.05,vs.对照组(vs. control)
图5KMOS对小鼠高架十字迷宫任务的影响
Figure 5 Effect of KMOS on performances of in mice elevated plus maze
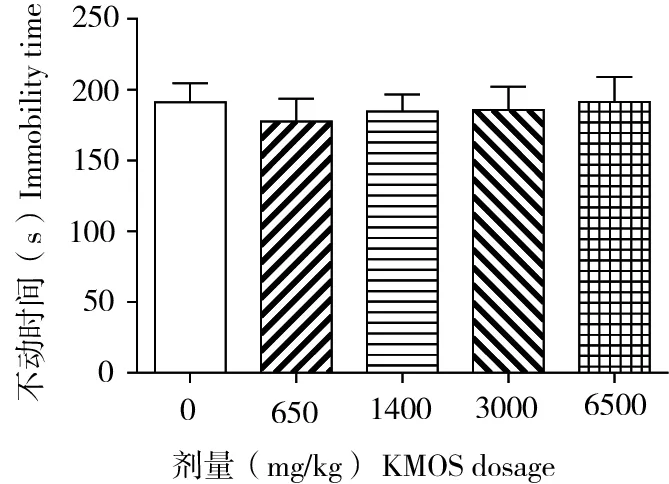
图6 KMOS对小鼠强迫游泳不动时间的影响Figure 6 Effect of KMOS on forced swimming immobile time in mice
3 讨论与结论
OFT常用于评价小动物的运动、焦虑、探究等情绪相关行为。EPM是测量小动物焦虑水平的重要方法。本研究行为学实验表明,KMOS处理30 d的昆明小鼠在OFT中进入中央区次数和直立次数、中央区运动速度均显著增加(图3-A、B,图4-D),且在EPM中进入开臂次数也显著增加(图5-C)。OFT中央区和EPM开臂对小动物来说均为较危险区域,焦虑水平高的动物较少进入。KMOS处理动物中央区和开臂进入次数、旷场直立次数的增加均可反映动物焦虑水平的降低和探究活动的增加。而其中央区平均速度较快,推测其应是进入次数增加,活动较为放松和频繁的表现。上述结果提示,长期KMOS处理可减少小鼠的焦虑样行为。
VH与杏仁核和前额叶等情绪和认知相关脑区有密切联系[14-15],也是微生物-肠-脑轴影响脑内神经元发生和情感相关精神疾病(如抑郁症、焦虑症等)发生的靶点[11-13],同时是抗抑郁药物的靶点之一[15-16]。益生菌可通过迷走神经肠支发挥抗抑郁和促进海马BDNF表达和神经元增殖作用[11]。由于KMOS具有很强的益生作用,可促进肠道益生菌增殖,改善肠道微环境,从而在多方面促进肠道健康[2-7]。因此,从理论上推测,KMOS可通过益生作用和肠-脑轴改善脑功能,发挥其情绪调控作用。在本研究中,KMOS处理小鼠VH-CA3亚区主细胞带神经元的数目显著增加(图2),说明长期摄入KMOS可促进VH神经元的增殖或者存活。而这可能是本研究发现KMOS具有抗焦虑作用的重要机制之一。
人们已发现,巴戟天和菊薯中的菊粉类低聚糖具有抗应激、抗抑郁、抗焦虑和改善动物模型创伤应激症状的作用[17-22]。动物实验和临床实验均表明,巴戟天低聚糖的抗抑郁作用与其增强脑内BDNF神经信号通路相关[19, 23]。而BDNF等神经营养因子可促进脑内,特别是海马等脑区神经元增殖和神经功能的改善和保持[11]。因此本研究组织学结果与这些研究是一致的,支持KMOS也应具备神经生物学效应,可以促进海马CA3亚区神经元的增殖或存活,从而发挥抗焦虑作用。FST是经典的获得性无助行为模型,常用于抗抑郁药物筛选。但本研究未在FST实验中观察到KMOS的抗抑郁效果。一方面,菊粉类低聚糖主要是低聚果糖,而KMOS属低聚甘露糖,结构不同,其抗焦虑和抗抑郁的分子机制应有一定差异。另一方面,本实验是在正常动物而非疾病模型动物上进行的。这两点可能是KMOS对FST实验结果影响不明显的原因。因此我们有必要采用疾病造模的方式,进一步研究KMOS的抗抑郁效应及作用机制。
总之,本研究首次发现,长期KMOS处理可提高小鼠VH-CA3亚区神经元增殖或存活率,并有抗焦虑样作用,提示KMOS作为重要的益生元,在焦虑情绪改善方面有潜在应用价值。
致谢:云南师范大学生命科学学院李彦明、马瑜、古丽柯孜·图尔贡、何丹婷和周丽娟等同学参与了行为学和组织学实验;中科院昆明动物所蔡景霞研究员和徐林研究员提供了实验条件。在此表示感谢。

