TRIML1对肝癌细胞恶性生长的影响①
吴 宪 徐 哲 偏丽丽 赵 敏 李 涛 张纪岩
(安徽医科大学第一附属医院检验科,合肥 230022)
肝癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,每年大约都会发现有超过五十万名成人死于肝癌。尽管HCC的诊断和治疗有一定进展,但由于耐药和易于复发,HCC在很大程度上仍然无法治愈[1-3]。肝癌发生机制多种多样,具体分子机制尚不完全清楚,其中炎症是肝癌发生的关键因素[4]。此外,有研究证明,自分泌的IL-6会促进恶性肿瘤细胞生长[5,6]。现代医学主要研究手术切除肿瘤、放化疗、血管肿瘤介入综合治疗等手术方法,但治疗效果并不理想,年平均生存率仅8%~10%[7,8]。因此研究人类肝癌早期发生及其发展的主要分子机制,对于不断寻求新的肝癌治疗疗法等也有着深远的现实意义。
Tripartite motif family-like 1(TRIML1)编码一种与TRIM家族高度相似的蛋白,区别在于TRIML1缺少B-box域。TRIML1最初发现于小鼠胚胎中,在小鼠胚胎发育的两个细胞胚胎到囊胚阶段均有表达[9]。TRIML1可与USP5相互作用,而USP5可以促进肝癌的发生发展[10]。此外,有文献报道,TRIM家族在许多类型的癌症中发挥重要作用[11-13],其中TRIM11、TRIM31、TRIM52和TRIM59等可以促进肝癌细胞的发生发展[14-18];TRIM16,TRIM26和TRIM50等可以抑制肝癌的发生发展[19-21]。本团队前期Huh7肝癌细胞基因芯片实验结果表明,在Huh7细胞中有TRIML1的表达。由此,本次实验将探究TRIML1在肝癌细胞中的作用。
1 材料与方法
1.1材料
1.1.1主要试剂及动物 胎牛血清,DMEM和F12购自美国HyClone公司;RIPA 蛋白裂解液和MTT细胞增殖分析试剂盒购自碧云天生物公司;LipofectamineTM2000转染试剂盒购自美国Gibco 公司;LipofectamineTMRNA iMaX Reagent购自美国Invitrogen公司;TRIML1抗体购自美国Proteintech 公司;GFP抗体购自日本MBL公司;GAPDH(glyceralde-hyde-3-phosphate dehydrogenase) 抗体购自美国Santa Cruz 公司;辣根过氧化物酶标记的山羊抗小鼠和山羊抗兔IgG二抗购自北京中杉金桥公司;ECL发光液购自美国Thermo公司;人IL-6(hIL-6)ELISA 试剂盒购自美国Abcam 公司;X光片、显影液、定影液购自美国Kodak 公司;PVDF膜购自美国Millipore公司;pEGFP-N1质粒和TRIML1-pEGFP-N1质粒为本实验室构建存放;Agar购自美国Sigma公司;蛋白Marker购自GenStar公司;G418购自Invitrogen公司;CCK8试剂盒购自美国Biotool公司;siRNAs由GenePharma公司合成;6~8周龄BALB/c雄性裸鼠,购自北京维通利华实验动物技术有限公司。
1.1.2仪器设备 CO2培养箱购自美国Thermo 公司;低温高速冷冻离心机购自德国Eppendorf公司;酶标仪购自瑞士Tecan sunrise 公司;紫外分光光度计购自北京普析通用仪器有限责任公司;SDS-PAGE 蛋白电泳及转印仪购自美国Bio-Rad 公司;游标卡尺购自桂林精宓量具量仪有限责任公司。
1.2方法
1.2.1细胞培养 本次实验以HepG2和Huh7肝癌细胞为研究对象。肝癌细胞采用含10 %胎牛血清的DMEM完全培养基(含100 U/ml青霉素钠和100 U/ml硫酸链霉素)培养,37℃,5%CO2细胞孵箱中培养,待细胞长到80%左右,0.9%生理盐水洗3次,0.25 %胰酶消化1 min,含10 %胎牛血清的DMEM培养基终止消化,2 000 r/min离心5 min,弃上清,重悬,计数,传代,用于后续实验操作。
1.2.2筛选TRIML1过表达细胞株 正常HepG2细胞接种到6孔板上,生长到40%~60%时,分别转染pEGFP-N1质粒和TRIML1-pEGFP-N1质粒,转染24 h后加入G418的完全培养基进行筛选,G418工作浓度为600 μg/ml。G418筛选2周后,细胞基本不再死亡,流式分选带有GFP绿色荧光的细胞,即得到过表达TRIML1和GFP空载的稳定细胞株,扩大培养冻存液氮用于后续试验。
1.2.3绘制细胞生长曲线 将生长状态良好的稳定过表达TRIML1的HepG2肝癌细胞和稳定表达GFP空载的对照HepG2肝癌细胞的细胞浓度调整为3×104个/ml,96孔板每孔加100 μl,即96孔板每孔种3×103个/ml的细胞,每组细胞设8个复孔。96孔板在37℃、5%CO2细胞孵箱中培养。分别在细胞铺到96孔板的0、24、48和72 h加入CCK8试剂,每孔10 μl,37℃孵育0.5~4 h,直至培养液变为橘黄色,酶标仪检测450 nm处的OD值,计算平均值,绘制细胞生长曲线。
1.2.4软琼脂克隆形成 分别取0.6 g和1.2 g Agar溶解于100 ml双蒸水中,高压灭菌制备0.6%Agar和1.2%Agar,4℃冰箱保存,使用前微波炉加热融化。按照4.5 ml∶4.5 ml∶1 ml的比例将2×DMEM,1.2%Agar和血清混合制备下层胶,混合过程要轻柔,避免产生气泡,动作要迅速,防止凝胶凝固。6孔板每孔加入1.5 ml混合液,轻摇使其铺匀,4℃促凝20 min。促凝期间,将生长状态良好的稳定过表达TRIML1的HepG2肝癌细胞和稳定表达GFP空载的对照HepG2肝癌细胞的细胞浓度调整为1×104个/ml备用,再将细胞调整为103个/ml,制备细胞悬液。按照1.4 ml∶1.4 ml∶0.35 ml∶0.35 ml的比例将2×DMEM、0.6 %Agar、血清和细胞悬液混合制备上层胶,混合过程要轻柔,避免产生气泡。6孔板每孔加入1 ml混合液,轻摇使其铺匀,4℃促凝20 min。上层胶充分凝固后,6孔板每孔加入1 ml含10 %胎牛血清的1×DMEM完全培养基。37℃、5%CO2细胞孵箱中培养2~3周,弃去上层培养基,每孔加入1 ml MTT,37℃孵育4 h观察集落形成。
1.2.5裸鼠成瘤实验 取适应性饲养1周后的裸鼠8只,取生长状态良好的稳定过表达TRIML1的HepG2肝癌细胞和稳定表达GFP空载的对照HepG2肝癌细胞,将细胞密度调整为1×107个/ml,分别皮下接种于裸鼠的左、右前肢腋下,200 μl/只。从细胞注射开始,每天观察裸鼠生长情况和成瘤状况,用游标卡尺测量瘤子的长短经,计算肿瘤体积,绘制肿瘤生长曲线。1只死亡,1只未成瘤。第17天处死裸鼠,分离瘤体并称重。
1.2.6Western blot 蛋白表达 将生长状态良好的稳定过表达TRIML1的HepG2肝癌细胞和稳定表达GFP空载的对照HepG2肝癌细胞按5×105个/孔接种到6孔板中,37℃、5%CO2细胞孵箱中培养 24 h。利用RIPA蛋白裂解液获得蛋白样品,用紫外分光光度计调整蛋白浓度,加入4×上样缓冲液,100℃水浴10 min使蛋白充分变性,-20℃冻存。准备10%聚丙烯酰胺凝胶,上样,电泳分离后转印至PVDF膜上。5 %脱脂牛奶室温封闭1 h,一抗(TRIML1,GFP和GAPDH)4℃孵育过夜。次日,TBST洗膜 3次,每次15 min,二抗室温孵育1 h,TBST洗膜3次,每次15 min。ECL发光液涂于膜上暗室显影。
1.2.7ELISA 法检测细胞因子 将生长状态良好的稳定过表达TRIML1的HepG2肝癌细胞和稳定表达GFP空载的对照HepG2肝癌细胞接种于24孔板中,2×105个/孔,每组设2个复孔,置于37℃、5%CO2细胞培养箱培养24 h,在实验组细胞中加入鼠TNF-α,刺激8 h,对照组不加TNF-α,收细胞上清于-80℃冰箱冻存,用于后续ELISA检测。按照ELISA试剂盒说明书操作,在酶标仪450 nm和570 nm 波长处读取吸光度值,使用Prism软件分析计算。
1.2.8小干扰RNA(siRNA)敲低TRIML1 Huh7肝癌细胞按2×105个/孔接种至12孔板中,培养24 h后,用LipofectamineTMRNA iMaX Reagent 转染siRNAs。TRIML1 siRNA序列为:siRNA-806#5′-GCACAGATTGAGTCCTCAA-3′,siRNA-1071#5′-CCGACAACCCGGAAAGATT-3′与siRNA-1287#5′-GGGTCTCGTCACCTTTGAA-3′,以非靶点对照RNA(siRNA NC)为对照。转染48 h后,收细胞上清用于ELISA,收蛋白用于Western blot验证。
1.2.9悬浮培养spheres形成 Huh7细胞转染48 h后,胰酶消化,计数,用DMEM/F12培养基(含20 ng/ml 表皮生长因子,10 ng/ml肝细胞生长因子,20 ng/ml成纤维细胞生长因子和1×B27)重悬细胞,调整浓度为1×103个/ml,再加入1%的甲基纤维素,防止细胞聚集,保证形成的spheres是来自单个的细胞。按照100个/孔将细胞接种至96孔低附板,放入37℃、5%CO2培养箱中培养7~14 d后,取出低附板计数直径大于75 μm的spheres数,spheres形成能力用计得的spheres数/种的细胞数×100%表示。

2 结果
2.1过表达TRIML1稳定株Western blot鉴定 分选带绿色荧光的HepG2细胞后,利用Western blot鉴定。Western blot中,综合内参GAPDH和TRIML1和GFP,认为分选得到的细胞为过表达TRIML1稳定株(图1)。
2.2过表达TRIML1对细胞生长曲线的影响 两组生长曲线均呈S型(图2),符合体外细胞培养的生长特点。培养24 h后,过表达TRIML1组的细胞数明显高于对照组,并且持续到72 h,表明过表达TRIML1能促进HepG2细胞的体外生长。
2.3过表达TRIML1对HepG2细胞软琼脂克隆形成的影响 稳定表达pEGFP-N1和TRIML1-pEGFR-N1的HepG2细胞在种入Agar琼脂14 d后用MTT染色4 h可以观察到,两组均有集落形成,克隆数如图3。过表达TRIML1的HepG2细胞集落形成数量明显高于对照组。

图1 过表达TRIML1 的HepG2混合稳定株的鉴定Fig.1 Identification of HepG2 stable mixed-clones over-expressing TRIML1Note:1.Control cells;2.TRIML1 over-expressing cells.
2.4过表达TRIML1对HepG2细胞裸鼠成瘤能力的影响 成瘤过程中,1只裸鼠对照细胞未成瘤,1只裸鼠死亡。注射8 d后有明显瘤块形成,第17天实验结束时,如图4,过表达TRIML1组平均瘤体体积(3.655 0±0.156 3)cm3,明显大于对照组瘤体体积(2.618 0±0.130 6)cm3。同时,过表达TRIML1组平均瘤体质量为(2.226 0±0.179 5)g,明显大于对照组瘤体质量(1.106 0±0.205 8)g,证明过表达TRIML1能促进HepG2细胞的成瘤能力。
2.5过表达TRIML1对HepG2细胞分泌IL-6的影响 在稳定表达pEGFP-N1和TRIML1-pEGFR-N1的HepG2细胞中加入小鼠TNF-α刺激8 h,设立未处理组。取细胞上清ELISA检测发现,过表达TRIML1细胞的人IL-6本底分泌量明显高于对照组;TNF-α刺激8 h后,过表达TRIML1细胞的IL-6分泌量仍高于对照组(图5)。
2.6TRIML1敲低对Huh7细胞生长及IL-6分泌的影响 为反向验证TRIML1对于肝癌细胞分泌IL-6的影响,在Huh7细胞中利用siRNAs敲低TRIML1。Western blot验证3种siRNAs均可敲低TRIML1(图6)。收集细胞上清用于ELISA,显示TRIML1敲低后,Huh7细胞IL-6的分泌量显著下降(图7)。悬浮培养spheres形成实验中,敲低TRIML1也会抑制Huh7细胞的spheres形成(图8)。

图2 过表达TRIML1对HepG2细胞生长曲线的影响Fig.2 Effect of TRIML1 over-expression on growth curve of HepG2 cellsNote:

图3 过表达TRIML1对HepG2细胞软琼脂克隆形成的影响Fig.3 Effect of TRIML1 over-expression on anchorage-independent growth of HepG2 cellsNote:

图4 过表达TRIML1对HepG2细胞裸鼠成瘤能力的影响Fig.4 Effect of TRIML1 over-expression on in vivo tumor growth of HepG2 cells in nude miceNote:

图5 过表达TRIML1对HepG2细胞分泌IL-6的影响Fig.5 Effect of TRIML1 over-expression on secretion of IL-6 in HepG2 cellsNote:

图6 Huh7肝癌细胞敲低TRIML1的鉴定Fig.6 Identification of TRIML1 knockdown in Huh7 cells

图7 敲低TRIML1对Huh7细胞分泌IL-6的影响Fig.7 Effect of TRIML1 knockdown on secretion of IL-6 in Huh7 cellsNote:
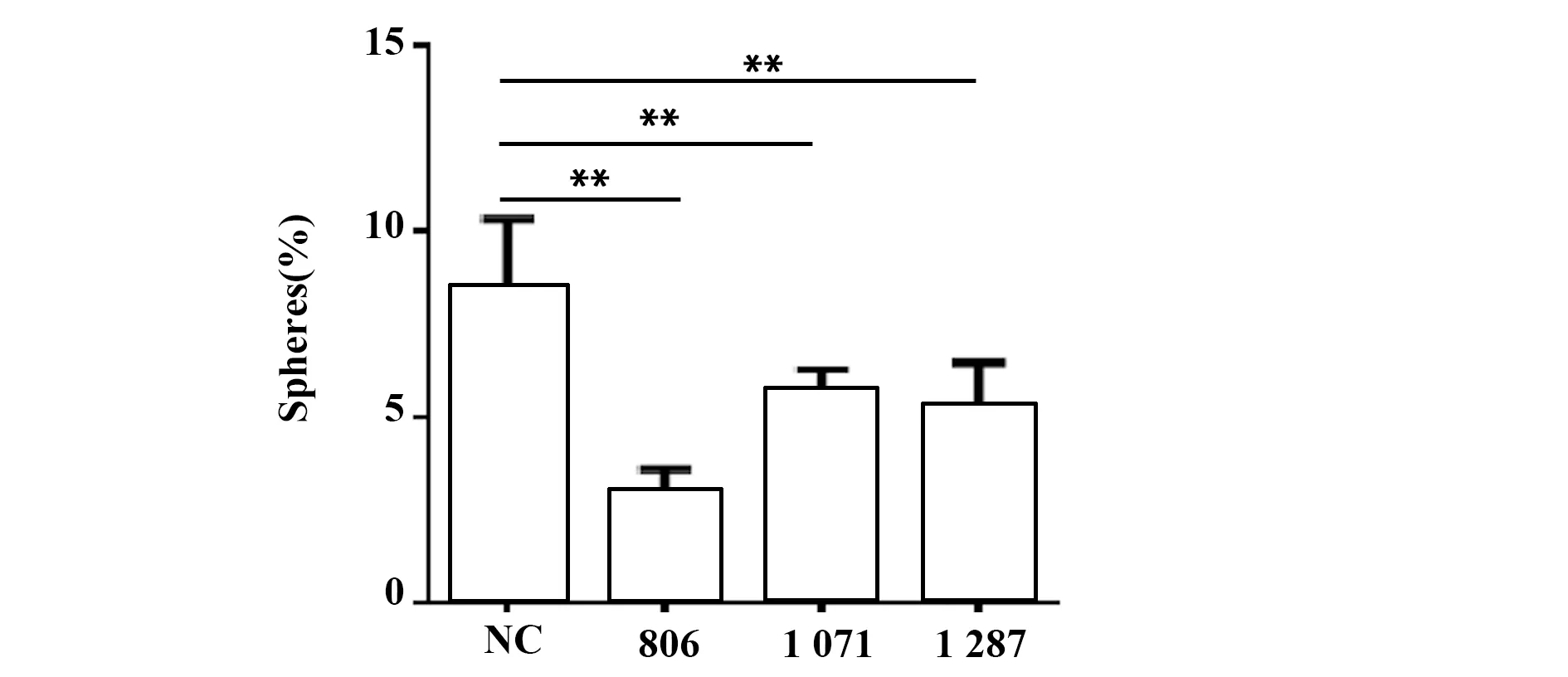
图8 敲低TRIML1对Huh7细胞spheres形成能力的影响Fig.8 Effect of TRIML1 knockdown on sphere formation ability of Huh7 cellsNote:
3 讨论
肝癌是最常见的恶性瘤之一,其预后差、易复发、致死率高和发病率高严重威胁人类的生活与健康。目前已知USP5是肝癌的促癌基因,可以促进肝癌的发生发展,而TRIML1可与USP5相互作用,其作用尚不清楚,而且TRIM家族与肝癌的关系极为密切。因此,通过探讨TRIML1对肝癌细胞恶性增长的影响,希望为肝癌的防治提供新的依据。
在HepG2肝癌细胞中筛选过表达TRIML1稳定株为后续实验提供更好的研究对象。通过CCK8检测到过表达TRIML1稳定株的细胞生长增殖能力明显高于对照组(P<0.01);软琼脂集落形成情况可观察到过表达TRIML1稳定株的集落形成数明显高于对照组(P<0.01),证明TRIML1可以促进HepG2肝癌细胞的体外生长增殖。裸鼠成瘤实验可观察到,过表达TRIML1稳定株组的裸鼠瘤体体积和重量明显高于对照组,进一步证明TRIML1可促进HepG2肝癌细胞的体内生长增殖。有文献报道,HepG2肝癌细胞自分泌IL-6,而自分泌的IL-6则会促进HepG2肝癌细胞恶性生长。因此,在肝癌细胞中分别过表达和敲低TRIML1,探究TRIML1对肝癌细胞分泌IL-6的影响。过表达TRIML1会促进HepG2细胞IL-6本底水平和TNF-α诱导的分泌均上升。而且,在Huh7肝癌细胞中敲低TRIML1,可以抑制Huh7细胞的spheres形成和IL-6的分泌,说明TRIML1促进HepG2细胞恶性生长可能与IL-6分泌量上升有关。
本研究表明TRIML1促进肝癌细胞恶性生长。TRIML1在肝癌细胞的迁移,侵袭以及药物抗性中的作用还有待进一步研究。TRIML1作为一种最新发现的信号分子,其作用也还有待后期实验。