抗人载脂蛋白6单链抗体的筛选、制备及活性鉴定①
陈 炯 詹 飞 冯 巍
(河南科技大学法医学院,洛阳 471023)
人类载脂蛋白6 (human lipocalin 6,hLCN6) 是新发现的一类附睾特异性表达并分泌的载脂家族蛋白,能与精子头部和尾部结合,与精子成熟有关[1]。本实验室曾构建了抗hLCN6杂交瘤细胞株1B2,分泌鼠源单克隆抗体具有较高的组织特异性与灵敏度[2],可用于精子的免疫荧光检测。目前,hLCN6单克隆抗体 (hLCN6 mAb) 偶联的免疫磁珠可有效用于混合细胞中精子的分离与法医学鉴定[3]。与传统单抗相比,小分子重组抗体因分子量小、易于进行基因工程操作而备受重视[4-6],包括单链抗体 (scFv)、双价单链抗体 (bsFv) 和嵌合抗体Fab片段,既保留了亲本抗体所具有的高亲和力和特异性,又简单经济且易于改造,是基于抗原-抗体相互作用分离精子的理想材料。本研究通过构建抗hLCN6全套鼠源scFv噬菌体抗体文库,筛选亲和力和特异性较好的抗hLCN6 scFv,并进行原核表达纯化和鉴定,为后期规模化制备该抗体偶联的免疫磁珠、法医混合斑中精细胞的分离奠定了基础。
1 材料与方法
1.1材料 按照知情同意原则,实验用精液样本及女性口腔上皮细胞样本,分别由本实验室健康成年男性和女性志愿者提供。BALB/c小鼠购自中科院上海实验动物中心;大肠杆菌Escherichiacoli(E.coli)Rosetta(DE3)、pET-28a质粒、hLCN6抗原及小鼠抗hLCN6 mAb 1B2由本室保存或制备;噬菌体载体pFAB5C购自Biovector公司;E.coliXL1-Blue和辅助噬菌体M13KO7购自美国Stratagene公司;Triziol试剂和反转录试剂盒购自Invitrogen公司;膜蛋白提取试剂盒购自美国Biovision公司;Sulfo-NHS-LC-Biotin、DynabeadsTMM-280 Streptavidin和HRP-Streptavidin试剂盒购自Thermo Fisher公司;鼠抗噬菌体M13抗体、HRP-羊抗鼠IgG、BCA蛋白定量试剂盒和增强型化学发光底物 (ECL) 购自Pierce公司;Ni-NTA亲和层析填料购自QIAGEN公司;弗氏佐剂和四甲基联苯胺 (TMB) 购自Sigma-Aldrich;限制性内切酶、dNTPs、Taq酶和DNA连接酶购自TaKaRa公司;DNA胶回收试剂盒和质粒小量提取试剂盒购自北京天根公司;超滤浓缩管购自Millipore公司;引物购自苏州金唯智公司;其他试剂为国产分析纯。
1.2方法
1.2.1全套VH、VL基因的扩增和鉴定 hLCN6抗原的制备及动物免疫方法参照文献[2]。用TRIziol试剂从致敏小鼠的脾细胞中提取总RNA,按照反转录试剂盒说明书进行反转录合成cDNA。根据小鼠免疫球蛋白可变区基因序列中相对保守的框架区FR1、FR4,设计了4对简并引物[7]。序列如下:VHfor:5′-TGGGGSTGTYGTTTTGGCTGMRGAG-ACRGTGA-3′,VHback:5′-SAGGTGMAGCTKCASSA-RTCWGG-3′;VLfor:5′-GGATCAAGTTGGTCCACCATCAGCCCGTTT-3′,VLback:5′-GACATTCTGMTSACMCAGWCTCCA-3′;VH′ for:5′-ACCGCCGGATCCACCGCCACCCGAGCCACCGCCACCTGMRGAGACD-GTGAGCGTGG-3′,VH′ back:5′-ATGACTCGCGGCCCAGCCGGCCSAGGTGCARCTKGTGSAGTCWGG-3′;VL′ for:5′-ATTCTGCGGCCGCTTACCGTTTYATYTCCARCTTKGTCCC-3′,VL′ back:5′-GGCTCGGG-TGGCGGTGGATCCGGCGGTGGCGGTTCGGACATTCT-GMTSACMCAGWCTCCA-3′。其中:r=A/G,Y=T/C,M=A/C,W=A/T,K=G/T,S=C/G,D=G/A/T,划线部分分别为SfiⅠ和NotⅠ酶切位点。以上引物由苏州金唯智公司合成。以cDNA为模板,分别以VHback、VHfor以及VLback、VLfor为引物,PCR扩增全套可变区基因。产物经琼脂糖电泳分离后,切胶回收全部VH、VL基因。
1.2.2全套scFv基因的克隆和鉴定 以纯化的VH、VL全套基因为模板,相应地分别以VH′ back、VH′ for及VL′ back、VL′ for 为引物,在VH的5′端和3′端分别加上SfiⅠ酶切位点、连接肽编码序列;在VL的3′端和5′端分别加上NotⅠ酶切位点、连接肽编码序列。PCR产物经电泳分离后,将全部VH′、VL′基因切胶回收。以纯化的VH′、VL′全套基因互为模板和引物,进行重叠延伸PCR形成编码连接肽(Gly4Ser)3的序列,从而将全套VH′、VL′基因随机拼接为scFv。PCR反应先94℃变性45 s,58℃退火45 s、72℃延伸1 min,循环7次;再加入VH′ back、VL′ for引物,按上述参数继续循环30次。产物经电泳分离后,胶回收全套scFv基因,经SfiⅠ和NotⅠ双酶切后与相同酶切的pFAB5C噬菌体质粒连接。连接产物转化感受态E.coli XL1-Blue,涂布于含100 μg/ml氨苄青霉素和2%葡萄糖的2×YT (2×YTAG) 琼脂板上,37℃培养过夜。随机挑取单克隆抗体进行菌落PCR鉴定。
1.2.3ScFv基因噬菌体抗体库的构建及滴度测定 用15 ml 2×YTAG培养液洗下菌苔,培养至OD600=0.4~0.6,加入2×1010空斑形成单位 (pfu) 辅助噬菌体M13KO7于37℃、220 r/min振荡培养1 h,以1 000 g离心10 min,沉淀用10 ml含100 μg/ml氨苄青霉素和50 μg/ml卡那霉素的2×YT培养基重悬,于37℃、220 r/min振荡培养过夜。次日,1 000 g 离心20 min,收集上清即为噬菌体抗体库。用0.45 μm的微孔滤膜过滤后于4℃保存。将5 μl经适当稀释的噬菌体抗体库加到 100 μl OD600=1的XL1-Blue菌液中,室温放置15 min,涂布于2×YTAG琼脂板上,37℃培养过夜,计算集落形成单位 (cfu) 即为噬菌体抗体库滴度。
1.2.4抗hLCN6 scFv 的筛选 纯化的hLCN6蛋白按Sulfo-NHS-LC-Biotin试剂盒说明书进行生物素化。约5×1011cfu新鲜制备的scFv文库噬菌体用封闭液 (1×PBS缓冲液中含3% BSA,0.05% Tween-20) 于室温封闭1 h,加入10 μg生物素化蛋白于封闭后的噬菌体抗体库中,37℃缓慢振荡孵育1 h。按说明书加入链霉亲和素包被的M-280磁珠于混合液中,振荡孵育30 min捕获抗原-抗体复合物。用含0.1% Tween-20的PBS缓冲液 (PBST) 洗涤磁珠10次,胰酶消化30 min后洗脱噬菌体。洗脱的噬菌体溶液感染XL1-Blue后涂布2×YTAG培养板,37℃培养过夜,同时进行噬菌体滴度检测,计算噬菌体output、input等,完成第1轮筛选。用M13KO7进行超感染,对再次生成的抗体库进行第2轮筛选。该过程重复4轮以获得具有特异性抗体的噬菌体文库。
1.2.5阳性克隆的ELISA检测 将第4轮亲和富集筛选的阳性噬菌体感染E.coliXL1-Blue后,从所涂布的平板上随机挑取单克隆菌落接种到96孔细胞培养板 (含2×YTAG培养基) 培养过夜。次日从该板上转接2 μl菌液至第二块96孔板,37℃培养至OD600=0.6~0.8时加入1 mmol/L IPTG诱导,30℃培养过夜。次日离心取上清进行ELISA检测[8]。用hLCN6抗原 (2 μg/孔) 包被96孔酶标板,经5%脱脂奶粉封闭后,每孔加入30 μl诱导上清,阴性对照孔加入辅助噬菌体M13KO7超感染的pFAB5C空载体离心上清,阳性对照孔加入抗hLCN6 mAb,空白对照孔直接加PBS,室温孵育1 h。PBST洗3次后,每孔加入1∶5 000稀释的鼠抗噬菌体M13抗体,室温孵育1 h。洗板3次后,加入HRP-羊抗鼠IgG孵育1 h。再以PBST洗板3次后加入TMB底物显色,然后加入2 mol/L H2SO4终止反应,酶标仪读取OD450值。阳性克隆菌株确定标准为:OD值为阴性对照值3倍以上。
1.2.6阳性克隆的基因序列分析及表达纯化 对ELISA检测阳性克隆进行测序以确认抗体序列。根据pFAB5C载体序列合成测序引物。P1:5′-TATGCTTCCGGCTCGTATGT-3′,P2:5′-GTCAGACGATTGGCCTTGAT-3′。再以阳性噬菌体质粒为模板,用上游引物5′-GGAATTCCATATGGTCAAACTGCAGCAGTCTGG-3′ (划线部分为NdeⅠ限制性酶切位点)、下游引物5′-CCGCTCGAGCTACCGTTTTATT-TCCAGCTTGGTCCC-3′ (划线部分为XhoⅠ限制性酶切位点) 扩增不含基因Ⅲ信号肽序列的scFv基因,连接到pET-28a表达载体后转化E.coli Rosetta (DE3),挑取单菌落于LB液体培养基中 (含50 μg/ml 卡那霉素和34 μg/ml氯霉素) 过夜培养,再以 1∶100的比例放大培养至OD600=0.6~0.8,加入1 mmol/L IPTG于37℃诱导表达6 h。离心收集菌体,悬浮于20 ml裂解缓冲液 (50 mmol/L Tris-Cl,150 mmol/L NaCl,100 μg/ml 苯甲基磺酰氟,pH 8.0) 中,置于冰上进行超声破碎。将菌体裂解液15 000 r/min 离心20 min,收集上清,用0.45 μmol/L滤膜过滤,上样于Ni-NTA螯合柱,用20%的洗脱缓冲液 (50 mmol/L Tris-Cl,150 mmol/L NaCl,250 mmol/L 咪唑,pH8.0) 洗脱5个柱体积,之后以100%洗脱缓冲液洗脱,收集各洗脱峰,进行SDS-PAGE分析后合并高纯度样品。将合并的样品透析过夜后后用超滤法浓缩。以BCA法进行定量。
1.2.7抗hLCN6 scFv的生物学活性鉴定
1.2.7.1Western blot检测 纯化的scFv蛋白按Sulfo-NHS-LC-Biotin试剂盒说明书进行生物素化。将诱导后的hLCN6表达菌株裂解后上样,经SDS-PAGE电泳后转膜,进行Western blot检测。精子与口腔上皮细胞混合悬液的制备参照文献[3]。取精子(1×105个/ml)和口腔上皮细胞(1×104个/ml)悬液各1 ml,用膜蛋白提取试剂盒提取精子细胞膜蛋白,BCA法检测蛋白浓度,每份样品取等量 (80 μg) 进行Western blot检测。一抗为1∶200稀释的生物素标记的scFv,二抗为1∶500稀释的HRP标记的链酶亲和素,用ECL化学发光底物显影成像。
1.2.7.2间接ELISA法检测抗hLCN6 scFv的亲和力 参考文献[3],scFv按Sulfo-NHS-LC-Biotin试剂盒说明书进行生物素化。利用间接ELISA法测定抗hLCN6 mAb的亲和力,以1 μg/ml hLCN6蛋白包被酶标板,用含3%脱脂奶粉的PBS溶液室温封闭1 h,PBS洗涤。加入倍比稀释的scFv,室温孵育1 h。PBST洗板3次,加入HRP标记的链酶亲和素,室温孵育1 h。洗涤后加底物溶液避光显色,酶标仪读取OD450值。当连续几个稀释度的OD450读数不再增大时视为抗原抗体100%结合,以抗体浓度 (mol/L) 为横坐标,OD450吸光值为纵坐标作散点图,生成对数趋势线和公式。将OD450最大值的一半代入公式,求出此时的抗体浓度即为scFv的亲和力解离常数(Kd)。
2 结果
2.1全套scFv基因的克隆与噬菌体抗体库的构建 将全套VH、VL基因扩增产物进行电泳后,扩增出的VH基因片段约为340 bp,VL基因片段约为320 bp,与预期大小一致 (图1A)。将全套VH、VL基因添加酶切位点及连接肽序列后,用重叠延伸PCR将重、轻链可变区拼接成完整的scFv基因,拼接扩增产物经电泳后,得到1条约710 bp的片段,同预期结果相符 (图1B)。将拼接产物双酶切后与载体连接,转化E.coli后铺板,测定库容为1.5×106,随机挑取10个集落,PCR扩增鉴定重组率为90% (图1C)。
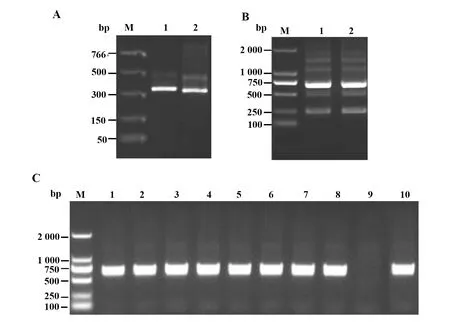
图1 全套scFv基因的克隆与鉴定Fig.1 Cloning and identification of anti-hLCN6 scFv geneNote: A.PCR amplification of VH and VL gene repertoires;M.DNA marker.Lane 1.Product of VH gene;Lane 2.Product of VL gene;B.Identification of scFv gene products;M.DNA marker;Lane 1-2.PCR products of scFv gene;C.PCR identification of recombinant scFv clones.
2.2噬菌体抗体库的筛选及阳性克隆的鉴定 噬菌体抗体库经4轮富集筛选后,噬菌体抗体收获率由第1轮的2.5×10-8增加到第4轮的3.3×10-5,富集倍数增加1 000多倍 (表1)。将第4轮亲和富集筛选的阳性噬菌体感染E.coliXL1-Blue后,从所涂布的平板中随机挑取48个单克隆菌落接种于96 孔板中进行培养并诱导表达scFv,用ELISA进行初步筛选,最后得到2株阳性克隆,其分别命名为AM38-6和AM38-7。测序分析表明,2个克隆为同一序列。其中重链可变区基因长342 bp,编码114个氨基酸;轻链可变区基因长327 bp,编码109个氨基酸 (图2)。NCBI blast分析表明,该scFv基因序列符合数据库中单链抗体所具有的特点,其重链可变区与小鼠IgG的γ重链同源性达95.8%,轻链可变区与小鼠κ链同源性达97.9%,重链和轻链可变区具有完整的骨架区和互补决定区 (划线序列) 结构。
表1 亲和富集筛选对抗hLCN6 scFv的富集效应
Tab.1 Selective enrichment of anti-hLCN6 phage antibodies from phage display library

Round Input(cfu)Output(cfu)Recovery rate(output/input)Enrichment[rate(n)/rate(1)]11.0×10132.5×1052.5×10-8121.5×10122.0×1061.3×10-65232.0×10123.8×1071.9×10-576042.4×10127.9×1073.3×10-51 320

图2 抗hLCN6 scFv基因序列分析Fig.2 Sequence analysis of anti-hLCN6 scFv geneNote: Underline.CDR region;Bold.Linker.
2.3抗hLCN6 scFv的表达纯化与生物学活性鉴定 转化hLCN6 scFv表达质粒的工程菌经诱导培养后,离心收集上清,经Ni-NTA亲和层析柱分离纯化后,收集目的蛋白进行SDS-PAGE检测,经考马斯亮蓝染色后呈单一蛋白条带,表明纯化的scFv具有较高的纯度。蛋白样品分子量约为27 kD,与scFv理论分子量基本一致 (图3A)。scFv经浓缩和BCA法定量后,其浓度为2.65 mg/ml。Western blot显示,以纯化的生物素标记的scFv作为一抗,在诱导菌株裂解物和精子中均检出hLCN6蛋白,与蛋白已知分子量一致,而口腔上皮细胞中检测结果呈阴性,证明scFv可与hLCN6抗原发生特异性结合(图3B~D)。利用间接ELISA实验测定抗hLCN6 scFv的亲和力,结果表明该抗体与抗原的Kd值为6.69×107mol/L (图4)。
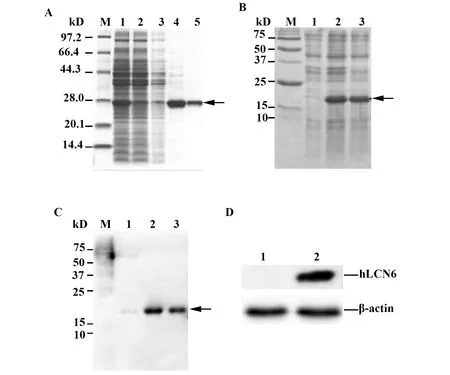
图3 抗hLCN6 scFv的纯化与活性鉴定Fig.3 Purification and activity identification of anti-hLCN6 scFvNote: A.ScFv purification by affinity chromatography with a Ni-NTA column;M.Protein marker;Lane 1.Supernatant of lysed bacteria after induction;Lane 2.Loading solution passed through a Ni-NTA column;Lane 3.Elution with wash buffer containing 50mM imidazole;Lane 4-5.Elutions with buffer containing 250mM imidaz-ole;B.hLCN6 expression in E.coli Rosetta (DE3);M.Protein marker;Lane 1.Rosetta (DE3)/pET-28a-hLCN6 (IPTG uninduced);Lane 2.Rosetta (DE3)/pET-28a-hLCN6 (IPTG induced);Lane 3.Precipitation of hLCN6 protein strain after ultrasonication.hLCN6 is indicated with an arrow;C.Western blotting analysis of figure B with anti-hLCN6 scFv;D.Western blotting analysis of hLCN6 expression in spermatozoa and buccal epithelial cells with anti-hLCN6 scFv.Lane 1.Buccal epithelial cells; Lane 2.Spermatozoa.
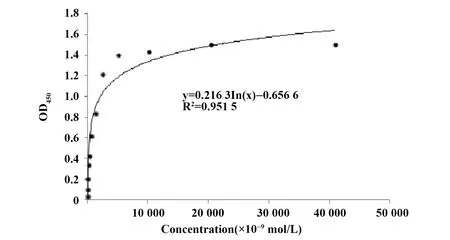
图4 抗hLCN6 scFv亲和力测定Fig.4 Affinity assay of anti-hLCN6 scfv
3 讨论
精子在附睾中所进行的表面修饰是精子成熟过程中不可或缺的一步[9]。hLCN6是新发现的一个附睾特异性分泌表达的载脂家族蛋白,它能够结合到精子的头部和尾部,与精子的成熟有关。本实验室曾以E.coli表达纯化的hLCN6为抗原,获得了抗hLCN6 mAb,其偶联的免疫磁珠可成功用于混合细胞中精子的分离与鉴定。但由于mAb制备成本较高,难以满足大规模法医检案的需要,因此制备经济有效的基因工程抗体成为必需。本实验室曾用RT-PCR法从杂交瘤细胞中克隆抗体可变区基因,但得到的scFv无抗原结合活性,原因可能是设计的简并引物改变了第一骨架区氨基酸序列,从而影响了抗原与抗体的结合[10]。近年来,噬菌体抗体已成为基因工程抗体研究的热点,并被广泛应用于生命科学各个领域[11-13]。通过噬菌体展示技术可以快速制备出针对几乎所有抗原的功能抗体片段。scFv是目前研究最多的基因工程抗体之一,其免疫原性低,能较好地保持对抗原的亲和性,且易于基因操作和大量生产[14],对法医物证检案颇具价值。
因此,为了快速制备鼠源抗hLCN6 scFv,本研究利用噬菌体展示技术成功构建了全套scFv噬菌体抗体库,最终获得了2株能与hLCN6抗原特异结合的阳性克隆。构建的工程菌经IPTG诱导后呈可溶性表达,进而采用亲和层析纯化,获得了高纯度的scFv抗体。Western blot和间接ELISA实验表明,纯化的scFv与hLCN6具有较高的亲和力,能够特异性的识别并结合精子上的hLCN6蛋白。
综上,与本实验室曾采用的以E.coli原核表达系统制备抗hLCN6 scFv相比,利用噬菌体展示技术制备scFv更能保持其抗原结合活性,可大量生产,为后续构建抗hLCN6 scFv免疫磁珠用于法医混合检材中精细胞的鉴定与分离奠定了基础。