谷胱甘肽保护的铜纳米簇合成及其在Pb2+和Ag+检测中的应用
毛月圆, 许业雕, 李 智, 马蒙蒙, 李朝阳, 汪徐春*
(1.安徽科技学院 化学与材料工程学院,安徽 蚌埠 233030;2. 复旦大学 聚合物分子工程国家重点实验室,上海 200438)
纳米材料是近些年来热门的研究方向,由于纳米材料具有尺寸依赖的电学、光学、磁性及化学性质,而被广泛应用于各个领域[1]。特别是具有丰富的类分子性质的纳米团簇材料吸引了众多研究者的兴趣[2]。纳米团簇材料包含数十个金属原子,其尺寸与电子的费米波长接近,因此呈现出介于金属原子和金属纳米粒子丰富的物理化学性质。纳米团簇材料具有较强的荧光、良好的光稳定性以及较高的荧光效率,因此荧光纳米团簇材料已经发展为一类新型的荧光材料。常见的金属团簇主要包括AuNCs、AgNCs、CuNCs及由两种金属原子构成的合金纳米簇。由于Cu在水溶液中易被氧化这一性质限制了铜纳米簇材料的应用,与金纳米簇及银纳米簇的合成及应用的相关报道比较多。经过对铜纳米簇材料合成的探索与研究,由DNA[3]、氨基酸[4]、蛋白质[5]及聚合物[6,7]保护的铜纳米簇具有较好的稳定性,增加了铜纳米的应用。与AuNCs和AgNCs相比,CuNCs还具有材料廉价、简单易得的特点,并且CuNCs同样具有超小尺寸、生物相容、低毒性和荧光性质等特点,被广泛的应用于金属离子、pH、小分子物质、蛋白质、核酸等检测和生物标记成像等领域[8]。
铜纳米簇材料可用于检测多种金属离子,主要包括Fe3+[9-12]、Cu2+[7,13-16]、Al3+[17]、Hg2+[18-19],Pb2+[20]等金属离子,由于铜纳米簇材料的稳定性及发光效率不佳,采用模板法合成的铜纳米簇具有较好的稳定性和较高的发光效率,常用的模板是各种生物分子,如蛋白质、DNA、聚合物等。例如牛血清蛋白(BSA)保护的CuNCs被用于Pb2+的检测[20];谷胱甘肽保护的CuNCs用于检测溶液中的Hg2+[19];青霉胺保护的CuNCs用于检测溶液中的Fe3+[9];半胱氨酸保护的CuNCs用于检测Al3+[21];谷胱甘肽保护的CuNCs用于检测Cu2+[16]。CuNCs在离子检测方面呈现的良好的性质,可以合成性质更加丰富的CuNCs并应用于其他离子的检测中。
银元素为人类生活中广泛应用的一种重金属元素,其单质或离子被广泛应用于生物医药、电池材料、半导体及成像领域[22]。由于含银材料具有一定的抗菌性能,因此在生物医药领域被用于以抗菌药、消毒试剂。正是由于银离子在人类生活中的应用广泛,将会在人体内大量聚集,引起多种疾病。到目前为止,并没有关于CuNCs应用于金属Ag+检测的相关报道。
本文合成了一种还原型谷胱甘肽保护的铜纳米簇CuNCs@GSH,此铜纳米簇的荧光极弱,加入Pb2+形成聚集体,其荧光增强,形成CuNCs@GSH-Pb复合物;再向此聚集体溶液中加入Ag+时,使其荧光逐渐淬灭。铜纳米簇材料实现了对Pb2+和Ag+两种离子的检测,并且呈现较好的离子选择性。因此,可将其用作溶液中重金属离子Pb2+和Ag+的检测中。
1 材料与方法
1.1 仪器与试剂
CuCl2·2H2O(AR,99%),L-谷胱甘肽(RG,99%),NaOH(AR,96%),Pb(NO3)2(RG,99%),AgNO3(RG,99%),均购于上海泰坦科技有限公司。
UV-2450紫外可见分光光度计(日本岛津公司); FL-4600荧光光谱仪(日本Hitachi); 透射电子显微镜(日本日立)。
1.2 谷胱甘肽保护的铜纳米簇的合成
分别取1 mL 0.08 mol/L CuCl2溶液与 5.0 mL 0.08 mol/L谷胱甘肽(L-GSH)溶液加入到反应瓶中,充分混合,溶液由无色变为黑色,再由黑色变为微黄色。向装有反应产物的反应瓶中滴加0.2 mol/L NaOH溶液调节至pH=5.0,有乳白色浑浊絮状物生成,放在低温冷却液循环系统中搅拌反应1 h,得到谷胱甘肽保护的铜纳米簇CuNCs@GSH。
2 结果与分析
2.1 谷胱甘肽保护的铜纳米簇的表征
从透射电子显微镜(图1a)可以看出,所制备的铜纳米簇的的尺寸大约为5 nm左右,其晶格距离为2.1 Å,此晶面间距对应了铜立方结构的(111)晶面。由XRD图可得,此铜纳米簇主要有3个衍射峰:31.55Å、45.17Å、64.50Å。根据布拉格方程2dsinθ=nλ,可计算出对应的晶面间距分别为2.88 Å、2.02 Å和1.45 Å。由2θ=45.17°,晶面间距为2.02 Å,接近于TEM数据中的晶面间距2.1 Å,对应了铜立方结构(111)晶面。通过透射电子显微镜可以看出,向CuNCs@GSH中加入Pb2+后,CuNCs@GSH出现聚集形成颗粒较大的聚集体(图1c)。
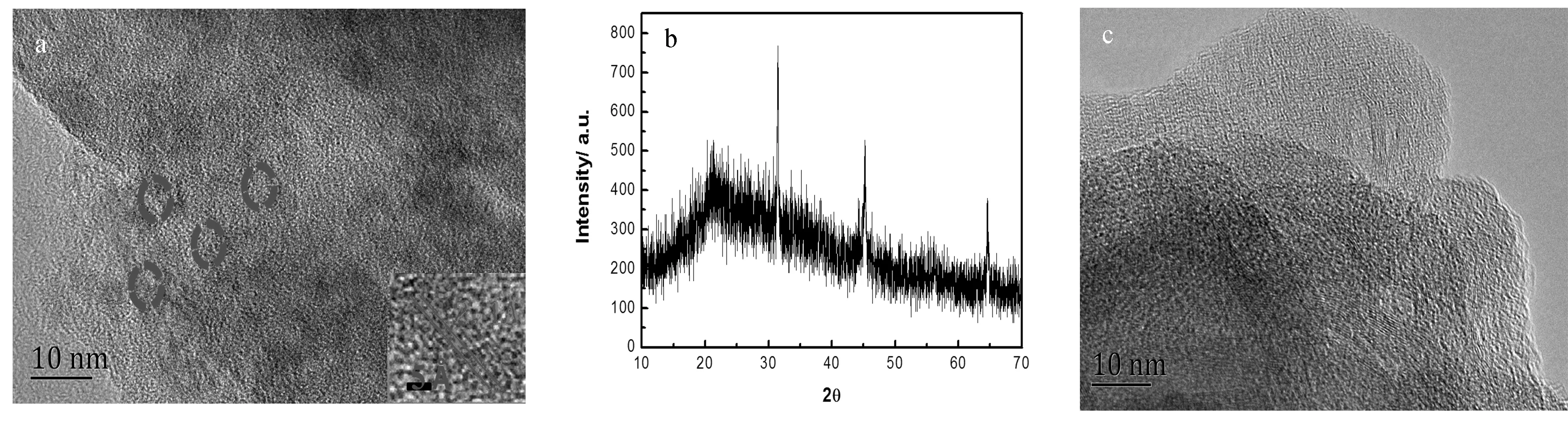
图1 铜纳米簇CuNCs@GSH的(a)透射电子显微镜图片,(b)CuNCs@GSH的X射线粉末衍射图,(c)CuNCs@GSH加入Pb2+后,聚集体的透射电子显微镜图片Fig.1 (a)TEM image of CuNCs@GSH; (b) XRD spectra of copper nanoclusters; (c) TEM image of aggregate after adding Pb2+to CuNCs@GSH
2.2 CuNCs用于检测Pb2+
2.2.1 CuNCs用于检测Pb2+合成的铜纳米簇溶液,荧光较弱。向铜纳米簇溶液中逐渐加入铅离子时,铜纳米簇在620 nm处的荧光明显增强在Pb2+浓度在300 μM时荧光强度最强;当继续向溶液中加入铅离子时,荧光会逐渐减弱。荧光逐渐增强是由于Pb2+可以与谷胱甘肽保护铜纳米簇表面残留的羧基之间存在强的静电吸附作用,通过形成 GSH-Pb2+-GSH使分散在水溶液中的GSH-Cu(I)复合物相互靠近,形成聚集体CuNCs@GSH-Pb2+-GSH@CuNCs (CuNCs@GSH-Pb),电子从配体转向Cu2+和Pb2+使溶液荧光显著增强;Pb2+浓度过大时将会引起荧光再次减弱,这是由于铅离子的加入使得CuNCs聚集,从体系中沉淀出来,从而使得荧光减弱。

图2 向制备的铜纳米簇CuNCs@GSH中逐渐加入Pb2+时,溶液荧光变化趋势(Ex=365 nm)插图为(左)制备的铜纳米簇荧光照片和(右)加入Pb2+后的铜纳米簇溶液的荧光照片Fig.2 The fluorescence intensity changes of CuNCs as adding Pb2+ (Ex=365 nm)Insert:The fluorescence images of CuNCs@GSH before (left) and after (right) adding Pb2+
2.2.2 CuNCs选择性 为了排除其他离子对铜纳米簇荧光性质的影响,我们进行了离子选择性实验。向制备的铜纳米簇中加入不同种类的常见离子,向铜纳米簇中加入这些离子后,测定其荧光光谱(如图3所示,1~8分别表示Pb2+、Ag+、Ca2+、Fe2+、Hg2+、K+、Mg2+、Na+),可以看出此铜纳米簇在加入Pb2+时,其荧光明显增强;向溶液中加入其它常见阳离子,其荧光并无明显变化,可以说明此铜纳米簇用于检测Pb2+具有较高的选择性。

图3 (a)铜纳米簇CuNCs@GSH对离子选择性的荧光光谱图;(b)铜纳米簇选择性柱状图(Insert:加入不同离子后的铜纳米簇的荧光照片,1-9分别表示blank, Pb2+、Ag+、Ca2+、Fe2+、Hg2+、K+、Mg2+、Na+,加入的离子浓度为1 000 μM)Fig.3 (a) The selectivity of CuNCs@GSH to other common ions; (b) Column data of selectivity of CuNCs@GSH and 1-9 respect Pb2+、Ag+、Ca2+、Fe2+、Hg2+、K+、Mg2+、Na+, respectively and the concentration of ions was 1 000 μM
2.3 CuNCs@GSH-Pb复合物用于检测Ag+
2.3.1 CuNCs@GSH-Pb复合物用于检测Ag+通过向铜纳米簇得到荧光较强且在水中能够稳定存在的CuNCs@GSH-Pb复合物,向此复合物溶液中加入Ag+时,出现荧光淬灭的现象。我们向制备的具有较强荧光的复合物CuNCs@GSH-Pb中逐渐加入不同浓度Ag+溶液,通过滴定实验结果衡量复合物CuNCs@GSH-Pb对Ag+的检测性质。在逐渐向复合物CuNCs@GSH-Pb中加入Ag+时,在620 nm处的荧光逐渐减弱。这可能是由于随着银离子的加入,表面的GHS捕获了溶液中的Ag+,谷胱甘肽与Ag+间进行配位,阻断了由周围GSH到CuNCs间的电荷转移过程,从而导致铜纳米簇的荧光减弱并消失。
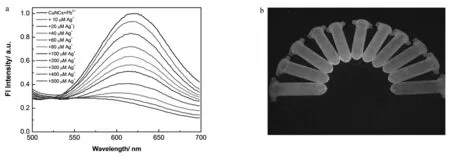
图4 (a)向CuNCs@GSH-Pb复合物溶液中逐渐加入Ag+时,溶液荧光的变化趋势(Ex=365 nm);(b)向CuNCs@GSH-Pb复合物溶液中加入不同量的Ag+溶液,在紫外灯下,混合溶液的荧光照片Fig.4 Fluorescence spectra changes (a) and fluorescence images (b) of CuNCs@GSH-Pb complex as adding Ag+to the solution (Ex=365 nm)
2.3.2 CuNCs@GSH-Pb复合物离子选择性 向CuNCs@GSH-Pb复合物溶液中加入不同的常见离子,发现此CuNCs@GSH-Pb复合物的荧光不受其他离子的影响,只有在加入Ag+时,溶液的荧光逐渐减弱并消失;加入其它常见离子(Fe2+、K+、Mg2+、Na+、Sn2+、Ca2+、Al3+、Hg2+、NH4+、Zn2+)时,仅有Hg2+对CuNCs@GSH-Pb复合物的荧光有较弱的淬灭效果,其它离子并未对CuNCs@GSH-Pb复合物的荧光产生明显影响,说明CuNCs@GSH-Pb复合物对Ag+的检测具有较高的选择性。
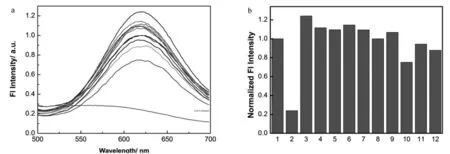
图5 CuNCs@GSH-Pb复合物对不同离子的选择性荧光光谱(a)及620 nm处荧光变化柱状图(b)(1-12分别表示blank、Ag+、Fe2+、K+、Mg2+、Na+、Sn2+、Ca2+、Al3+、Hg2+、NH4+、Zn2+,浓度为1 000 μM)Fig.5 (a)The selectivity of CuNCs@GSH-Pb complex to other common ions; (b) Column data of selectivity of CuNCs@GSH-Pb and 1-12 respect blank, Ag+,Fe2+,K+,Mg2+,Na+,Sn2+,Ca2+,Al3+,Hg2+,NH4+,Zn2+, respectively
3 结论与讨论
实验通过一步法合成了一种荧光型铜纳米簇CuNCs@GSH,并通过透射电子显微镜和X射线粉末衍射仪进行了表征,透射电镜及XRD都显示铜纳米簇的晶面间距约为2.1 Å,恰好对应铜立方晶体的(111)晶面。向此CuNCs@GSH中加入Pb2+之后,其荧光强度增强,这是由于Pb2+诱导CuNCs@GSH聚集使其在620 nm处的荧光显著增强,形成CuNCs@GSH-Pb复合物;向CuNCs@GSH-Pb复合物中加入Ag+之后,在620 nm处荧光明显降低。此CuNCs@GSH能够检测溶液中的Pb2+和Ag+,并且具有较高的选择性。本方法合成的谷胱甘肽保护的铜纳米簇可以作为一种能够顺序检测Pb2+和Ag+的荧光纳米材料。

