基于核磁共振代谢组学分析糖尿病大鼠脑区特异性代谢变化
倪志涛,季慧,高红昌,郑宏,张华杰
(温州医科大学药学院,浙江温州325035)
糖尿病是一种因体内胰岛素分泌缺陷或生物功能受损而导致的全身代谢性疾病[1]。糖尿病往往会出现涉及全身多个器官的严重并发症,其发病率逐年增加[2]。早在1922年就发现了糖尿病能引起认知功能障碍[3],其表现为智力减退和灵活性降低等[4]。糖尿病脑病作为糖尿病的并发症之一会严重降低患者的生活质量[5],但是其发病机制尚不明确。
代谢组学是继基因组学和蛋白质组学之后新发展起来的一门学科,是系统生物学的重要组成部分[6]。基于核磁共振代谢组学技术能够系统地分析机体受到疾病干预情况下代谢物变化[7],其凭借样品制备简单、分析速度快、重现性高等优势广泛应用于脑代谢研究[8]。现阶段的脑代谢研究主要集中在与学习记忆密切相关的海马组织,而对其他脑区的关注较少,因此本研究运用基于核磁共振代谢组学技术分析糖尿病大鼠大脑皮层、纹状体、下丘脑和中脑等脑区的代谢变化,为探索糖尿病脑病的潜在代谢机制提供新线索。
1 材料和方法
1.1 仪器、试剂与动物 BrukerAVANCEIII600核磁共振谱仪(德国Bruker公司);冷冻干燥机(ALPHA-4,德国Christ公司)。血糖仪及血糖试纸(德国贝朗医疗国际贸易有限公司);重水(D2O,99.9%)购于美国剑桥同位素实验室;链脲佐菌素(streptozocin,STZ)购自美国Sigma-Aldrich公司;枸橼酸、枸橼酸钠、甲醇、氯仿购于上海国药集团化学试剂有限公司。雄性SD大鼠20 只,体质量180~200g,购于上海斯莱克实验动物有限公司,饲养于温州医科大学实验动物中心SPF级动物房,室温(22±2)℃,相对湿度45%±3%,动物许可证号:SYXK(沪)2017-0008。本研究通过实验动物伦理学委员会批准。
1.2 方法
1.2.1 建立1 型糖尿病大鼠模型:雄性SD大鼠适应性饲养1周后随机分成糖尿病组和对照组,每组8只。糖尿病组大鼠禁食12h后分别按体质量单次腹腔注射65mg/kg的STZ枸橼酸钠混悬液,对照组给予相同体积的枸橼酸钠溶液,72h后分别测其空腹血糖水平,以大鼠血糖值大于16.7mmol/L代表造模成功。
1.2.2 大鼠脑组织收集与处理:大鼠经造模成功
10周后断头处死,迅速分离出大脑皮层、纹状体、下丘脑和中脑,并将分离出的组织放入液氮中急冻,之后储存于-80℃。取样本称重后置于匀浆管内,分别加入冰甲醇4mL/g,蒸馏水0.85mL/g,使用组织匀浆机匀浆后涡旋15s;再分别加入2mL/g冰氯仿和冰蒸馏水,涡漩后于冰上静置15min[9]。4℃、12000×g离心15min后取上层溶液置于冻干机内冻干24h。最后将冻干粉末重新溶解于500μLD2O中,4℃、12000×g 离心10min后将上清液转入NMR样品管中进行测试。
1.2.31HNMR图谱采集与分析:使用BrukerAVANCEIII600MHz超导高分辨核磁共振谱仪采集1HNMR图谱。采用zgpr标准脉冲序列,仅用预饱和方式压制水峰。具体参数如下:采样标准温度298K,谱宽12000Hz,数据采集点数64K,弛豫延迟10s,累加次数256次,每次扫描时间2.65s。采集到的图谱均采用BrukerTopspin2.1软件进行相位及基线调整,并以乳酸甲基峰的化学位移(1.33ppm)进行定标。将同组样本导出的数据一起导入到MATLABR2010软件(美国MathWorks公司)中进行相位调整,然后对谱峰段(0.5~9.0ppm)以0.01ppm的间隔进行积分切割。为了消除负值和水峰的影响,将各组样本数据中的负值和水峰(4.60~5.20ppm)置零。对每一段积分值都相对于该谱的所有积分值进行归一化[10-11],然后将数据导入SIMCA-P+12.0软件(瑞典Umetrics公司)进行主成分分析(principalcomponentanalysis,PCA),所得谱图的X轴和Y轴分别代表第一主成分(firstprincipalcomponent,PC1)和第二主成分(secondprincipalcomponent,PC2)。
1.3 统计学处理方法 应用SPSS13.0统计软件进行统计学处理。计量资料以表示,2组间比较采用独立样本t 检验。P <0.05 为差异有统计学意义。
2 结果
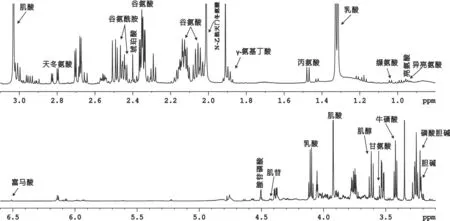
图1 糖尿病大鼠大脑皮层组织典型1HNMR代谢指纹图谱
2.1 糖尿病大鼠脑区代谢模式分析 图1为大鼠大脑皮层的典型1D1HNMR谱,纹状体、下丘脑、中脑的谱图与大脑皮层谱图极为相似,故不做展示。通过相关文献,并结合NMRSuite7.0软件和人类代谢数据库(www.hmdb.ca)进行分析鉴定,归属出的代谢物有亮氨酸、异亮氨酸、缬氨酸、乳酸、丙氨酸、γ-氨基丁酸、N-乙酰天门冬氨酸、肌酸、胆碱、磷酸胆碱、牛磺酸、甘氨酸、腺苷磷酸、肌苷、富马酸、天冬氨酸、琥珀酸、谷氨酸、谷氨酰胺、肌醇。2组大鼠4个脑区代谢物的PCA分析结果表明,糖尿病组和对照组大鼠4个脑区代谢物在PC1方向上均有明显区分,代谢模式差异明显(见图2)。从相对应的载荷图中可以发现乳酸、肌酸、谷氨酸、N-乙酰天门冬氨酸等在大脑皮层的代谢模式区分中贡献较大。谷氨酸、谷氨酰胺、γ-氨基丁酸、肌醇、牛磺酸等在纹状体的代谢模式区分中贡献较大。乳酸、肌醇、磷酸胆碱、牛磺酸、γ-氨基丁酸等在下丘脑的代谢模式区分中贡献较大。另外,乳酸、谷氨酸、谷氨酰胺、亮氨酸、磷酸胆碱等在中脑的代谢模式区分中贡献较大。
2.2 脑区代谢物定量分析结果 对代谢物进行定量分析发现,与对照组大鼠相比,糖尿病组大鼠大脑皮层中乳酸、牛磺酸、肌酸、磷酸腺苷、谷氨酸、缬氨酸、天冬氨酸等代谢物含量显著上升,而甘氨酸、磷酸胆碱、肌醇、富马酸、谷氨酰胺、γ-氨基丁酸等代谢物出现下降(P <0.05),见图3。与对照组大鼠相比,糖尿病组大鼠纹状体中乳酸、牛磺酸、磷酸胆碱、磷酸腺苷的含量显著升高,而丙氨酸、甘氨酸、肌酸、胆碱、肌苷、亮氨酸、异亮氨酸、缬氨酸、N-乙酰天门冬氨酸、γ-氨基丁酸等代谢物出现下降(P<0.05),见图4。与对照组大鼠相比,糖尿病组大鼠下丘脑中肌醇、牛磺酸、磷酸胆碱含量显著上升,而胆碱、N-乙酰天门冬氨酸、琥珀酸、亮氨酸、谷氨酸、谷氨酰胺、γ-氨基丁酸等代谢物出现下降(P<0.05),见图5。与对照组大鼠相比,糖尿病组大鼠中脑中乳酸、肌醇、磷酸胆碱的含量显著上升,而丙氨酸、磷酸腺苷、N-乙酰天门冬氨酸、肌醇、琥珀酸、亮氨酸、异亮氨酸、谷氨酸、谷氨酰胺、γ-氨基丁酸、丙氨酸、富马酸等代谢物出现显著下降(P<0.05),见图6。
3 讨论
糖尿病患者出现认知功能损伤的确切机制至今不明,研究人员更多关注于持续高血糖造成的神经元功能紊乱、氧化应激、糖基化终产物产生增多等机制。而本研究从基于1HNMR的代谢组学角度出发,分析糖尿病对不同脑区代谢所带来的影响,有助于更加深入了解糖尿病脑病的发病机制。
3.1 糖尿病大鼠脑区特异性能量代谢紊乱 大脑正常生理活动所需的能量占人体能量总消耗的20%以上,脑病的发生与脑内能量代谢变化也有着密切联系[12-13]。本研究发现,与对照组相比,糖尿病大鼠的大脑皮层、纹状体、中脑三个脑区中乳酸的含量异常升高。这一结果与报道[14]的糖尿病大鼠海马组织乳酸含量异常升高相类似,提示糖尿病大鼠脑内会出现广泛的乳酸代谢异常。脑内乳酸由葡萄糖通过无氧酵解的方式生成,其含量的升高通常被认为与线粒体功能受损和丙酮酸氧化能力下降有关。此外,三羧酸循环(tricarboxylicacidcycle,TCA)中间产物富马酸、琥珀酸在大脑皮层、下丘脑和中脑中出现不同程度下降,这说明在这三个脑区中三羧酸循环活性减弱。所以糖尿病大鼠脑组织出现的糖酵解能力及三羧酸循环活性变化是引起能量变化的重要原因。
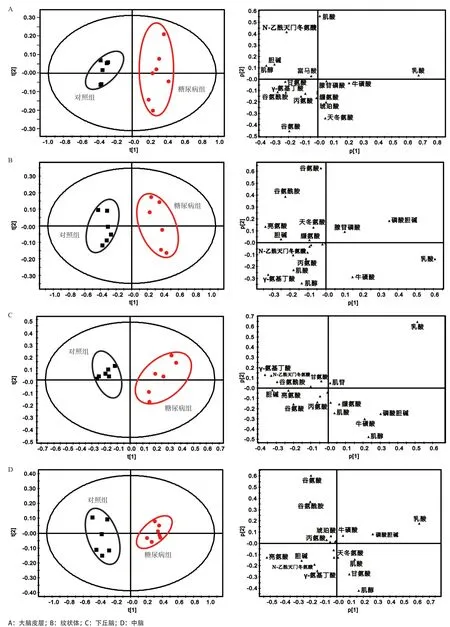
图2 2组大鼠4个脑区代谢模式分析的PCA得分图及其对应载荷图

图3 糖尿病大鼠大脑皮层的代谢通路分析图
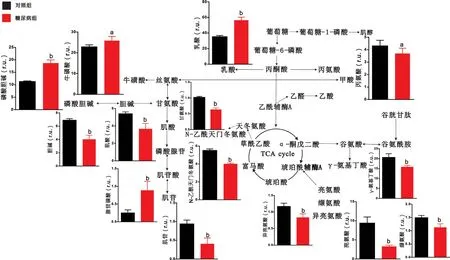
图4 糖尿病大鼠纹状体的代谢通路分析图
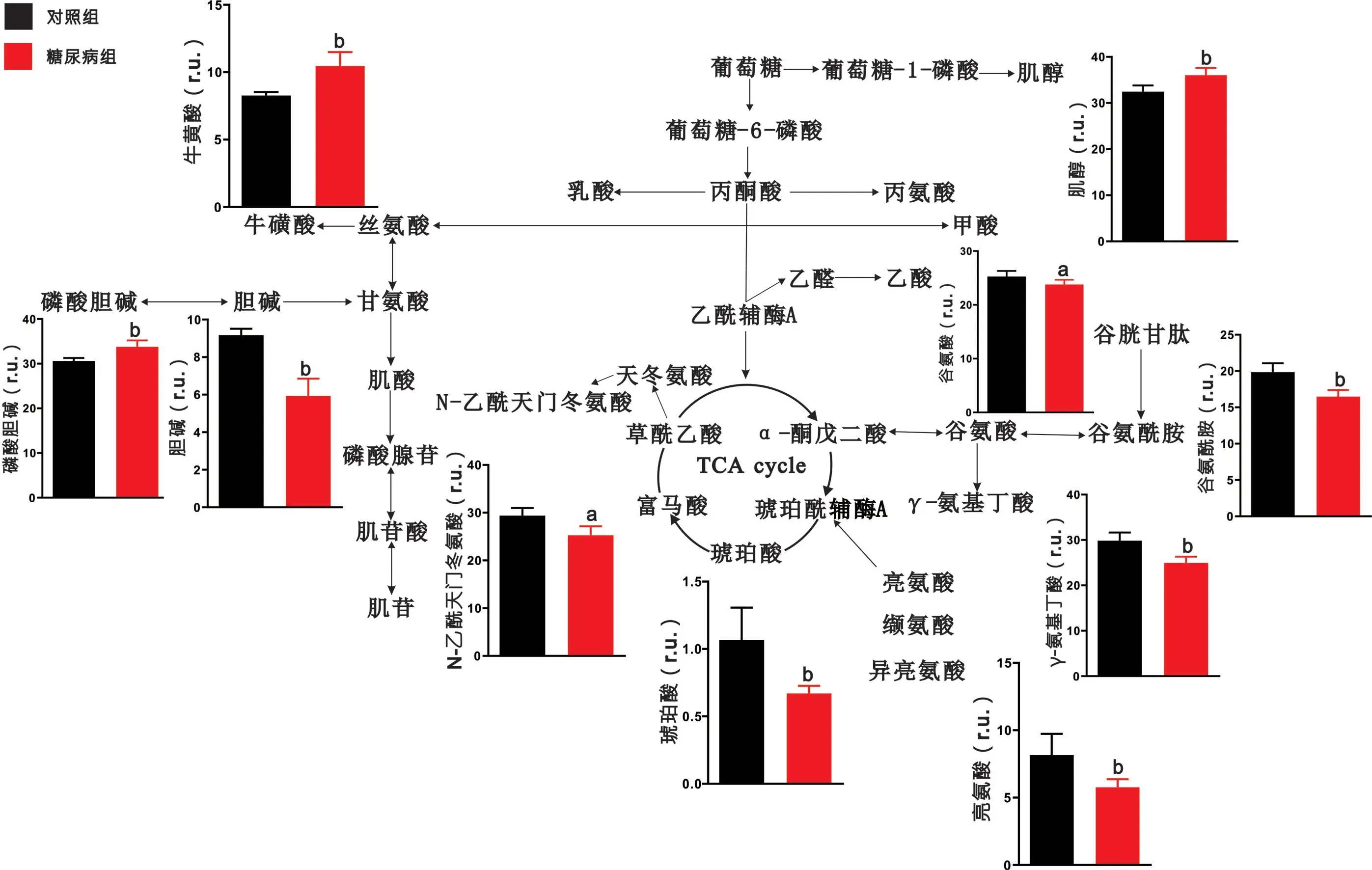
图5 糖尿病大鼠下丘脑代谢通路分析图
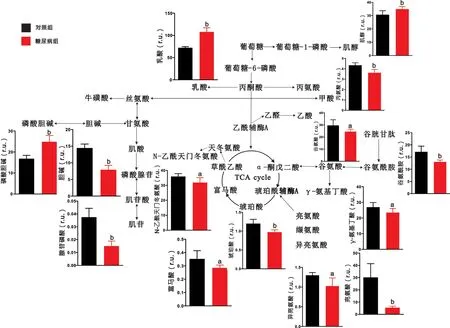
图6 糖尿病大鼠中脑的代谢通路分析图
3.2 糖尿病大鼠脑区特异性神经递质代谢紊乱 谷氨酸-谷氨酰胺(Glu-Gln-GABA)循环维持着神经元和胶质细胞之间的神经递质平衡[15]。星形胶质细胞摄取谷氨酸后,将其转化为谷氨酰胺,随后将合成的谷氨酰胺转运至神经元,作为氨基酸类神经递质谷氨酸和γ-氨基丁酸的主要前体物质,继续参与神经冲动传递或其他代谢途径[16]。本研究发现,与对照组相比,在糖尿病大鼠的大脑皮层中的谷氨酰胺和γ-氨基丁酸的含量出现降低,而在下丘脑、中脑两个脑区中,谷氨酸、谷氨酰胺和γ-氨基丁酸的含量均出现显著降低,说明神经元和胶质细胞之间的神经递质循环被严重抑制。在2型糖尿病db/db小鼠的全脑代谢分析中同样出现了类似变化,这提示神经递质代谢紊乱无论是在1型还是2型糖尿病脑病中都至关重要[17]。此外纹状体中γ-氨基丁酸的含量也出现了显著降低。抑制性神经递质γ-氨基丁酸作为脑内最重要的神经递质之一,其含量降低也会严重影响正常脑功能。天冬氨酸作为兴奋性氨基酸类神经递质能够参与到TCA循环的补给途径中,我们发现大脑皮层中γ-氨基丁酸含量降低的同时天冬氨酸的含量却显著升高,这一结果进一步说明了神经递质代谢出现紊乱。
3.3 糖尿病大鼠脑区特异性神经胶质细胞标志物变化 牛磺酸和肌醇都是神经胶质细胞的特征性代谢物[18-19],普遍认为牛磺酸可反映星形胶质细胞的活性。我们发现糖尿病大鼠的大脑皮层、纹状体和下丘脑中的牛磺酸含量都出现了显著提高,提示这三个脑区的胶质细胞出现增生,而胶质细胞的增生已被发现于糖尿病大鼠脑中[20]。此外有研究发现糖尿病大鼠海马胶质细胞增生与海马神经元的凋亡有着紧密联系[21],因此我们推测上述三个脑区的神经元也出现了不同程度的损伤。同时牛磺酸也具有抗氧化作用,这提示糖尿病大鼠脑内可能出现了氧化应激损伤。肌醇是调节胶质细胞渗透压平衡和内环境稳定的重要代谢物。本研究发现,与对照组相比,糖尿病大鼠大脑皮层中肌醇含量出现下降,这提示神经胶质细胞功能异常,胶质细胞渗透压调节能力失效;而下丘脑和中脑却出现完全相反的结果,胶质细胞的渗透压调节显著增强。
3.4 糖尿病大鼠脑区特异性胆碱代谢异常 胆碱和磷酸胆碱是生物膜的重要组成成分,胆碱和磷酸胆碱含量的变化与细胞膜损伤有关[22]。本研究发现,与对照组相比,在糖尿病大鼠大脑皮层中,磷酸胆碱的含量出现显著的下降而胆碱含量无明显变化。这一结果提示大脑皮层细胞膜的损伤较为严重,细胞的更替能力下降。
3.5 糖尿病大鼠脑区特异性神经元标志物变化 N-乙酰天门冬氨酸作为神经元活性的特征性代谢物,一般认为其含量的降低可反映神经元的损伤[23]。本研究结果发现,与对照组相比,N-乙酰天门冬氨酸在糖尿病大鼠的纹状体、下丘脑和中脑中都出现显著下降,说明糖尿病对大鼠脑神经元造成较大损伤。因此,高血糖所诱导的神经元损伤是广泛涉及多个脑区的,而并不只存在于海马区域[24]。
综上所述,本研究应用基于1HNMR的代谢组学方法分析了1型糖尿病大鼠大脑皮层、纹状体、下丘脑和中脑四个脑区的代谢水平变化,发现糖尿病大鼠出现脑区特异性代谢紊乱,主要包括能量代谢、神经递质代谢和胆碱代谢。

