短尾蝮蛇毒金属蛋白酶和磷脂酶A2的分离纯化及磷酸化修饰检测
罗亚军,林楚霞,文 琳,汪 妍,徐 宁,高建芳
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
翻译后修饰(如糖基化、磷酸化、乙酰化)是驱动蛇毒组分及功能多样化的重要因素[1-3].迄今为止,有关蛇毒蛋白翻译后修饰的研究,主要局限于利用特异性显色剂对修饰类型的表象检测上,也有部分研究对少量的修饰蛋白进行了质谱鉴定[4-11].此外,还有一例研究报道了美洲矛头蝮(Bothropsjararaca)蛇毒全蛋白组水平的糖基化修饰强度,并预测了修饰位点[3].少量研究工作报道了翻译后修饰对蛇毒功能的影响,如从美洲矛头蝮中分离出的一种具有纤维蛋白原水解活性的丝氨酸蛋白酶(BPA)中,N端糖苷占到总分子质量的62%;当局部去除糖基化修饰,发现其纤维蛋白原水解活性大为增强,且丝氨酸蛋白酶抑制剂也无法再抑制其活性,显然这种特性受到了聚糖结构的影响[10].对美洲矛头蝮和铜头蝮(Agkistrodoncontortrixlaticinctus)蛇毒出血金属蛋白酶Jararhagin和ACLH去翻译后修饰处理或直接原核表达的研究发现,这两类物质与其天然形式相比,出血活性消失,仅保留纤维蛋白原和纤连蛋白水解活性,这种去修饰后组分在临床抗凝药物开发上显然具有潜在的价值[11].但由于缺少足够的关于蛇毒组分翻译后修饰的表征,限制了翻译后修饰对蛇毒组分功能影响的研究.
本研究以短尾蝮(Gloydiusbrevicaudus)蛇毒为对象,利用阴离子层析、凝胶排阻色谱和反相高效液相色谱从中分离纯化金属蛋白酶和磷脂酶A2,利用三位点磷酸化修饰抗体检测两种组分的磷酸化修饰信号,结合LC-MS质谱鉴定并预测磷酸化修饰位点.通过位点修饰抗体在短尾蝮蛇毒蛋白磷酸化修饰信号检测中的实践,为蛇毒全蛋白组水平的磷酸化修饰研究提供参考,并为特定氨基酸位点的磷酸基团在蛇毒组分功能多样性变化中的作用研究奠定基础.
1 材料与方法
1.1 蛇毒采集
实验用短尾蝮成体采自浙江萧山,用咬膜皿法采集蛇毒,新鲜毒液经10 000 r/min 4 ℃离心15 min后吸取上清,随后用Labconco 4.5 L冷冻干燥机(Labconco)制备成蛇毒冻干粉,并保存于-80 ℃备用.
1.2 蛇毒金属蛋白酶和磷脂酶A2分离纯化
称取0.3 g蛇毒冻干粉,用20 mmol/L Tris-HCl pH8.0缓冲液溶解,并用0.22 μm针头滤器过滤.随后将过滤液上样至DEAE Sepharose FF柱(16/10)进行阴离子层析分离,设置流速2 mL/min,用AKTA-FPLC低压液相层析系统按以下步骤进行洗脱:20 mmol/L Tris-HCl pH8.0洗脱5个柱体积,0~0.5 mol/L NaCl(含20 mmol/L Tris-HCl pH8.0)线性梯度洗脱30个柱体积,0.5 mol/L NaCl(含20 mmol/L Tris-HCl pH8.0)洗脱5个柱体积,收集各组分峰.取50 mg含目的组分的DEAE Sepharose FF柱分离峰溶于50 mmol/L PBS(含0.15 mol/L NaCl pH7.0),随后上样至Sepharcy S-200 HR柱(Hi Prep 16/60)进行凝胶排阻色谱分离,设置流速0.2 mL/min,用50 mmol/L PBS(含0.15 mol/L NaCl pH7.0)缓冲液洗脱2个柱体积,收集各组分峰.各组分峰经超滤管(3 kDa,Millipore)除盐浓缩后冷冻干燥,-20 ℃保存备用.
取1 mg含金属蛋白酶的凝胶排阻分离峰样品,溶于含0.1%三氟乙酸(TFA)的超纯水,10 000 r/min 4 ℃离心15 min,取上清.将上清上样至Kromasil 300 C18柱(250 mm× 4.6 mm, 5 μm),设置流速1 mL/min,用Waters E600高效液相系统进行分离.流动相分别为0.1% TFA和乙腈,设置线性梯度洗脱条件为:含10%乙腈的TFA洗脱10 min,含25%乙腈的TFA洗脱10 min,含45%乙腈的 TFA洗脱45 min,60%乙腈50 min.磷脂酶A2的线性梯度洗脱条件设置为:含10%乙腈的TFA洗脱10 min,含25%乙腈的TFA洗脱10 min,含35%乙腈的 TFA洗脱50 min.所有组分峰收集后冷冻干燥,-20 ℃保存备用.
测定各组分峰蛋白浓度时,将其用超纯水溶解后以Bradford法测定稀释液浓度[12],每个样品重复测定3次,以牛血清白蛋白作为标准品.利用各阶段收集峰的蛋白含量与上样蛋白含量的比值作为组分峰的相对含量,以各收集峰总的蛋白含量与上样蛋白含量的比值计算单次分离的得率.
1.3 蛋白酶水解活性和磷脂酶A2活性检测
用含2%牛乳酪蛋白的0.2 mol/L Tris-HCl为底物检测蛇毒金属蛋白酶水解活性[13],将阴离子层析或凝胶排阻色谱所得的不同蛇毒组分峰蛋白(40 μg)加入0.5 mL底物液,于37 ℃水浴反应2 h.加入等体积0.44 mol/L 三氯乙酸溶液终止反应,随后5 000 r/min 4 ℃离心15 min取上清.将上清和0.4 mol/L NaCO3以2∶5混合,后加入1份福林酚再次充分混匀,在660 nm下读取吸光值.蛋白酶水解活性以每分钟每毫克蛇毒蛋白降解底物引起吸光度改变0.01作为一个酶活性单位(U/(min·mg)).
以大豆卵磷脂为底物检测磷脂酶A2活性[13],将阴离子层析或凝胶排阻色谱所得的不同蛇毒组分峰蛋白(0.8 μg)加入200 μL底物体系(0.1 mol/L NaCl,10 mmol/L CaCl2,7 mmol/L Triton X-100,0.35%大豆卵磷脂和98.8 mmol/L酚红,pH7.6),混合均匀后,在室温静置观测1 min,以颜色由浅紫色迅速变为黄色作为蛇毒组分是否具有较强的磷脂酶A2活性的判断标准.
1.4 SDS-PAGE和western blot检测
各收集峰蛇毒蛋白的SDS-PAGE分离及与磷酸化抗体间的western blot检测方法参照Gao等[14].蛇毒蛋白定量上样后用12%分离胶在Bio-Rad Mini Protean III电泳系统分离.电泳结束后,用半干转印仪将胶上蛋白转印至PVDF膜(0.45 μm)上,随后用含5% BSA的TBST缓冲液在4 ℃中封闭过夜.封闭完成后,PVDF膜用TBST缓冲液漂洗3次,随后将膜转移至小鼠抗Ser/Thr/Tyr三位点磷酸化修饰一抗(1∶1 000稀释)中,37 ℃摇床孵育1 h.孵育结束后,PVDF膜用TBST缓冲液漂洗3次,随后将膜放入HRP标记的兔抗鼠二抗(1∶3 000稀释)中,37 ℃摇床再次孵育1 h.用TBST彻底洗去膜上未结合的二抗,并控干PVDF膜上的残留液.最后用ECL发光显色试剂盒对PVDF膜进行连续曝光显色,经曝光的X光片控干后用Umax2100扫描仪扫描,随后用Tan4100软件分析结果.
1.5 质谱鉴定及磷酸化修饰位点预测
从SDS-PAGE胶上切下目的蛋白条带,用超纯水清洗3次后用枪头捣碎.加入20 ng/μL胰蛋白酶液40 μL,37 ℃孵育16 h.将酶解液上样至Zorbax 300SB-C18 peptide traps柱,并经Column RP-C18柱(150 mm ×0.15 mm)进行毛细管高效液相分离.以0.1%甲酸水溶液为流动相A液,以含84%乙腈的0.1%甲酸水溶液为流动相B液,设置线性梯度洗脱条件为:4%~50%B液35 min,50%~100%B液15 min,100%B液5 min.分离产物用Q Exactive质谱仪进行鉴定,选择正离子检测方式,采集45 min数据,每次全扫后采集10个二级质谱图用于分析多肽碎片的质荷比.质谱结果用Peaks X搜索引擎在实验室自有亚洲蝮属(Gloydius)毒蛇毒腺转录组翻译后蛋白库中进行配对检索.一级质谱和二级质谱质量容差分别设置为20 ppm和0.1 Da,允许最大遗漏酶切位点为 1 个,设置 Carbamidomethyl(C)为固定修饰,Acetyl(N-term)、Oxidation(M)和Phosphorylation(S/T/Y)为可变修饰,设定肽段得分阈值为15.
2 结果与分析
短尾蝮蛇毒金属蛋白酶和磷脂酶A2的分离及活性检测结果见图1、图2.
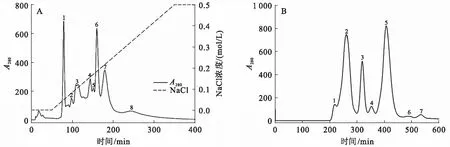
A:DEAE-Sepharose阴离子层析;B:Sepharcy-200凝胶排阻色谱;C:C18柱反相高效液相色谱分离蛇毒金属蛋白酶;
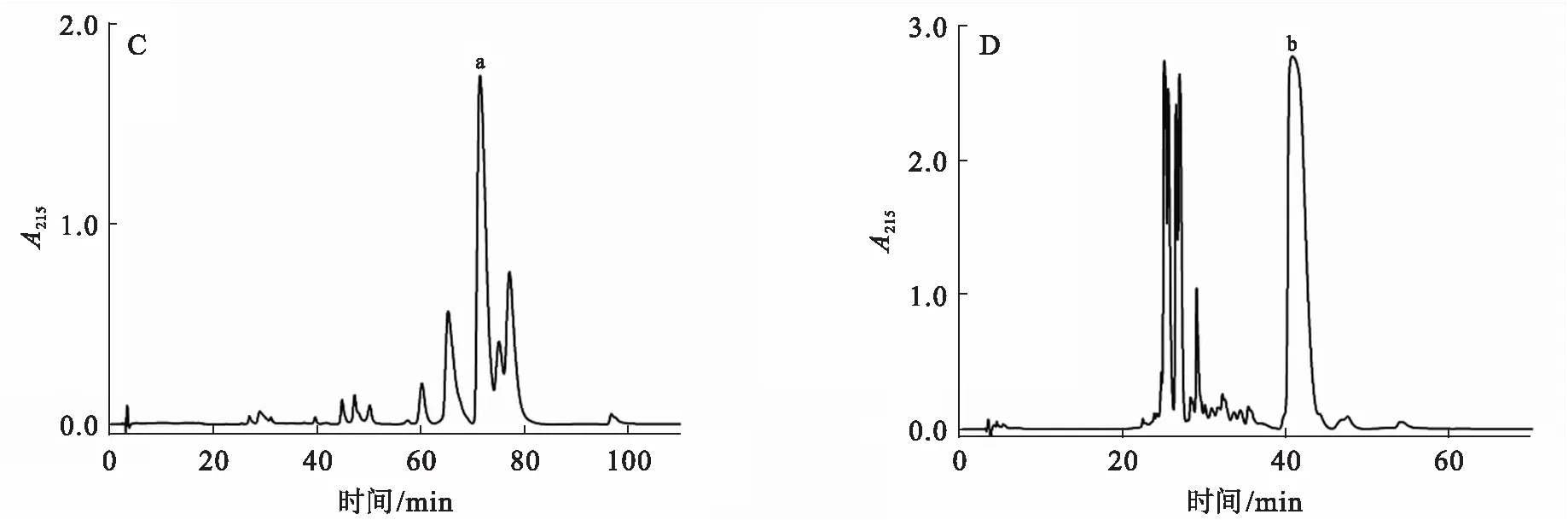
A:DEAE-Sepharose阴离子层析;B:Sepharcy-200凝胶排阻色谱.
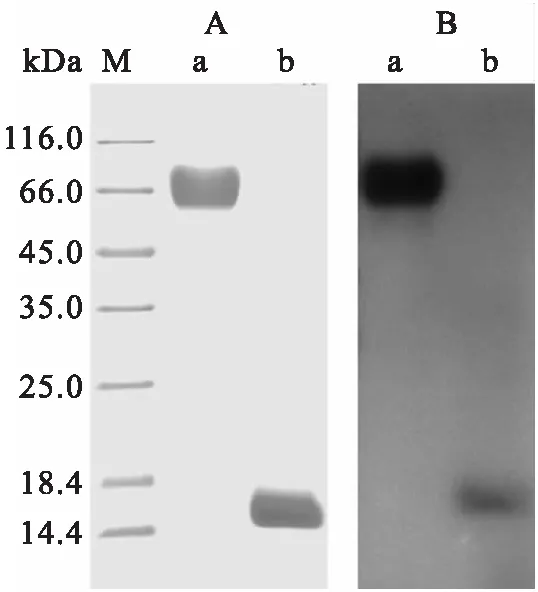
A:蛇毒蛋白SDS-PAGE电泳;B:磷酸化修饰抗体;
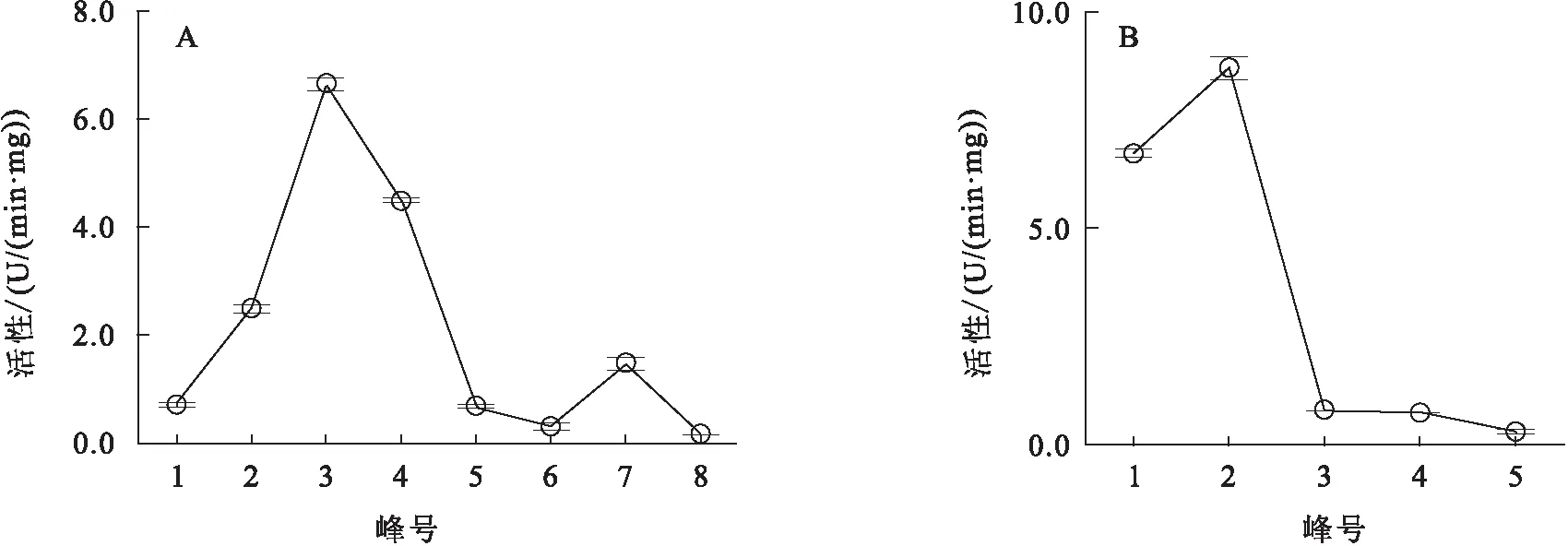
短尾蝮粗毒经DEAE-Sepharose阴离子层析共分离获得8个组分峰,2、3、4和7号峰蛇毒蛋白能明显水解酪蛋白,且3号峰的水解能力最强(图1A、图2A),达到6.6 U/mg,预示该组分峰具有较高的蛇毒金属蛋白酶含量.3号峰组分在1 min内能将含酚红的大豆卵磷脂底物液由浅紫色迅速变为黄色,表明该组分峰还具有较强的磷脂酶A2活性.3号峰经Sepharcy-200凝胶排阻色谱进一步分离,共收集7个组分峰,6、7两个峰回收后得率较低,未用于后续活性分析,其余5个组分峰中只有1、2两个峰能有效降解酪蛋白,且2号峰水解能力相对较高,达到8.7 U/mg(图1B、图2B),表明该峰可能具有较高的蛇毒金属蛋白酶含量.凝胶排阻色谱所得7个峰中,仅5号峰组分在1 min内能将含酚红的大豆卵磷脂底物液由浅紫色迅速变为黄色,表明该组分峰还具有较强的磷脂酶A2活性.反相高效液相分离结果显示,2、5两个峰仍具有多个复杂的组分峰(图1C、D),其中两个主要的组分峰a和b经SDS-PAGE电泳检测为单一条带,分子质量分别为66和16 kDa(图3A).
Bradford法测定粗毒蛋白及各组分峰含量显示,分离用短尾蝮粗毒含蛋白55%,单次阴离子层析所得8个峰的最终得率为粗毒蛋白的82.3%,3号峰含蛋白10.3%.凝胶排阻色谱所得的2号峰和5号峰,分别占上样蛋白的30.0%和11.9%;反相高效液相分离所得的a和b两个峰,分别占上样蛋白的44.3%和47.3%,这两个峰分别占粗毒总蛋白的1.4%和0.6%.
蛋白免疫印迹检测显示,最终分离所得a和b两个峰的蛇毒蛋白能被三位点(丝氨酸、苏氨酸、酪氨酸)磷酸化修饰抗体有效识别,呈现出明显的磷酸化修饰信号,且a峰所含蛋白条带的信号更为强烈(图3B).质谱检测结果显示,a峰所含组分为蛇毒金属蛋白酶,共匹配到12条特征性肽段,且肽段集中在活性结构域;并从4条肽段中预测到4个氨基酸磷酸化修饰位点,分别为1个丝氨酸和3个苏氨酸(表1).b峰所含组分为磷脂酶A2,共匹配到22条特征性肽段,该组分属于D49型磷脂酶A2;仅从1条肽段中预测到1个酪氨酸磷酸化修饰位点(表1).

表1 短尾蝮蛇毒金属蛋白酶和磷脂酶A2磷酸化修饰鉴定Tab.1 Identification of phosphorylation modification in metalloproteinase and PLA2 from venom of G. brevicaudus
3 讨论
一般认为,磷酸化和糖基化修饰对维持蛇毒蛋白的结构稳定性、生物活性和免疫原性具有重要作用,对于阻断猎物体内含有的生理抑制剂以便毒蛇捕食、消化猎物同样具有不可忽视的作用[3].此外,这些修饰对于蛇毒中具有药用活性的组分参与细胞增殖分化及凋亡、骨架调控、肌肉收缩和神经递质合成与释放、肿瘤的发生与浸润扩散也具有重要的影响.理论上,这些修饰可以通过cDNA序列进行预测,但对于特定修饰类型的强度和复杂性(如修饰位点、功能和结构域等),仅依靠对概念性翻译的预测是无法获得相对准确的信息的,且还容易因cDNA序列预测所得的修饰位点数量过多,干扰后续基于位点修饰前后蛇毒蛋白功能变化的研究.利用特异性荧光染料(如Pro-Q Diamond)可实现对磷酸化修饰蛇毒蛋白的识别[2],但染料无法实现对修饰蛋白肽段的捕获,因此无法用于高通量筛选鉴定蛇毒蛋白的磷酸化修饰全组.近年来发展的以抗磷酸化修饰抗体亲和捕获待检样品中的磷酸化修饰肽段及高精度检测技术,能在样品鉴定前进行富集处理,便利了样品蛋白质修饰组学研究,已在大肠杆菌组氨酸磷酸化修饰研究中取得了良好的效果[15].
本研究利用三步法分离纯化短尾蝮蛇毒金属蛋白酶和磷脂酶A2,结合蛇毒活性检测和质谱鉴定验证两种组分.考虑到阴离子层析和凝胶排阻色谱分离阶段各组分峰仍可能存在多个蛋白条带,故以酪蛋白和大豆卵磷脂水解活性用于初步判断,并选择活性最高组分峰用于后续分离.当然,两种底物水解活性并非是蛇毒金属蛋白酶和磷脂酶A2的唯一判定标准.质谱解析所得组分峰a的肽段主要对应于自建库短尾蝮蛇毒金属蛋白酶的水解活性结构域,但该组分表观分子质量为68 kDa,符合III型蛇毒金属蛋白酶的分子质量特点,理论上应能鉴定到除活性结构域之外的去整合素和半胱氨酸富集区,有可能是该区域在质谱检测中未能捕获到对应的母离子.蛇毒磷脂酶A2匹配到的特征性肽段相对较多,因其特征性肽段“CCFVHDCC”中含有天冬氨酸,故属于D49型磷脂酶A2.
Western blot检测结果发现两种分离组分的显色强度存在较大差异,除了因分子质量不同所致的转膜效率差异外,还可能是由于金属蛋白酶具有较多的磷酸化修饰位点导致其能结合更多的磷酸化修饰抗体.以往有关亚洲蝮属蛇岛蝮(Gloydiusshedaoensis)蛇毒的研究利用质谱鉴定了5条可被Pro-Q Diamond染色的蛋白,但仅能预测到1个磷酸化修饰位点[8],位点预测的有效性不高.利用三位点磷酸化修饰抗体可有效检测短尾蝮蛇毒分离组分受到的修饰强度,加之选择了亚洲蝮属毒腺转录组作为自建库用于质谱峰图解析,保证了位点预测的有效性.当前检测也表明,三位点磷酸化修饰抗体完全可用于亲和捕获短尾蝮蛇毒磷酸化修饰组分,进行修饰组学鉴定.
本研究的结果证实了三位点磷酸化修饰抗体能有效识别短尾蝮蛇毒金属蛋白酶和磷脂酶A2,并成功预测了氨基酸修饰位点,为磷酸化修饰抗体用于高通量鉴定蛇毒蛋白磷酸化修饰全组提供了可行性参考,也为研究磷酸化修饰在蛇毒蛋白功能多样性变化中的作用奠定了基础.

