基于网络药理学探讨山海丹颗粒治疗勃起功能障碍的潜在作用机制
钱 程,成 鹏,郑维维,余苏云,吴佳伟,郑孟凯,陈文星,陆 茵,2,王爱云,2
(南京中医药大学 1.药学院、江苏省中药药效与安全性评价重点实验室,2.中药品质与效能国家重点实验室(培育),江苏 南京 210023; 3.杭州施强药业有限公司,浙江 杭州 310000)
中药复方山海丹颗粒主要功效为活血化瘀、宣痹通络、益气养血,其组成有丹参、决明子、葛根、山羊血、麦冬、灵芝、人参、佛手、黄芪、红花、香附、蒲黄、海藻、何首乌、川芎、三七16味中药。4味活血化瘀药丹参、红花、三七、山羊血相须配伍,入心散血中之滞,入肝理血之壅。4味补气药人参、黄芪、何首乌、灵芝同用,益气养血,补气以促血行。川芎活血行气、香附行气解郁、佛手疏肝理气,这3味药可加强行气活血作用。蒲黄化瘀、海藻散结,麦冬清心、葛根生津、决明子清热,可以辅助活血发挥益气养血功效,并滋阴复脉。山海丹颗粒主要发挥活血功效,并辅以补气,临床用以治疗胸痹、心梗等疾病。中医认为勃起功能障碍(erectile dysfunction,ED)是经由脏腑、经络、气血津液相互协调作用的结果。有学者认为勃起功能障碍因于肝者居多,应从肝治[1]。肝藏血,主疏泄,主宗筋,肝血在肝气疏导下对阴茎的快速充盈是阴茎勃起的物质基础[2]。而山海丹颗粒可以调达肝气,散肝血之壅,具有中医理论上治疗ED的潜在可能。现代医学认为,ED本质是一系列神经血管活动,阴茎勃起需要副交感神经兴奋,动脉扩张,动脉血流增加,海绵体充血膨胀[3]。动脉粥样硬化、高脂血症等血管性疾病常会引起ED发生,对血管具有调节作用的山海丹颗粒存在治疗ED的作用基础。
网络药理学是新兴药理研究方法,综合计算生物学、系统生物学和网络分析等多学科技术,旨在探究药物与疾病的关联性,具有系统性及整体性的特点[4]。单靶点机制通路的研究方法难以解释中药多成分、多靶点的协同作用,中药配伍运用注重整体协调性,而这与网络药理学特点十分契合。目前,许多关于网络药理学的研究成功应用于中药的机制探究,揭开了中药发挥药效的途径,阐释了中药的科学内涵[5]。
据此,本研究基于网络药理学探讨山海丹颗粒治疗ED的潜在作用机制,为山海丹颗粒扩大适应症提供依据和新思路。
1 材料与方法
1.1 山海丹颗粒成分库的构建及活性成分筛选山海丹颗粒包含丹参、决明子、葛根、山羊血、麦冬、灵芝、人参、佛手、黄芪、红花、香附、蒲黄、海藻、何首乌、川芎、三七16味中药,通过查询上海有机所中药天然产物数据库、 中药系统药理学数据库和分析平台(traditional chinese medicine systems pharmacology,TCMSP)、中药信息库(traditional chinese medicine information database,TCMID),查找复方中已被鉴定的中药化学成分,将这些成分搜集并整合,构建中药复方成分数据库。口服中药要发挥药效,必须克服机体药代动力学屏障,经过吸收、分布、代谢、排泄等过程。一些成分由于半衰期短、脂溶性差、细胞渗透性差等原因,最终无法成为发挥药效的活性成分。中药复方组成复杂、成分众多,很多药效发挥依赖于微量成分协同作用,而传统检测手段很难将发挥作用的成分完全检测出来。利用TCMSP数据库ADME预测功能筛选复方成分中的活性成分口服生物利用度(oral bioavailability,OB)、类药性(drug-like,DL)是中药成分在ADME中的关键参数,可以作为筛选中药发挥药效活性成分的条件。在TCMSP数据库中,设定筛选参数:OB≥30%,DL≥0.18。
1.2 山海丹颗粒潜在靶标预测及成分靶点网络图的构建通过整合分子靶标预测模型数据库:Similarity Ensemble Approach (SEA),STITCH和Benchmark Database通过模拟及比对计算,预测山海丹颗粒活性成分对应的所有分子靶标集。在总集中,运用化学基因组学整合手段,基于支持向量机和随机森林算法计算出总靶点集中所有靶点与成分相互作用的强度。最终选取总集中支持向量机和随机森林数值分别大于0.8和0.7的靶点作为潜在药效靶标子集。通过Uniprot数据库,对潜在药效靶标进行分析和注释,查找靶蛋白的基因名、Uniprot ID,保留人源靶点,并删除重复项。使用Cytpscape3.2.1软件绘制山海丹颗粒所含主要中药-靶点图。
1.3 勃起功能障碍疾病靶点库的构建通过Therapeutic Target Database(TTD)数据库、PharmGkb数据库输入疾病名称“Erectile dysfunction”,得到疾病ED相关靶点名称。利用Disease Gene Search Engine with Evidence Sentences(DiGSeE)数据库,输入疾病名称“Erectile dysfunction”,选择“Gene expression”,文本挖掘ED相关靶点名称。将得到的靶点整合,基因名转化并保留人源靶点,删除重复项。
1.4 PPI网络拓扑分析和核心靶点筛选利用Cytpscape 3.2.1软件将山海丹颗粒潜在靶点和ED相关靶点进行PPI网络拓扑分析,分别得到两个拓扑网络。利用Cytpscape 3.2.1软件的插件CytoNCA将两个拓扑网络进行Merge,生成两个拓扑网络的交集网络,得出中药山海丹颗粒可作用于ED的靶点,以及Degree值等数据。通过交集网络的拓扑数据分析出Degree值为33,定义大于2倍Degree值为Big Hubs,依据较高Degree值筛选得到核心网络靶点。将关键靶点导入DisGeNET数据库,获取基因对应蛋白及蛋白分类。
1.5 核心靶点的功能注释分析DAVID数据库支持基因和靶蛋白列表分析的网络数据库。使用DAVID数据库对PPI核心靶点进行GO注释和KEGG富集分析,寻找出山海丹颗粒中有效成分可能参与调控的基因网络中的潜在靶点、信号通路及相关生物学过程、细胞组分和分子功能。用OmicShare工具对KEGG富集通路绘制气泡图。使用Cytocape 3.2.1软件中的ClueGO插件进行富集分析,构建靶蛋白参与的信号通路可视化结果。
1.6 蛋白相互作用网络构建与分析GeneMANIA数据库包含大量蛋白相互作用关系,将山海丹颗粒治疗ED的核心靶点导入该数据库,选择Homo sapiens,进行蛋白相互作用分析。
2 结果
2.1 山海丹颗粒成分库的构建及活性成分筛选通过上海有机所中药天然产物数据库、TCMSP数据库和TCMID数据库查找中药成分,复方中已被鉴定的中药化学成分为丹参、三七、红花、人参、黄芪、何首乌、灵芝、决明子、葛根、佛手、香附、蒲黄、海藻、川芎、麦冬。最终构建的中药复方成分库包含1 571个成分,其中丹参202个成分,三七119个成分,红花189个成分,人参190个成分,黄芪87个成分,何首乌19个成分,灵芝242个成分,决明子68个成分,葛根18个成分,佛手81个成分,香附104个成分,蒲黄33个成分,海藻20个成分,川芎189个成分,麦冬10个成分。基于TCMSP数据库OB、DL筛选指标共选出了268个潜在活性成分,删除重复项为226个活性成分。其中丹参64个成分,三七8个成分,红花22个成分,人参22个成分,黄芪20个成分,何首乌11个成分,灵芝61个成分,决明子14个成分,葛根4个成分,佛手5个成分,香附18个成分,蒲黄8个成分,海藻4个成分,川芎7个成分,麦冬0个成分。
2.2 山海丹颗粒潜在靶标预测及成分靶点网络图的构建通过SEA、STITCH、Benchmark Database和Uniprot数据库预测,得到中药活性成分的潜在作用靶点。删除重复项,共有186个潜在作用靶点,其中丹参活性成分潜在作用靶点76个,三七活性成分潜在作用靶点117个,红花活性成分潜在作用靶点121个,人参活性成分潜在作用靶点94个,黄芪活性成分潜在作用靶点140个,何首乌活性成分潜在作用靶点52个,灵芝活性成分潜在作用靶点53个,决明子活性成分潜在作用靶点59个,葛根活性成分潜在作用靶点60个,佛手活性成分潜在作用靶点12个,香附活性成分潜在作用靶点128个,蒲黄活性成分潜在作用靶点130个,海藻活性成分潜在作用靶点85个,川芎活性成分潜在作用靶点32个。利用Cytpscape 3.2.1软件绘制山海丹颗粒中药-靶点作用图(Fig 1)。

Fig 1 Major Chinese medicine -target networkof Shanhaidan granules
2.3 勃起功能障碍疾病靶点库的构建通过TTD、PharmGkb和DiGSeE数据库得到ED相关基因,得到82个疾病作用靶点。利用Cytpscape 3.2.1软件绘ED-靶点作用图(Fig 2)。
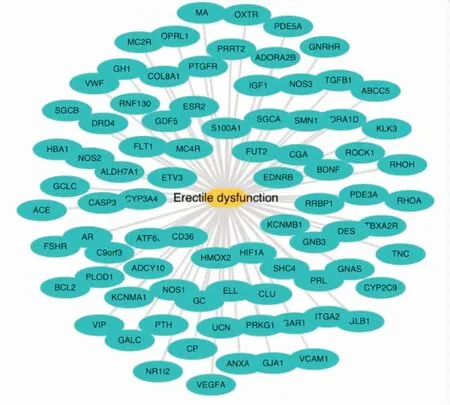
Fig 2 ED-target network
2.4 PPI网络拓扑分析和核心靶点筛选通过PPI网络拓扑分析,得到山海丹颗粒潜在靶点拓扑网络,包含6 679个节点,148 186条边;ED相关靶点拓扑网络,包含2 550个节点,58 997条边。使用CytoNCA分析后的交集网络包含2 032个节点,52 284条边(Fig 3)。取Degree值大于33的基因作为核心靶点,得到丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、一氧化氮合酶2(nitric oxiden synthase 2,NOS2)、磷脂酰肌醇-3-激酶调节亚基2(phosphoinositide-3-kinase regulatory subunit 2,PIK3R2)等基因,查到基因对应蛋白并进行蛋白分类(Tab 1)。这些蛋白与ED疾病的发生发展密切相关,说明山海丹颗粒可能通过这些蛋白发挥对ED的潜在治疗作用。
Fig 3 Core target intersection PPI network
2.5 核心靶点的功能注释分析山海丹颗粒GO分析显示,山海丹颗粒预测的核心靶点在生物学过程中排名靠前的有缺血反应、调控血管生成、调控凋亡过程、细胞增殖以及衰老等,表明山海丹颗粒可能通过调控这些生物学进程从而影响疾病。细胞组分方面包括细胞-细胞粘附连接、细胞核核小体、肌动蛋白细胞骨架、膜筏、血液微粒等。分子功能主要涉及核苷酸结合、蛋白复合物结合、激酶活性、蛋白异二聚化活性、钙粘蛋白结合参与细胞-细胞粘附等方面(Fig 4 )。
使用 DAVID 进行山海丹颗粒靶点KEGG通路分析,选取P 值相对较小且靶点富集的20条通路,主要有环磷酸鸟苷/蛋白激酶G(cyclic guanosine monophosphate-protein kinases G, cGMP/PKG)信号通路、丝裂原活化蛋白激酶(mitogen-activated pro-tein kinase, MAPK)信号通路、凋亡途径、磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide-3-kinase/protein kinase B, PI3K/Akt)信号通路(Fig 5 )。

Tab 1 Major potential targets of core network

Fig 4 Biological function analysis of Shanhaidangranules in treating ED targets
使用Cytocape3.2.1软件中的ClueGO插件进行富集分析,构建靶蛋白参与的信号通路可视化结果,发现山海丹颗粒发挥药效主要与cGMP/PKG信号通路、PI3K/Akt信号通路和MAPK信号通路等相关(Fig 6)。
此分析结果也可与KEGG分析结果相互佐证,说明山海丹颗粒治疗ED的潜在作用机制与cGMP/PKG信号通路、MAPK信号通路、PI3K/Akt信号通路和凋亡途径有关,为山海丹颗粒治疗ED的实验研究提供相关通路检测的依据。
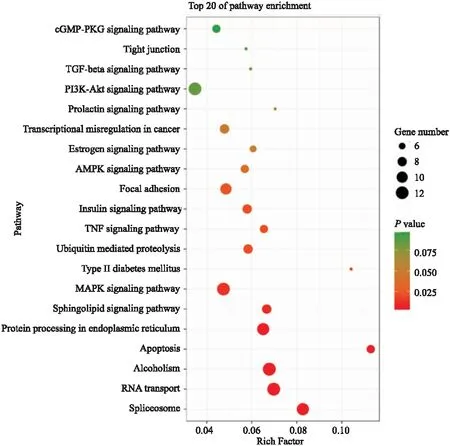
Fig 5 KEGG pathway in treatment of EDtarget by Shanhaidan granules
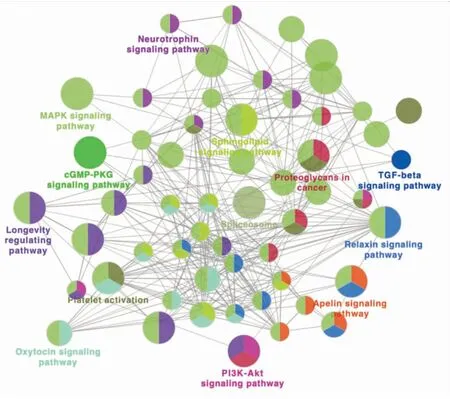
Fig 6 Signal pathway enrichment anlysis of Shanhaidangranules in treatment of ED core targets
2.6 蛋白相互作用网络构建与分析通过GeneMANIA构建蛋白相互作用网络并预测主要功能,发现有意义的功能主要包括:① 调节细胞凋亡信号通路;②正向调节MAPK级联信号;③调节cGMP生物合成过程;④丝氨酸/苏氨酸激酶活性;⑤ NO代谢过程。提示山海丹颗粒可能通过关键蛋白参与的相关信号通路发挥对ED的潜在治疗作用(Fig 7)。
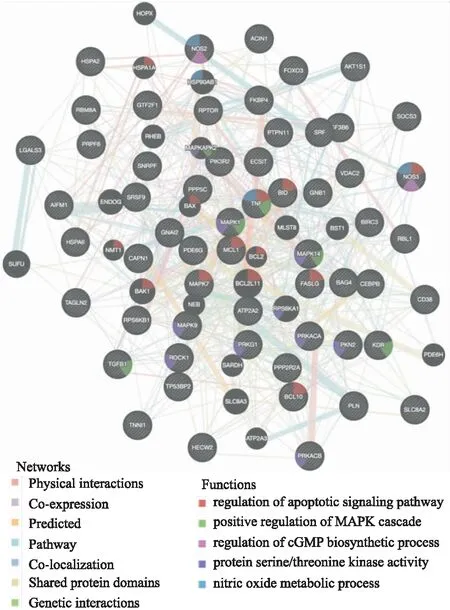
Fig 7 Key protein interaction network of Shanhaidangranules in treating ED and functional notes
3 讨论
本研究基于网络药理学大数据信息分析的方法,深入探讨了山海丹颗粒治疗勃起功能障碍的潜在作用机制。通过数据库找出山海丹颗粒的主要活性成分及治疗ED的潜在作用靶点,如MAPK、NOS、肿瘤坏死因子(tumor necrosis factor,TNF)、叉头形蛋白O(forkhead box protein O,FOXO)等。通过多个数据库查找山海丹颗粒治疗ED的通路并相互佐证,总结出4条潜在治疗的机制通路,即为:cGMP/PKG信号通路、MAPK信号通路、PI3K/Akt信号通路、凋亡途径。
山海丹颗粒治疗ED的核心靶点185个,主要有TNF、FOXO、NOS、MAPK等。TNF-α对血管具有直接作用,在ED患者中高水平表达,可激活MAPK、PI3K/Akt等信号通路,这也可能是TNF-α对ED的调节机制[6]。FOXO在衰老过程中发挥对神经的保护作用,衰老是ED发生的重要因素,会引起nNOS表达下降以及内皮细胞过度凋亡,引发ED[7]。NO由eNOS、iNOS、nNOS三种不同类型一氧化氮合酶产生, NO诱导cGMP活化与积累,影响平滑肌松弛和阴茎勃起。血管和海绵体窦腔内皮细胞中的eNOS是NO的重要来源,内皮细胞过度凋亡会减少NO的合成和释放,从而影响阴茎勃起。
cGMP/PKG途径可以调节NO的血管舒张作用,副交感神经兴奋会刺激神经元释放NO,NO则激活鸟苷酸环化酶促进cGMP合成,阴茎组织中的cGMP介导阴茎勃起,cGMP被磷酸二酯酶过度降解则会导致勃起障碍[8]。cGMP通路也是目前关于ED研究较多的机制通路。
cGMP除了受NO影响,也受到MAPK通路的调节,从而导致ED的发生。MAPK信号通路在细胞分化、增殖及凋亡过程中发挥重要作用,这与ED的发生发展密切相关。RhoA/Rock通路的激活会导致阴茎松弛,并且是MAPK通路上游的调节因子[9]。MAPK信号通路中主要包括细胞外信号调节蛋白激酶(extracellular regulated protein kinases,ERK)和p38MAPK。ED患者ERK活化水平显著高于非ED患者,ERK能够调控eNOS,抑制ERK信号通路可以降低精氨酸酶活性,改善海绵体的舒张功能[10]。p38可增强精氨酸酶活性,引起内皮细胞功能异常。p38与血管炎症、内皮细胞凋亡、内皮细胞功能障碍有关,p38MAPK通路的激活是提高精氨酸酶活性在内皮细胞中表达的关键[11]。
内皮细胞过度凋亡会引起NOS活性降低导致NO合成受阻,从而抑制阴茎勃起。衰老、糖尿病、高脂血症等疾病都会导致内皮细胞凋亡,eNOS水平降低,抑制了Bcl-2与Bax的比值[7]。5型磷酸二酯酶抑制剂(phosphodiesterase type 5 inhibitors,PDE5-I)作为治疗ED一线药物,其机制就是抑制PDE5,减少cGMP的降解,导致平滑肌松弛,抑制超氧化物生成,减少细胞凋亡从而提高NO含量。阴茎海绵体平滑肌细胞过度凋亡会使平滑肌数量降低,导致静脉性ED发生。有研究对非动脉性重度ED患者的组织学进行检测,发现阴茎海绵体平滑肌占阴茎海绵体结构的比例较正常,对照组显著降低,这是静脉性ED发生的重要原因[12]。
PI3K/Akt信号传导途径对细胞影响广泛,包括细胞分化、增殖、凋亡等。活化的Akt可以通过磷酸化直接激活eNOS,促进NO的合成。eNOS依赖于Akt磷酸化介导阴茎勃起,A2B腺苷受体通过PI3K/Akt信号激活的eNOS促进阴茎勃起[13]。阴茎海绵体平滑肌细胞和血管内皮细胞的血小板衍生生长因子在缺氧环境下分泌增多,通过PI3K/Akt信号传导增加连接蛋白的表达,并导致了ED,靶向该途径可成为治疗ED的有效策略[14]。
山海丹颗粒临床常应用于治疗冠心病、心绞痛,且疗效较好。使用山海丹颗粒治疗ED的实验及临床报道较少,尚未广泛应用。有学者临床使用山海丹颗粒联合复方玄驹胶囊治疗高脂血症伴随勃起功能障碍,结果发现可降低血脂水平并提高勃起功能,效果显著[15]。该报道也一定程度上证实了山海丹颗粒治疗ED的可行性。ED发病机制复杂,单一靶点的抑制剂药物临床有效率有限,而山海丹颗粒可靶向多条通路及多个靶点,发挥中药复方治疗优势。利用网络药理学探究山海丹颗粒治疗ED的潜在作用机制,能够为山海丹颗粒扩大适应症和临床治疗ED提供思路和依据,其具体作用机制仍然需要进一步的实验验证以及临床检验。

