BML-111抑制Hep3B细胞迁移及机制初探
徐 芬, 郝 华, 吴德强,汪庆余,李里香,徐 静,林 兰,冯 雨
(南昌大学第二附属医院 1.全科医学科、2. 病理科、3. 药剂科,江西 南昌 330006)
肝癌是消化系统常见恶性肿瘤,其发病与慢性肝炎病毒(乙型肝炎病毒和丙型肝炎病毒)密切相关。如何抑制肝癌组织中的炎症反应成为肝癌治疗的重要策略。脂氧素是人体内最重要的炎症自稳物质,在免疫自稳(包括炎症[1-2]及肿瘤[3-4])中扮演着重要角色,然而其半衰期极短且容易降解,不适合进行在体实验研究。而BML-111是其类似物,在结构上与脂氧素类似,而且两者的受体相同(均为甲酰肽受体2,FPR2),保留了脂氧素功能所必需的基团,且不易降解,性质稳定,因而在实验研究中应用较广,研究发现其对炎症[5-6]及妊高症[7]具有明显的抑制作用。我们课题组研究发现,脂氧素及BML-111调控ILK轴抑制肝细胞癌EMT及转移[8]。而近年来研究发现,5-脂加氧酶(5-lipoxygenase,5-LOX)在多种癌组织中高表达并参与肿瘤的演进。本研究拟以人肝癌细胞细胞系(Hep3B)为实验对象,采用BML-111及Boc-2(FPR2阻断剂)干预Hep3B细胞,观察BML-111对Hep3B细胞迁移的作用及对5-LOX的调控作用,为抗肝癌研究提供实验依据。
1 材料与方法
1.1 试剂TRIzol(Invitrogen15596018);引物设计及合成(上海赛百盛);逆转录相关试剂、PCR扩增仪(美国MJ research ABI9600);兔抗5-LOX(Santa Cruz Biotechnology,sc-20785);FITC荧光二抗(Boster,SA-1068);Boc-2(Sigma,06731);RPMI 1640(Gibco,31870074);BML-111(Cayman,10005032);血清(杭州四季青,2104)。
1.2 细胞培养与实验分组实验用Hep3B购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,置于培养箱培养。培养液中含20%胎牛血清(FCS)及双抗(青霉素和链霉素)。使用胰酶消化传代。采用第3~5 代细胞进行实验。实验分为三组:(1)空白组;(2)BML-111组;(3)BML-111 +Boc-2 组(Boc-2预处理30 min后,最后加入BML-111)。参考以往的文献,BML-111 选择浓度为200 μg·L-1[9]。
1.3 免疫荧光实验24孔板接种细胞,给药,24 h后弃上清,用PBS洗板,冰甲醇固定,Triton破膜,BSA封闭,40 min后加入5-LOX一抗孵育4 h(4 ℃)后PBS 洗,二抗(荧光)孵育l h(室温),Hoechest染核,15 min后显微镜下观察,拍照。荧光强度为5-LOX的表达水平,分析采用ImageJ软件。
1.4 RT-PCR技术检测MMP-2和MMP-9表达TRIzol法提取RNA。逆转录具体过程如下:先测定RNA的浓度,将上样的总RNA 量定为4 μg,根据浓度计算出需要上样的体积V,而后加入OligodT 1 μL,用DEPC补足,总体积定为16 μL。短暂离心后,接着70 ℃水浴约5min,迅速置于冰上至少1 min。接着加入其它成分(包括5×buffer 5 μL,dNTPmix 3 μL,M-MLV1 μL),最后总体积为25 μL,离心后42 ℃水浴(60 min),然后85 ℃水浴(7 min) ,从而得到cDNA 样本。PCR 过程:反应体系总体积为25 μL,包括有12.5 μL PCR 混合液,加入上、下游引物各1 μL,cDNA的上样量为1.5 μL ,最后体积定为25 μL(用无菌水补足)。内参为GAPDH。反应条件及引物序列见Tab 1。经扩增、电泳、成像,最后半定量分析,每个样本均重复3次实验,以目的基因与内参之比作为其相对表达量。
1.5 Transwell实验(1)细胞的准备:上室加入细胞悬液200 μL,加药。下室中,加入600~700 μL培养基,孵箱中培养,时间为24 h。(2)细胞计数:取出培养板,弃培养液,PBS 洗2次。再加入冰甲醇固定细胞(10 min),用棉签擦去上室中未迁移的细胞,然后用苏木素染色5 min,蒸馏水冲洗,在显微镜下拍照(随机选取视野)并计数。显微镜下计数细胞,统计学分析。
1.6 HE染色将细胞接种于六孔板中,加药作用24 h后,弃去上清,固定,染色。
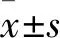
2 结果
2.1 BML-111对Hep3B细胞形态的影响Fig 1A所示,Hep3B细胞在未加任何刺激物的情况下,细胞呈多角形,多突起,细胞排列松散,体现了间质细胞的特点,即发生了上皮-间质转化(EMT)。而加入BML-111后,细胞排列紧密,突起明显减少,体现了上皮细胞的特点。而先加入受体阻断剂Boc-2后,BML-111并不能使其恢复上皮细胞形态,说明BML-111需要与受体结合发挥抑制EMT作用。
2.2 BML-111对Hep3B细胞迁移的影响Fig 1B1及B2所示,在Transwell迁移实验中,3组穿膜细胞数分别为44.666 7±11.238 91、18.666 7±5.507 57和44.333 3±11.930 35。空白组Hep3B穿膜细胞的数目较多,而加入BML-111后,细胞数减少显著(P=0.019),说明细胞迁移作用能被BML-111抑制。BML-111作用能被Boc-2阻断(P=0.020)。
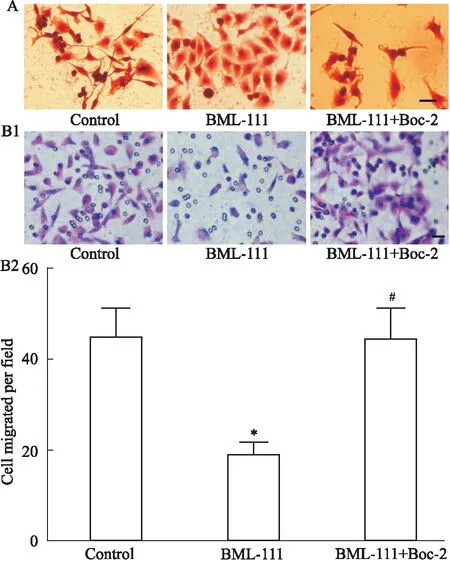
Fig 1 Effect of BML-111 on Hep3B cell morphology and
*P<0.05vsControl group;#P<0.05vsBML-111 group
2.3 BML-111对Hep3B 5-LOX表达及细胞定位的影响Fig 2A,B所示,在免疫荧光实验中,空白组Hep3B 5-LOX主要定位于细胞质和细胞核,加入BML-111后,5-LOX表达明显减少(P=0.000),并且主要定位于细胞质。而用Boc-2预处理后,再加入BML-111,并不能抑制5-LOX的表达(P=0.000)。

Tab 1 List of oligonucleotides used as PCR primers and reaction conditions
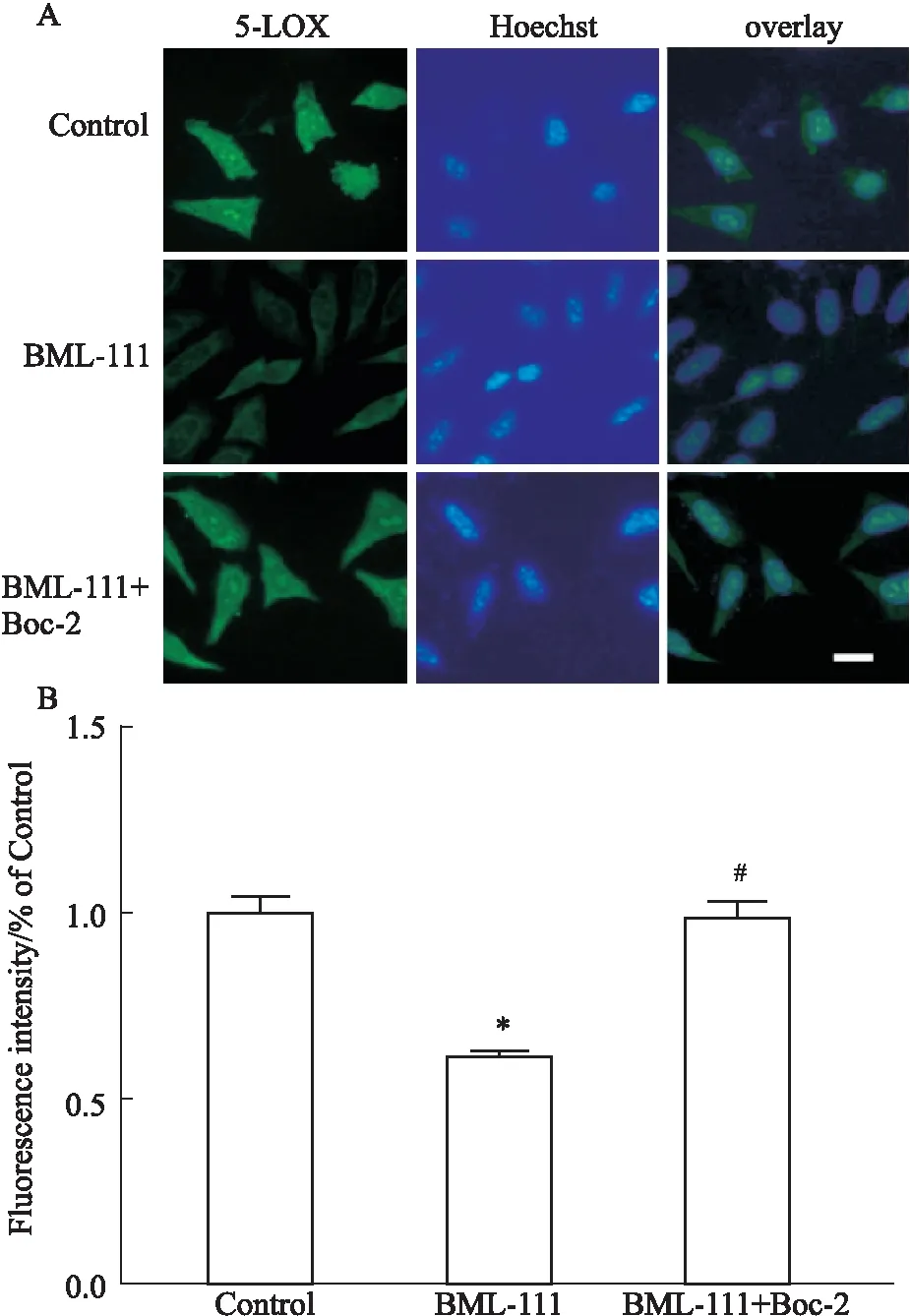
Fig 2 Effect of BML-111 on Hep3B 5-LOX expression and cell location (Bar=20
*P<0.05 vs Control group;#P<0.05 vs BML-111 group
2.4 BML-111下调5-LOX进而抑制MMP-2、MMP-9 mRNA表达如Fig 3A1及A2所示,在Western blot实验中,空白组、BML-111组及BML-111+Boc-2组5-LOX的蛋白表达量(以与内参的灰度值比较)分别为1.563 7±0.116 29、0.443 3±0.110 60和1.616 7±0.137 96。在BML-111的作用下,5-LOX的蛋白表达量明显减少,与空白组比较,差异有显著性(P=0.000)。而用Boc-2预处理可阻断其作用,5-LOX并不减少(P=0.000)。如Fig 3B1,B2,B3所示,在RT-PCR实验中,空白组MMP-2、MMP-9的表达量分别为0.543 3±0.070 95和0.793 3±0.045 09,加入BML-111后,两者的表达量明显减少,分别为0.110 0±0.030 00和0.396 7±0.047 26,与空白组比,差异均有显著性(P值均为0.000)。而加入Boc-2预处理后,再加入BML-111,两者的表达量分别为0.556 7±0.109 70和0.813 3±0.075 06,与BML-111组比,差异均有显著性(P值均为0.000)。
3 讨论
肝癌是国内常见的恶性上皮性肿瘤,其主要特征是生长迅速,早期发现困难,发现时往往为晚期,患者预后极差。如何抑制肿瘤转移是当前肿瘤研究的热点。肿瘤细胞由原发部位首先发生EMT转变,进而发生迁移、累及并侵犯周围组织,侵入脉管(包括血管和淋巴管),转移至远隔脏器。而众所周知,肝癌与慢性肝炎、肝硬化(乙肝、丙肝所致)关系密切。持续的慢性炎症所致肝细胞的增生是肝癌发生的主要原因,因而,如何抑制肝癌组织内的慢性炎症是抑制肝癌的治疗靶点。
脂氧素由花生四烯酸合成,是体内最重要的免疫自稳物质,对炎症的消退及抗肿瘤方面都发挥着重要的功能,是体内调控免疫自稳的重要物质。我们课题组近年来研究发现,脂氧素及其类似物对肝损伤[5]及肝癌[8]均具有调控作用。但由于脂氧素的半衰期短,性质不稳定,不适合实验动物研究。而脂氧素类似物BML-111在结构上具有与脂氧素相同的功能基团,而性质又相对稳定,因此被广泛应用于实验研究。5-LOX是脂氧素合成过程中的最重要的酶类,并且参与了肿瘤演进过程。有研究证明,5-LOX在多种恶性肿瘤中高表达,并且调控了肿瘤演进的多个过程,研究5-LOX的抑制剂成为抗肿瘤研究的热点[10-14]。侵袭和迁移是恶性肿瘤的重要特征,与肿瘤的进展与预后密切相关。而我们的研究发现,BML-111能有效抑制肝癌细胞EMT和迁移,BML-111在蛋白水平能明显抑制5-LOX的表达,并且通过其受体发挥作用。MMP-2和MMP-9与肿瘤迁移密切相关,所以我们进一步在mRNA水平研究了BML-111是否能抑制MMP-2和MMP-9的表达,结果与我们预期的一致。
Fig 3 MMP-2 and MMP-9 mRNA expression inhibited by BML-111 via down-regulating 5-LOX
*P<0.05vsControl group;#P<0.05vsBML-111 group
综上所述,BML-111的抗肝癌作用可能是调控多通路、多靶分子的功能。我们的研究为其抗肿瘤研究提供了新的思路,5-LOX可作为肿瘤治疗的靶点,BML-111抗肝癌机制非常复杂,尚需进一步深入并多方面研究。
(本实验是在南昌乐悠生物有限公司实验平台完成,感谢何远桥老师及其团队所给予的支持和帮助)

