去甲基化调控μ阿片受体对神经病理性疼痛痛觉过敏和吗啡耐受的影响
吴 强,林 静,刘民强,刘 丽,何仁亮
(深圳市第三人民医院1.麻醉科、2.供应室,广东 深圳 518000)
阿片类药物如吗啡依然是临床上治疗中重度神经病理性疼痛(neuropathic pain,NPP)的主要药物,但长期使用将产生药物耐受,导致疗效下降。前期研究显示,NPP过程中外周神经的μ阿片受体(mu-opioid receptor,MOR)表达下降,推测可能与吗啡耐受有关,但机制不明,表观遗传机制可能参与其中[1-2]。文献表明DNA甲基转移酶(DNA methyltransferase,DNMT)亚型DNMT3a介导的Oprm1基因(编码MOR)沉默会导致MOR表达减少,并促进神经损伤导致的NPP和吗啡耐受[3-4]。本文尝试用相反的手段,即DNA去甲基化酶TET1过表达的方式进行干预,观察其对NPP痛觉过敏和吗啡耐受的影响。
1 材料与方法
1.1 试剂与仪器兔抗TET1一抗(1 ∶ 1 000,Abcam,编号ab191698), 兔抗 GAPH一抗(1 ∶ 1 000,Santa Cruz,编号sc-20357),兔抗MOR一抗(1 ∶ 500,Immunostar,编号RA10104),山羊抗兔二抗(1 ∶ 3 000,Jackson Immuno Research),DNA 提取试剂盒(Qiagen),Ribo-Zero rRNA 试剂盒(Illumina,CA),Tru Seq Stranded Total RNA 样品制备试剂盒(Illumina,CA),5mC/5hmC一抗(BI-MECY, Eurogentec),热辐射测痛仪(美国 IITC Life Science),Von Frey针(美国Stolting),电泳转膜系统(Bio-Rad),高通量测序平台Illumina Hi Seq 2500。
1.2 方法
1.2.1实验动物分组 成年SD大鼠,♂,体质量(250~300) g,购于广东实验动物中心,许可证号SCXK(粤)2017-0029,饲养于温度(20~25)℃、昼夜12 h交替环境中,自由取食饮水。随机数字表法分为4组:① 假手术组(Sham组):将左侧的坐骨神经充分游离暴露但不结扎;② 慢性压迫性损伤(chronic constriction injury,CCI)组:将左侧坐骨神经游离暴露结扎;③ CCI+TET1组:背根神经节(dorsal root ganglia,DRG)内微注射HSV-TET1,3 d后结扎左侧坐骨神经。④ CCI+GFP组:DRG内注射HSV-GFP,3 d后结扎左侧坐骨神经。
1.2.2DRG内HSV-TET1病毒质粒微注射 在异氟醚吸入麻醉后,显微镜下小心操作三维手动旋钮,使玻璃微注射管(直径 20~40 μm)中心垂直于已暴露的DRG上方,然后缓慢向下调节旋钮,使其尖端垂直刺入背DRG表面,刺入时有轻微的突破感。微量注射泵的流速为12 μL·h-1,最后注入HSV-TET1(2 μL, 20 μmol·L-1)或HSV-GFP(2 μL)。HSV-TET1由美国罗格斯大学Tao教授馈赠。
1.2.3坐骨神经结扎CCI模型制备 病毒注射3 d后,参考Bennett等[5]的方法建立大鼠CCI模型:异氟烷吸入麻醉下将大鼠左侧卧位固定在操作台上,右侧后肢皮肤去毛,碘伏消毒,于坐骨结节处切开皮肤,钝性分离肌肉后暴露坐骨神经,用4-0的羊肠线打4个单线结,松紧度控制在勉强能够滑动为宜,间距约为1 mm,术毕逐层缝合伤口,单笼饲养。
1.2.4疼痛行为学观察和测量 在造模前3 d测定各组大鼠基础痛阈值,在造模前1 d,造模后d 3、d 5进行疼痛行为学测定。所有测定均在8 ∶ 00~12 ∶ 00 am安静环境下进行。
① 机械刺激缩爪反应阈值(paw withdrawal threshold, PWT)测量:参考Chaplan和何林峰等[6-7]的方法,以up and down 法测定PWT。将一透明有机玻璃箱放置于金属筛网上,让大鼠适应环境10 min 后,用Von Frey 针刺激大鼠术侧后足掌部持续时间≤4 s,阳性反应依据为大鼠出现抬足或舔足行为。初始刺激强度为2 g,当该力度刺激为阴性反应,则增大一级力度刺激;如反应为阳性则减少一级力度,如此交替直至出现第1次阳性。取 4 次测定平均值为阈值。最大力度为15 g,大于此值时记为15 g。注意每次刺激间隔(30 s)和刺激力度相当。② 热辐射刺激缩爪反应潜伏期(paw withdrawal latency, PWL)测量:参考 Hargreaves 等[8]的方法,将大鼠放置专用透明有机玻璃板上,调整热痛刺激仪光源焦距照射动物后肢掌心,记录动物从照射开始到引起缩肢反应的时间。每只大鼠测量 5 次,间隔时间5 min,上限20 s,以避免造成组织损伤。
1.2.5Western blot 于术后d 7行为学检测完毕后,采用颈椎脱臼法处死大鼠,沿棘突切开皮肤,除棘突和椎板,快速取出各组大鼠左侧 L5 DRG,加入组织裂解液,提取总蛋白,定量后行SDS-PAGE 电泳,转膜,室温下 5% 脱脂奶粉封闭 2 h,加入一抗 4 ℃下孵育过夜。次日PBST洗膜后重复清洗3次后,加入相应二抗室温下孵育2 h,ECL显影,记录分析实验结果。
1.2.6吗啡耐受模型的建立及测定[9]CCI造模术后d 4开始,每天早晚皮下注射吗啡10 mg·kg-1(间隔12 h),连续7 d,建立吗啡耐受模型。于术后d 7、9、11早注射吗啡前,检测吗啡耐受情况。方法:给予吗啡诱导量3 mg·kg-1皮下注射,在注射前后0.5 h测量TWL,连续测定3次,间隔1 min,上限值20 s。计算最大镇痛效应百分比(maximum potential analgesic effect,MPAE),公式为MPAE/%=(给药后TWL-给药前TWL)/(20-给药前TWL)×100%。
1.2.7甲基化水平检测 上述吗啡耐受模型大鼠行为学检测完毕后处死,采集L5 DRG,参照试剂盒说明书提取DNA,采用DNA blot方法检测DRG全基因5mC和5hmC水平,采用亚硫酸氢盐测序和Tab-seq技术检测MOR启动子区域5mC和5hmC水平。
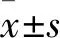
2 结果
2.1 注射HSV-TET1对CCI模型大鼠疼痛行为学影响如Fig 1所示,各组大鼠在手术前3 d和1 d 热痛阈值(PWLs)及机械痛阈值(PWTs)无统计学差异,术后d 3、d 5 CCI大鼠术侧PWLs和PWTs明显降低,差异有统计学差异(P<0.01)。DRG内微注射HSV-TET1可以明显缓解疼痛,PWLs和PWTs恢复基础水平;HSV-GFP疼痛阈值无明显影响(Fig 1 A, C)。手术对侧疼痛阈值在各时点没有明显改变(Fig 1 B, D)。
2.2 HSV-TET1注射对CCI模型大鼠DRG内TET1和MOR表达的影响如Fig 2所示,CCI术后TET1表达没有变化,HSV-TET1注射后TET1表达显著增加(P<0.01)。CCI术后MOR表达明显下降(P<0.01),HSV-GFP注射不能逆转MOR表达下降,HSV-TET1注射可以逆转这种效应,MOR表达明显增加(P<0.01)。
2.3 TET1过表达对于吗啡用于NPP镇痛效果的影响如Fig 3所示,CCI术后d 3,吗啡3 mg·kg-1肌注对于sham组大鼠和CCI组大鼠的镇痛效应MPAE分别约为(90.6±9.3)和(39.8±11.2)(P<0.01),吗啡对CCI大鼠的镇痛效果明显减弱。CCI+GFP组大鼠MPAE为(37.1±7.6),和CCI组相似;注射HSV-TET1后,吗啡的镇痛效应恢复至约(76±8.6)(P<0.01)。
2.4 TET1过表达对CCI大鼠吗啡耐受的影响如Fig 4所示,吗啡3 mg·kg-1对于CCI大鼠术后d 7、9、11的MPAE值分别约为50、30、19,发生了明显的吗啡耐受。CCI+GFP组大鼠的MPAE值分别为48、29、19,和CCI组结果相似。TET1组相应时点的MPAE分别为80、58、30,sham组分别为90、63、30,TET1组和sham组各时点比较差异无统计学意义,TET1组和CCI组各时点比较差异有统计学意义(P<0.01)。

Fig 1 Effect of HSV-TET1 microinjection in DRG on nerve-injury induced nociceptive
**P<0.01vssham group

Fig 2 Effect of HSV-TET1 microinjection on level of TET1 and MOR in L5 DRG after
**P<0.01vssham group;##P<0.01vsCCI group

Fig 3 Effect of TET1 overexpression on morphine
**P<0.01vssham group;##P<0.01vsCCI group

Fig 4 Effect of TET1 overexpression on morphine
*P<0.05,**P<0.01vsCCI group
2.5 TET1过表达对DRG全基因甲基化水平的影响如Fig 5 所示,DNA blot实验结果表明,4组实验大鼠L5 DRG内的5mC和5hmC的总含量半定量值差异无统计学意义(P>0.05)。
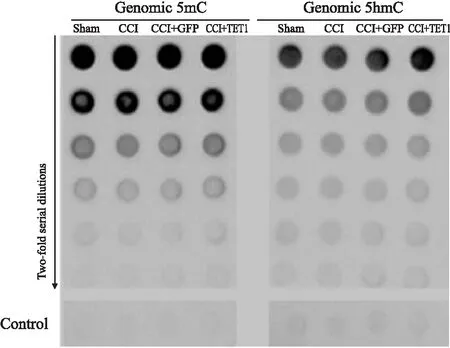
Fig 5 Effect of TET1 overexpression on level of genomic 5mC/5hmC in L5 DRG after
2.6 TET1过表达对DRG内OPRM1启动子区域甲基化水平的影响如Fig 6所示,CCI模型大鼠MOR基因OPRM启动子区域Oprm1(-450/-288)和Oprm2(-238/+439)5mC相对水平上升,5hmC水平下降(P<0.01);HSV-GFP注射对此效应没有影响,HSV-TET1注射可以逆转此效应。
3 讨论
虽然阿片类药物是目前NPP中重度患者最常使用的药物,但其在临床上的治疗效果并不理想,并且反复使用会产生药物耐受。既往研究发现,NPP形成后, 脊髓背角和DRG内MOR表达明显下降,这被认为是NPP病理过程维持及阿片类药物疗效不佳和耐受的主因之一[10-12]。但导致MOR表达减少的原因,目前仍然不十分明确。
DNA甲基化机制是最早发现又最具特征的基因表观修饰方式, 是基因表达状态稳定的主要机制之一。越来越多的研究者发现,表观遗传相关的表型变化与疼痛的关系[13]。机体中甲基化和非甲基化的动态平衡是由两类酶进行调控:一种是促进甲基化过程的酶,即DNA甲基转移酶家族DNMTs,使胞嘧啶(C) 转变为 5-甲基胞嘧啶(5mC);另一种是促进去甲基化的酶TET(Ten-eleven translocation methylcytosine dioxygenase)蛋白,催化 5mC 的氧化成为衍生物5-羟甲基胞嘧啶(5hmC),从而使已经甲基化的胞嘧啶去甲基化。最近的研究表明,DNMTs和TET蛋白共同维持着甲基化和去甲基的平衡[3]。DNA 的甲基化可以抑制相关基因的活性, 而去甲基化则能促进相关基因的活化甚至重新表达。因此体内无论甲基化酶DNMTs还是去甲基化酶TET发生变化,都会影响目的基因转录活性,从而导致蛋白表达和相应的生理功能发生改变。TET蛋白家族有3个成员,分别为TET1、TET2和TET3。TET1是目前公认的最具有催化5mC羟基化的活性酶。前期的结果显示,受损的DRG神经元中DNMT亚型DNMT3a的表达上调,但TET1的表达无明显变化,从而导致甲基化-去甲基化动态失衡[3]。本实验从调节TET1表达着手,尝试恢复机体甲基化-去甲基化的平衡状态,从而改善NPP的状态和吗啡耐受。

Fig 6 Effect of TET1 overexpression on level of 5mC/5hmC in two regions of oprm1 gene after
**P<0.01vssham group;##P<0.01vsCCI group
本实验结果表明,CCI模型的大鼠,在外周神经损伤d 3即开始出现痛觉过敏,证明NPP模型建立成功。CCI大鼠DRG的MOR表达水平明显减少,这和之前的实验结果相一致。我们采用腺病毒载体技术,将HSV-TET1注射入DRG内,Western blot结果表明,DRG内TET1表达明显增加,并且可以显著逆转神经损伤导致的MOR表达减少,行为学检测表明,TET1过表达可以缓解疼觉过敏。在CCI d 3,我们检测同等剂量的吗啡对不同分组大鼠镇痛效果的影响。实验结果显示,剂量3 mg·kg-1的吗啡,sham组大鼠的MPAE约为90,而CCI大鼠的MPAE约为40,注射HSV-TET1的大鼠MPAE恢复至约70。以上结果证实,CCI大鼠发生了痛觉过敏,且对吗啡的反应下降;TET1过表达可以恢复MOR的表达,改善NPP的状态,并部分恢复吗啡对NPP的镇痛作用。
我们进一步对CCI大鼠连续7 d注射吗啡建立吗啡耐受模型,观察TET1过表达对大鼠吗啡耐受的作用。实验结果显示,随着时间推移,吗啡对CCI大鼠的镇痛效应明显减弱,患侧的MAPE在d 7、d 9、d 11的MPAE分别约为50、30、19,产生了明显的吗啡耐受。注射HSV-TET1的大鼠在相同的时间点的MPAE分别约为80、58、30,表明虽然也产生了吗啡耐受,但耐受的情况得到明显改善。利用DNA探针发现,TET1过表达并不会改变DRG整体的甲基化水平,但直接基因测序结果显示注射TET1可以使MOR启动子内的两个特定区域Oprm1(-450/-288)和Oprm2(-238/+439)5mC含量下调,5hmC含量上调,即去甲基化水平上升,从而影响MOR的表达,最终影响到吗啡的镇痛效能。以上结果表明,TET1可以通过调节MOR启动子区域的甲基化水平,恢复MOR的表达,改善NPP的吗啡耐受。
综上所述,NPP过程中痛觉过敏和吗啡耐受可能与外周神经甲基化水平失衡,MOR表达水平下降有关。DNA去甲基化酶TET1可以调节MOR的启动子区域5mC和5mhC的平衡,恢复MOR的表达,从而改善NPP的痛觉过敏和吗啡耐受。本研究结果可以帮助深入理解NPP的发病机制,并为其临床治疗提供新的思路和靶点。
——吗啡

