四季抗病毒合剂治疗小儿新型冠状病毒肺炎的可行性分析△
刘妍如,唐志书*,宋忠兴,周瑞,许洪波,于金高,张君威,王昌利,,马虎强
1.陕西中医药大学 陕西省中药资源产业化协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/ 陕西省创新药物研究中心,陕西 咸阳 712083;2.陕西海天制药有限公司,陕西 咸阳 712046
2020年2月8日,武汉儿童医院报道了中国首例儿童感染新型冠状病毒肺炎(COVID-19)危重病例[1]。随着全国COVID-19确诊病例的不断上升,儿童病例报道也逐渐增多,最小确诊病例仅为出生30 h的新生儿。尽管数据显示儿童感染病例远少于成人,但儿童的免疫系统尚未发育完全,对细菌、病毒的抵抗力也比成人更弱,属于易感人群,更需要严密关注。目前,临床使用的洛匹那韦、利托那韦和瑞德西韦等抗病毒药物并不是针对儿童研发的,临床有效性和安全性也有待观察[2-3]。中医认为,治病应充分考虑小儿“脏腑娇嫩、形气未充”的特点,以扶正祛邪为本,侧重清热解毒、通腑泄热、活血化瘀和健脾燥湿。目前,中医药疗法虽已显示出临床疗效,但大多数的药物或复方制剂都不适合小儿“脏娇”的特点。因此,找到一种符合小儿体质特点的药物是非常必要的。
四季抗病毒合剂是由鱼腥草、桑叶、连翘、菊花、薄荷、桔梗、荆芥、紫苏叶、苦杏仁、芦根和甘草11味中药组成的中药复方口服制剂。四季抗病毒合剂在临床上对于小儿呼吸道感染的治疗作用得到了一定程度的肯定,但对于其活性成分及疗效机制的研究却鲜有报道[4-6]。因此,本研究从其临床有效性和安全性评价入手,采用网络药理学方法构建“中药-成分-疾病-靶点”关联网络,从整体预测药物靶点、作用通路和干预机制,采用分子对接技术筛选抗病毒活性成分,以阐释其干预COVID-19的作用内涵。
1 资料与方法
1.1 四季抗病毒合剂治疗小儿呼吸道感染有效性和安全性评价
1.1.1数据来源 以“四季抗病毒合剂”或“四季抗病毒”为主题词(或关键词),从中国期刊全文数据库(CNKI)、万方数字化期刊数据库和维普数据库(VIP)中检索文献。时间范围为1979年—2020年3月。从PubMed、Web of Science和Cochrane library数据库中以Title/Abstract检索“siji kangbingdu”,检索截止时间为2020年3月。检索无语言限制。
1.1.2纳入标准 纳入meta分析的文献应满足以下条件:1)研究设计,随机对照(randomized controlled trial,RCT)试验,采用或不采用盲法;加入平行对照组(安慰剂组或阳性药物组)。2)研究对象,根据《小儿卫生总微论方》所载:“当以十四以下为小儿治”,研究对象纳入年龄应为0~14岁的儿童,包括新生儿、婴儿、幼儿和儿童;病理状态符合《急性上呼吸道感染基层诊疗指南》(2018年)、《实用儿科学》及《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》中对急性上呼吸道感染、流感和病毒性肺炎的相关描述。3)干预方法,观察组干预方法为四季抗病毒合剂或在常规治疗(抗炎、抗感染、止咳、退热)基础上加用四季抗病毒合剂;对照组干预方法为抗病毒药物利巴韦林、干扰素或联合常规治疗。4)结果评价方法,根据《中医病症诊疗标准》《中药新药临床研究指导原则》,有明确的临床疗效判定标准;有明确的临床总有效率计算结果,数据应包括显效病例数、有效病例数和无效病例数。
1.1.3排除标准 1)非临床研究;2)研究对象为非呼吸道感染的病例;3)其他临床研究:评论、病例个案报告、通讯、社论和问卷调查。
1.1.4数据收集和提取 删除重复文献,根据Cochrane Handbook 评价手册以Reviewer Manager 5.3软件对纳入文献进行风险偏倚和质量评估,评价结果以“低风险”“非明确风险”“高风险”表示。数据进行标准化处理,以减少报告偏差和误差。
1.2 四季抗病毒合剂治疗小儿COVID-19的可行性分析
1.2.1化学成分收集及筛选 从中药系统药理学数据库与分析平台(The traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://www.tcmspw.com)中收集四季抗病毒组方中药鱼腥草、桔梗、桑叶、连翘、荆芥、薄荷、紫苏叶、苦杏仁、芦根、菊花和甘草的主要化学成分[7]。进一步以OB≥30%或DL≥0.18作为条件,对化合物进行进一步筛选。
1.2.2化合物及疾病相关靶点筛选 从TCMSP和Pubchem(http://pubchem.ncbi.nlm.nih.gov)数据库中搜索化合物对应的靶点,以UniProt数据库(http://www.uniprot.org/uniprot/)对收集的靶点进行规范化和校正,得到成分相关的基因靶点。在MalaCards数据库(https://www.malacards.org/)、TTD数据库(Therapeutic Targets Database,http://bidd.nus.edu.sg/ BIDD-Databases/ TTD/ TTD.asp)和OMIM 数据库(http://www.ncbi.nlm.nih.gov/omim)中输入关键词“SARS(Severe Acute Respiratory Syndrome)”“Respiratory Failure”,搜索已报道的与冠状病毒感染相关的基因。剔除重复和假阳性基因后,整理得到与冠状病毒感染相关的靶点基因。
1.2.3“成分-疾病-靶点”网络构建 将上述得到的化合物相关靶点和疾病相关靶点以Venn工具(2.1.0,https://bioinfogp.cnb.csic.es/tools/venny/)取靶点交集。将交集内靶点导入STRING 11.0数据库(https://string-db.org/),以人类(Homosapiens)为种属,查询蛋白相互作用信息,从而构建PPI(Protein to Protein Interaction)网络。
整合PPI网络的蛋白互作信息,“成分-疾病-靶点”及“中药-成分”信息,将数据导入Cytoscape 3.7.2软件,构建“中药-成分-疾病-靶点”预测网络。以网络的节点和边线来描述化合物与中药、疾病和靶点之间的关系,以Cytoscape 的Network analysis插件分析并提取网络节点和边的特征。
1.2.4生物过程注释及代谢通路分析 为了分析四季抗病毒合剂的作用机制,采用R软件包(3.6.2)的Cluster profiler包对交集靶点进行GO(Gene Ontology)生物信息学富集分析,用3个本体(Ontology)来描述基因靶点的分子功能(Molecular Function,MF)、所处的细胞位置(Cellular Component,CC)和参与的生物过程(Biological Process,BP)[8]。然后以KEGG(Kyoto Encyclopedia of Genes and Genomes,https://www.kegg.jp/)数据库对靶点基因参与的主要生化代谢途径进行富集和注释,显著性差异设定卡值为P<0.05,以R软件包(3.6.2)的ggplot2包进行绘图。最终整合冠状病毒感染的病理学、分子生物学机制研究,对四季抗病毒合剂的多成分、多靶点、多途径协同抗COVID-19的机制进行阐释。
1.3 四季抗病毒合剂抗新型冠状病毒(2019-nCoV或SARS-CoV-2)的活性化合物预测
1.3.1靶点与配体预处理 以上海科技大学饶子和、杨海涛课题组公布的2019-nCoV 3CLpro高分率晶体结构(PDB ID:6LU7,https://www.rcsb.org/structure/6LU7)为对接模板用于分子对接位点分析。采用Schrodinger-2018软件对6LU7结构进行加氢、去水、去杂原子等预处理。以6LU7原配体化合物为参照,将四季抗病毒合剂中经口服生物利用度(OB)、类药性(DL)筛选的化合物作为对接配体,并对各化合物分子进行加氢等优化预处理,生成批量处理文件。
1.3.2分子对接 以原始配体分子为中心(盒子大小设为14Å)生成格点文件。以6LU7作为刚性受体,各配体分子作为构象可变化(柔性)配体,进行半柔性对接,以对接打分值docking core≤-6作为筛选条件。
2 结果与分析
2.1 四季抗病毒合剂可有效治疗小儿呼吸道感染
2.1.1文献检索结果及质量评估 如图1文献筛选流程所示,从中文和英文数据库中检索文献共413篇,剔除重复文献后为160篇。阅读所有选中文献的标题或摘要后,排除非临床研究64篇,数据重复的临床研究1篇,研究对象为非小儿呼吸道感染的临床研究56篇,初步筛选得到文献为39篇。经进一步阅读全文详细分析,排除非随机对照的临床研究12篇,以中药复方作为对照的研究12篇,最终筛选得到15篇RCT文献(3247例病例)。在这15篇文献中,14篇文献以利巴韦林为对照组,1篇文献以重组人干扰素α1b为对照组。12篇文献以四季抗病毒合剂为实验组,2篇以利巴韦林合并四季抗病毒给药为实验组,1篇以干扰素合并四季抗病毒合剂联合给药为实验组[9-23]。
根据Cochrane Handbook 评价手册,对入选15篇文献的随机分配方法、分配方案隐藏、双盲方案、结论评估、报告偏倚及其他偏倚进行了逐条风险评估(见图2)。结果显示,4项研究选择了合适的随机分配方法(不包括按就诊顺序的随机分组),评为“低风险偏倚”;其余研究仅提及随机分组,未提及具体方法,评为“不明风险偏倚”。所有研究均未对分配方案隐藏、双盲方案进行说明,评为“不明风险偏倚”。15篇文献皆对总有效率中的病例数进行了说明,将结论评估和报告偏倚评为“低风险偏倚”。
2.1.2纳入研究特征 表1列出了以上15篇文献的基本研究特征:第一作者、出版时间、研究对象年龄、样本大小、干预方法、评价参数、不良反应描述。
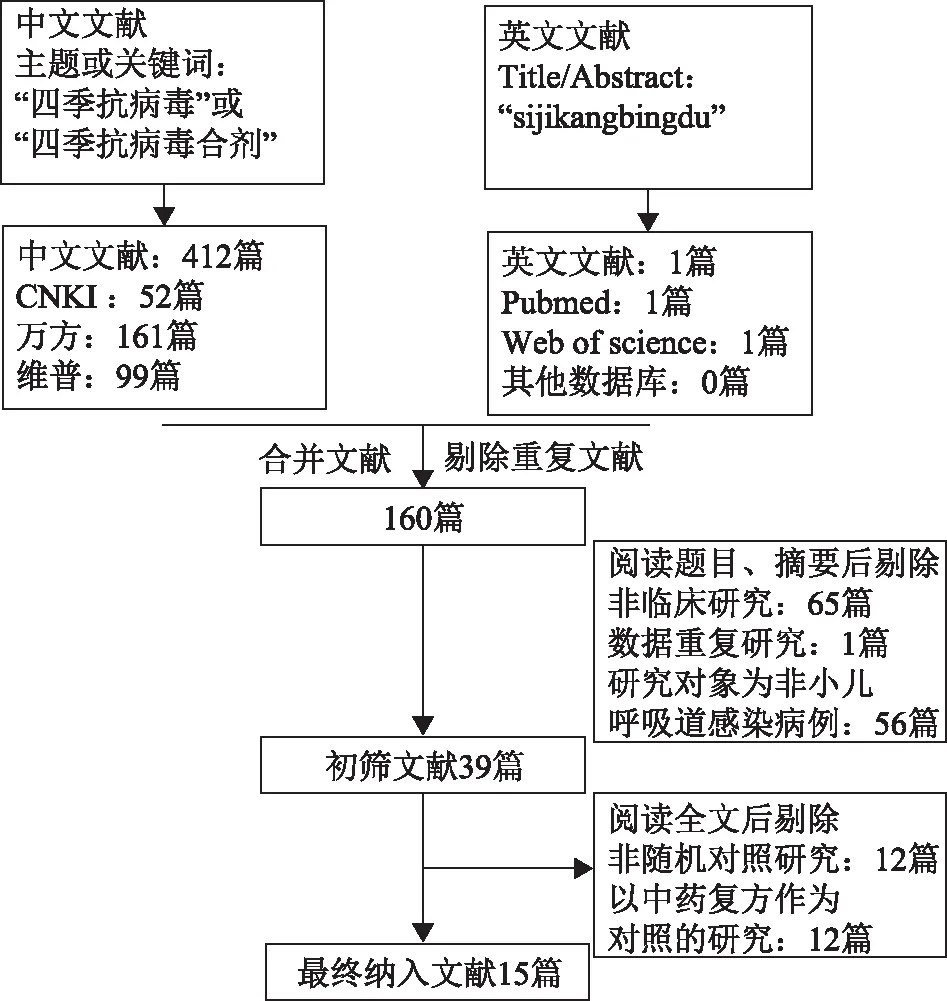
图1 四季抗病毒合剂治疗小儿呼吸道感染中英文文献筛查流程图
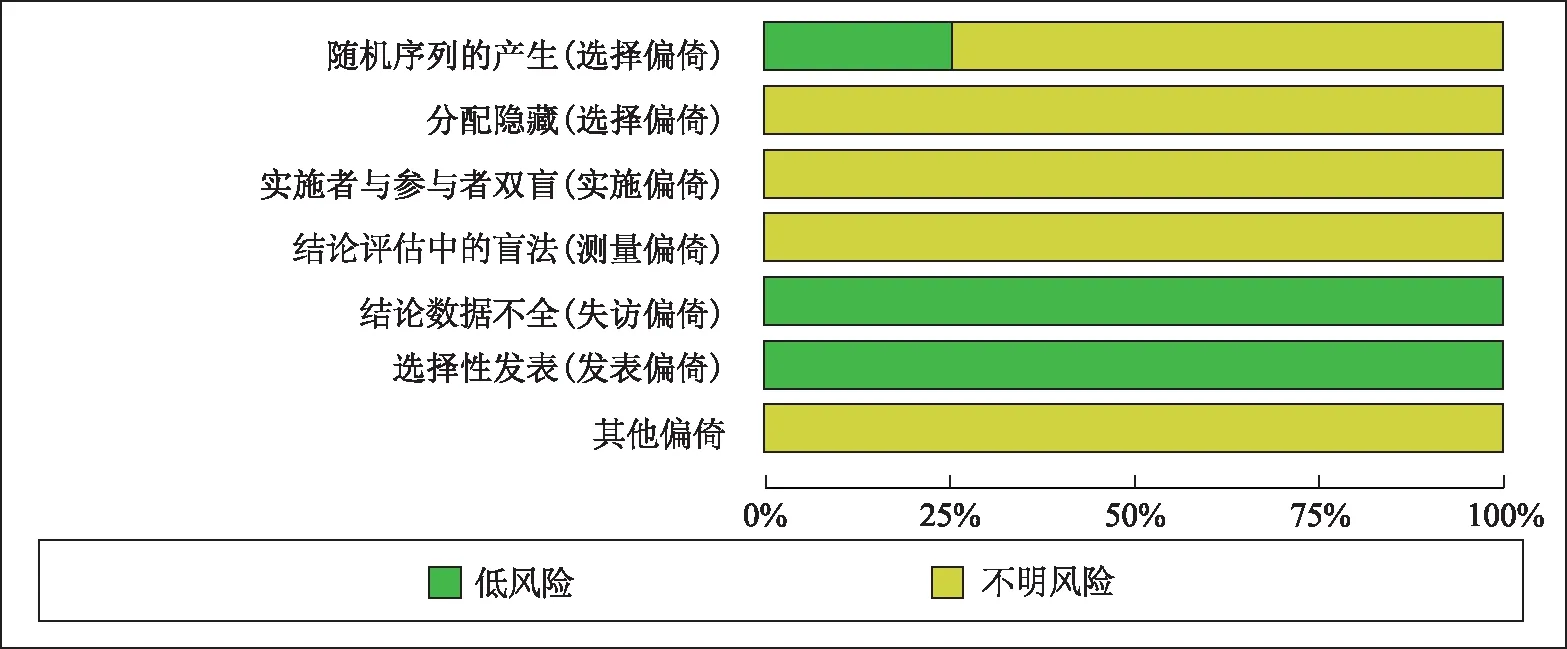
图2 四季抗病毒合剂治疗小儿呼吸道感染文献风险偏倚评价
表1 四季抗病毒合剂治疗小儿呼吸道感染纳入研究特征
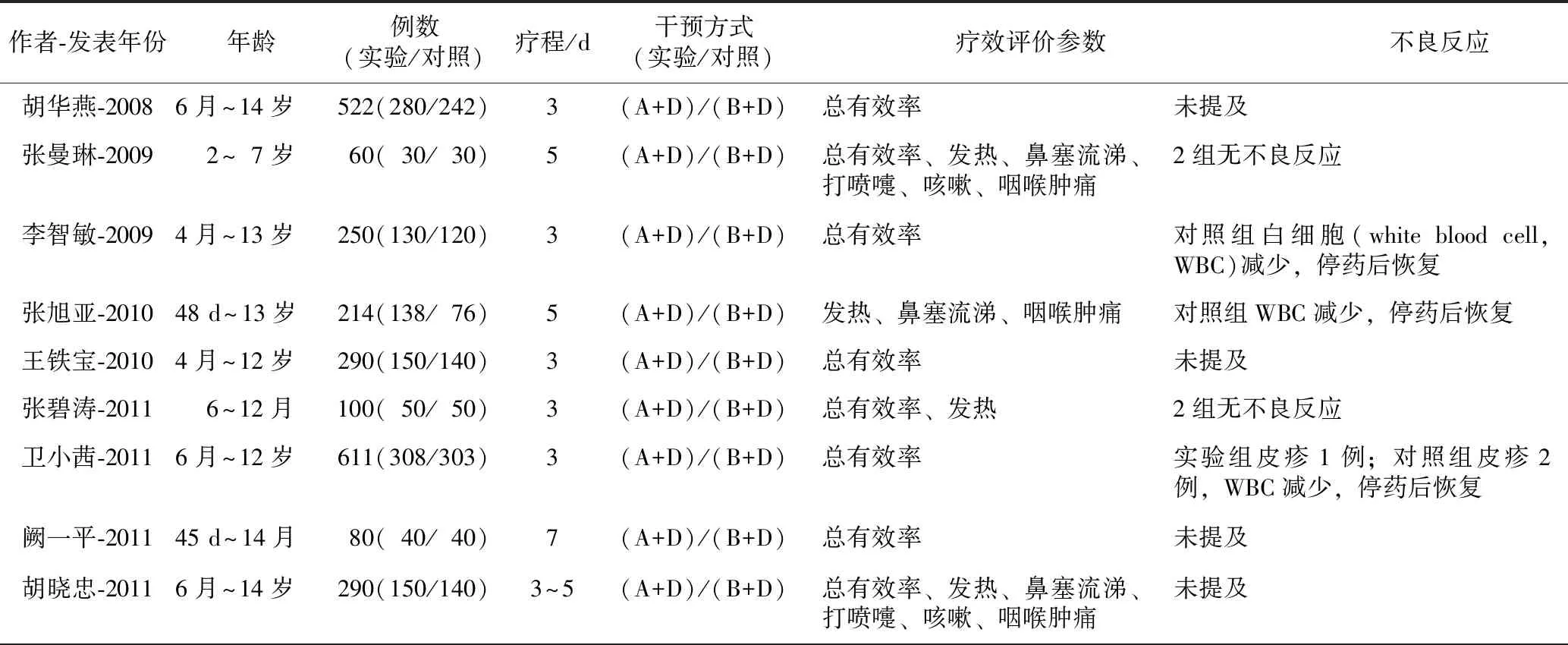
作者-发表年份年龄例数(实验/对照)疗程/d干预方式(实验/对照)疗效评价参数不良反应胡华燕-20086月~14岁522(280/242)3(A+D)/(B+D)总有效率未提及张曼琳-2009 2~7岁60(30/30)5(A+D)/(B+D)总有效率、发热、鼻塞流涕、打喷嚏、咳嗽、咽喉肿痛2组无不良反应李智敏-20094月~13岁250(130/120)3(A+D)/(B+D)总有效率对照组白细胞(white blood cell,WBC)减少,停药后恢复张旭亚-201048 d~13岁214(138/76)5(A+D)/(B+D)发热、鼻塞流涕、咽喉肿痛对照组WBC减少,停药后恢复王铁宝-20104月~12岁290(150/140)3(A+D)/(B+D)总有效率未提及张碧涛-2011 6~12月100(50/50)3(A+D)/(B+D)总有效率、发热2组无不良反应卫小茜-20116月~12岁611(308/303)3(A+D)/(B+D)总有效率实验组皮疹1例;对照组皮疹2例,WBC减少,停药后恢复阙一平-201145 d~14月80(40/40)7(A+D)/(B+D)总有效率未提及胡晓忠-20116月~14岁290(150/140)3~5(A+D)/(B+D)总有效率、发热、鼻塞流涕、打喷嚏、咳嗽、咽喉肿痛未提及
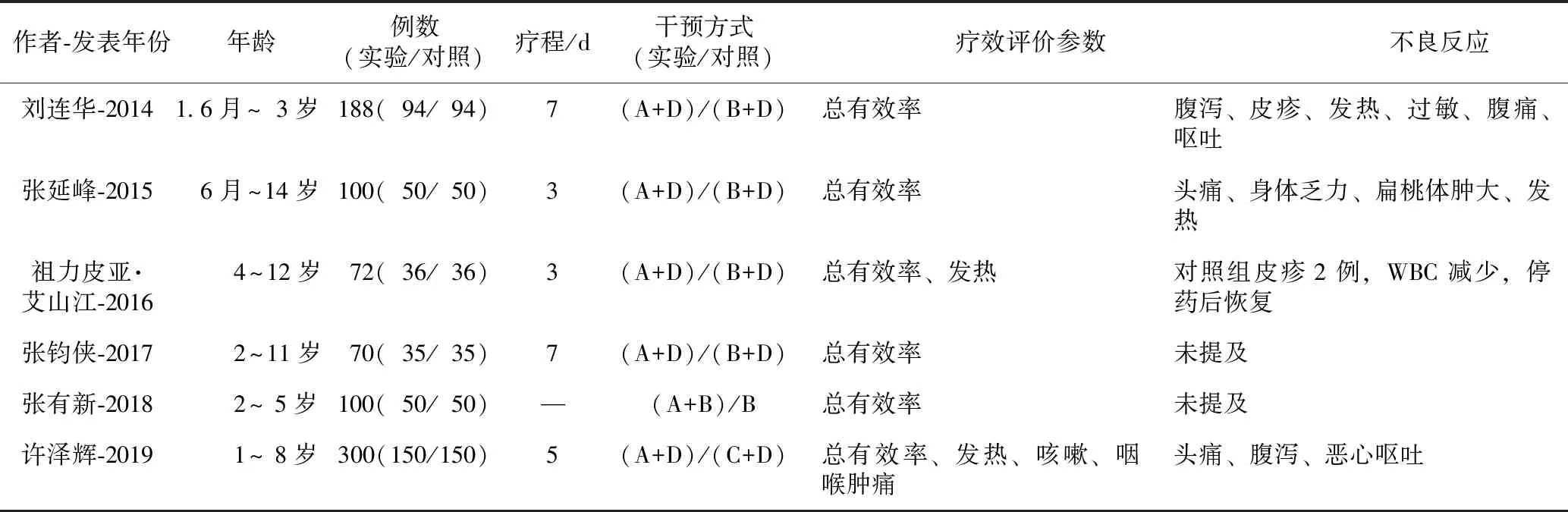
续表1
注:A.四季抗病毒合剂;B.利巴韦林;C.干扰素α1b;D.常规治疗;—表示未提及。
2.1.3疗效评估
2.1.3.1总有效率 经过初步比较,15个研究中,有14个文献报道了总有效率,根据研究的干预措施的差异,将14个文献进行亚组分析[9-11,13-23]。12项研究为联合常规消炎、退热治疗手段的比较研究,1项为联合对照组利巴韦林的比较研究,1项为联合干扰素α1b的比较研究。经过比较分析,12项联合常规手段的研究间异质性P=0.08,I2=38%>20%,说明研究具有中度异质性。从敏感性分析结果来看,12项研究中有1项是影响总体异质性的文献。在删除该文献结果后,研究间异质性P=0.40,I2=0%,剩余的研究异质性检验差异无统计学意义。图3显示,除3项研究跨越无效线外[16,19,26],其余9项研究的95%CL横线均位于无效线右侧(RR<1)[9,11,14-19,21],说明四季抗病毒合剂联合常规治疗能够有效治疗小儿呼吸道感染,且疗效优于利巴韦林(RR=0.15,95%Cl[0.12,0.18])。1项联合对照利巴韦林和1项联合干扰素α1b给药的有效性P值分别为0.01和0.003(<0.05),说明四季抗病毒合剂联合利巴韦林或干扰素α1b给药的总体有效率优于对照[22-23]。从总体分析结果来看,14项研究的异质性P=0.11,I2=33%>20%,具有中度的异质性。总体有效性Z=8.82,P<0.000 01(RR=0.14,95%Cl[0.11,0.17]),说明四季抗病毒合剂治疗的总体有效性优于利巴韦林或干扰素α1b(见图3A)。
2.1.3.2呼吸道感染症状 根据干预对呼吸道感染症状的改善类型,将治疗指标亚组分析按照退热时间、止咳时间、和咽喉肿痛消除时间进行分组并分析。15项研究中有4项研究对干预后的退热情况进行了统计,从提取的退热时间(d)亚组分析结果可以看出(见图3B),异质性P<0.000 01,I2=97%,说明组间具有很大异质性[10,12,20,23]。因此,采用随机效应模型,标准化均数差(SMD)进行统计。由亚组森林图可见,4项研究的95%Cl横线均位于无效线的左侧,代表总体效应的菱形方块位于无效竖线的左侧,有效性Z=2.48,P=0.01(RR=-1.49,95%Cl[-2.66,-0.31])。说明四季抗病毒合剂能够有效治疗或缓解呼吸道感染的发热症状,优于利巴韦林或干扰素α1b且差异有统计学意义。
15项研究中有3项研究对干预后的止咳时间进行了统计,异质性P=0.000 2,I2=88%,说明组间具有很大异质性(见图3B)[10,12,23]。删除张旭亚(2010)研究后,异质性P=0.69,I2=0%,说明该研究是造成组间异质性的主要来源。亚组森林图结果显示,3项研究的95%Cl横线均位于无效线的左侧,代表总体效应的菱形方块位于无效竖线的左侧,有效性Z=3.47,P=0.000 5(RR=-0.99,95%Cl[-1.54,-0.43])。说明四季抗病毒合剂能够有效治疗呼吸道感染的咳嗽症状,优于利巴韦林或干扰素α1b且差异有统计学意义。
15项研究中有3项研究对干预后的咽喉肿痛消退时间进行了统计,异质性P<0.000 01,I2=92%,说明组间具有很大异质性(见图3B)[10,12,23]。亚组森林图结果显示,3项研究的95%Cl横线均位于无效线的左侧,代表总体效应的菱形方块位于无效竖线的左侧,有效性Z=2.71,P<0.000 01(RR=-0.95,95%Cl[-1.64,-0.26])。说明四季抗病毒合剂能够有效治疗呼吸道感染的咽喉肿痛症状,优于利巴韦林或干扰素α1b且差异有统计学意义。
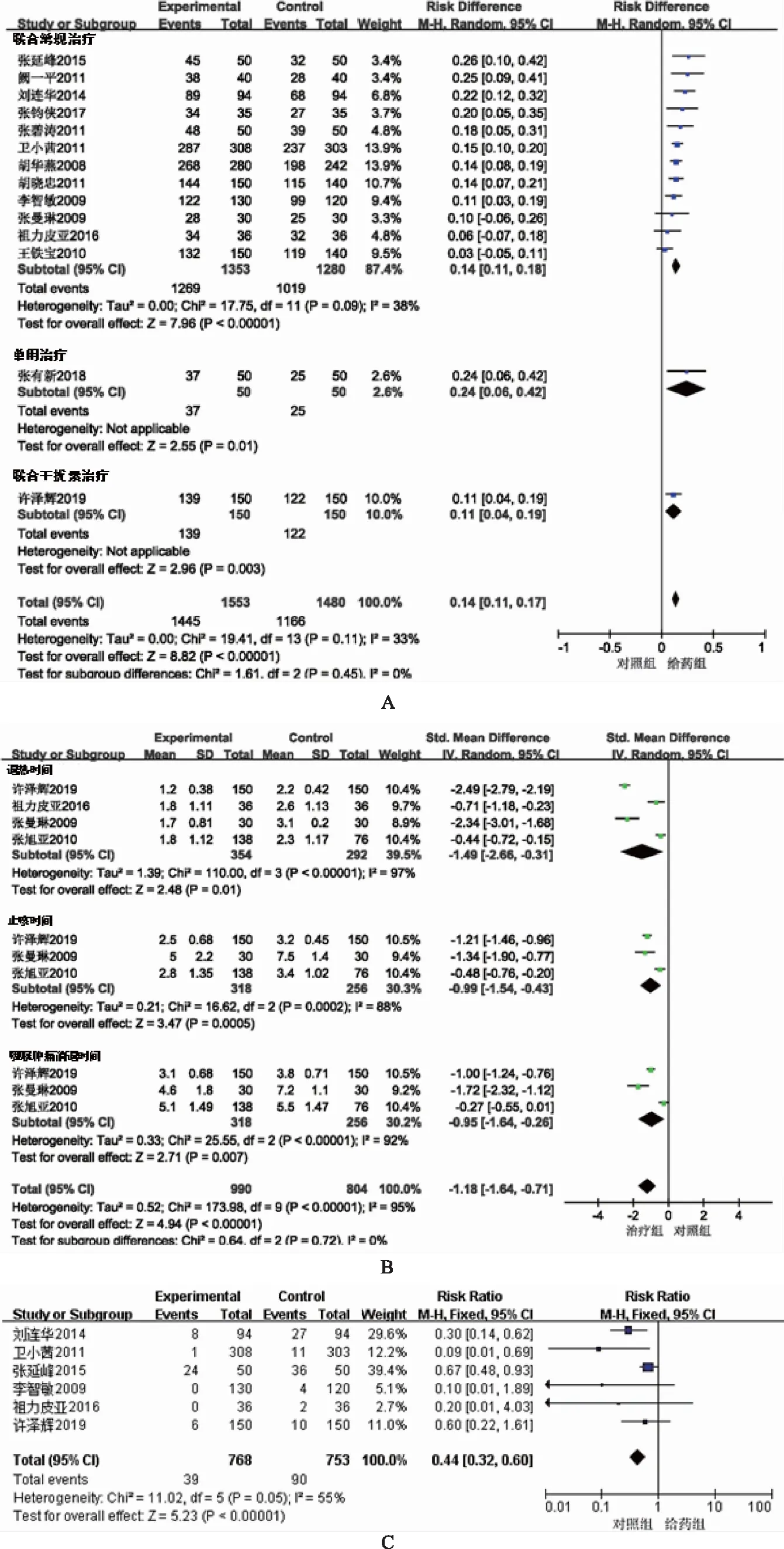
注:A.总有效率分析;B.症状缓解亚型分析;C.安全性分析。图3 四季抗病毒合剂治疗小儿呼吸道感染有效性与安全性分析森林图
总体有效性Z=4.94,P<0.000 01(RR=-1.18,95%Cl[-1.64,-0.71]),说明四季抗病毒合剂对缓解呼吸道感染的发热、咳嗽和咽喉肿痛症状优于利巴韦林或干扰素α1b。
2.1.4安全性评价 对四季抗病毒合剂用药安全性评价中,纳入分析的15项研究中有6项研究对不良反应率和具体症状进行了报道(见图3C)[11,15,18-20,23]。有4项研究报道了利巴韦林给药后WBC降低,给药结束后恢复正常[11-12,15,20];1项研究在四季抗病毒合利巴韦林干预后出现皮疹[15];2项研究均提到四季抗病毒合剂给药后出现了头痛、腹泻和恶心呕吐症状[19,23]。分析结果显示,组间异质性P=0.05,I2=55%,说明了组间的高度异质性。删除张延峰(2015)研究后,异质性P=0.42,I2=0%,说明该研究是造成组间异质性的主要来源。由森林图可见,有3项研究跨越了无效线,3项研究的95%Cl横线位于无效线的左侧,代表总体效应的菱形方块位于无效竖线的左侧,Z=5.23,P<0.000 01(RR=0.44,95%Cl[0.32,0.60]),说明四季抗病毒合剂在治疗小儿呼吸道感染中与对照相比不良反应较小。
2.2 四季抗病毒合剂具有多成分、多靶点的协同抗COVID-19作用
2.2.1化学成分筛选 结合前期发表的四季抗病毒合剂成分鉴定结果与TCMSP数据库收载的组方中药化学成分数据,共获得化学成分1377个[24]。以口服生物利用度(OB)≥30%或类药性(DL)≥0.18作为进一步筛选条件,得到符合筛选标准的活性化合物226个。
2.2.2“成分-疾病-靶点”筛选 四季抗病毒的226个活性化合物在TCMSP和Pubchem数据库中对应的靶点共有334个,以Uniprot数据库搜索校正后生成“成分-靶点”集合。从MalaCards数据库、TTD数据库和OMIM 数据库中得到与冠状病毒感染诱发的急性呼吸综合症状“SARS”和“Respiratory Failure”相关的靶点共计144个,生成“疾病-靶点”集合。将上述得到的“成分-靶点”和“疾病-靶点”集合以Venn工具 2.1.0取靶点交集,得到交集靶点24个(见图4A)。将交集内靶点导入STRING 11.0,构建PPI(Protein to Protein Interaction)网络(见图4B)。
2.2.3“中药-化合物-靶点”网络构建分析 将筛选得到的24个靶点与中药进行映射,筛选得到88个化学成分,并生成关联表,与PPI网络生成的互作表导入Cytoscape3.7.2软件构建四季抗病毒合剂的“中药-化合物-靶点”关联网络。如图4C所示,所构建的关联网络包括123个节点和939条边。图中节点大小代表度数大小,度数越大,说明该节点在网络中越重要,接近中心度越大,说明节点在网络中越接近中心。该网络中度数较大,接近中心度>0.45的化合物为槲皮素(度数=248)、木樨草素(度数=82)、山柰酚(度数=50)、β-谷甾醇(度数=24)、芦丁(度数=22)、豆甾醇(度数=16)和柚皮素(度数=16)。网络中度数较大,接近中心度>0.5的靶点为PTGS1(度数=106)、ADRB2(度数=52)、JUN(度数=45)、IL6(度数=41)、IL1B(度数=35)、IL10(度数=32)、IFNG(度数=29)、ACHE(度数=29)和IL2(度数=29)。以上结果表明四季抗病毒合剂在发挥药效过程中具有多成分、多靶点的协同作用。
2.2.4生物过程注释及代谢通路分析 为了探讨四季抗病毒合剂抗COVID-19作用的潜在分子机制,将“成分-疾病”对应的24个靶点通过Cluster profiler进行GO富集分析和KEGG通路注释,共富集到169条生物学过程,19条代谢通路。GO富集分析结果如图5所示,这些靶点主要分布于质膜外侧(GO:0009897,external side of plasma membrane)、细胞器包膜管腔(GO:0031970,organelle envelope lumen)和分泌颗粒腔(GO:0034774,secretory granule lumen)。其分子功能(MF)主要与细胞因子受体结合(GO:0005126,cytokine receptor binding)、细胞因子活性(GO:0005125,cytokine activity)和G蛋白偶联受体结合活性(GO:0001664,G protein-coupled receptor binding)有关。生物学途径(BP)主要涉及脂多糖反应(GO:0032496,response to lipopolysaccharide)、细菌来源分子效应(GO:0002237,response to molecule of bacterial origin)和细胞因子产生的正调控(GO:0001819,positive regulation of cytokine production)。这些靶点主要调控的代谢通路为:IL-17信号通路(hsa04657,IL-17 signaling pathway)、细胞因子受体相互作用通路(hsa04060,Cytokine-cytokine receptor interaction)、病毒蛋白与细胞因子-细胞因子受体相互作用通路(hsa04061,Viral protein interaction with cytokine and cytokine receptor)和花生四烯酸代谢通路(hsa00590,Arachidonic acid metabolism)。

注:A.“成分-疾病”靶点交集韦恩图;B.筛选靶点PPI图;C.“中药-成分-靶点”关联图(橙色:活性化合物;紫色:靶点;绿色:组方中药)。图4 四季抗病毒合剂治疗小儿呼吸道感染“中药-成分-疾病-靶点”网络关联图构建
2.3 四季抗病毒合剂的黄酮类成分是抑制2019-nCoV 3CL pro蛋白的主要成分
2.3.1对接体系验证 将对接前后的6LU7原始配体进行构象叠合来验证对接方法的准确度,叠加结果显示均方根偏差(RMSD)值为1.281 3Å < 2Å,说明该对接体系可以用于配体化合物与6LU7的对接测试。
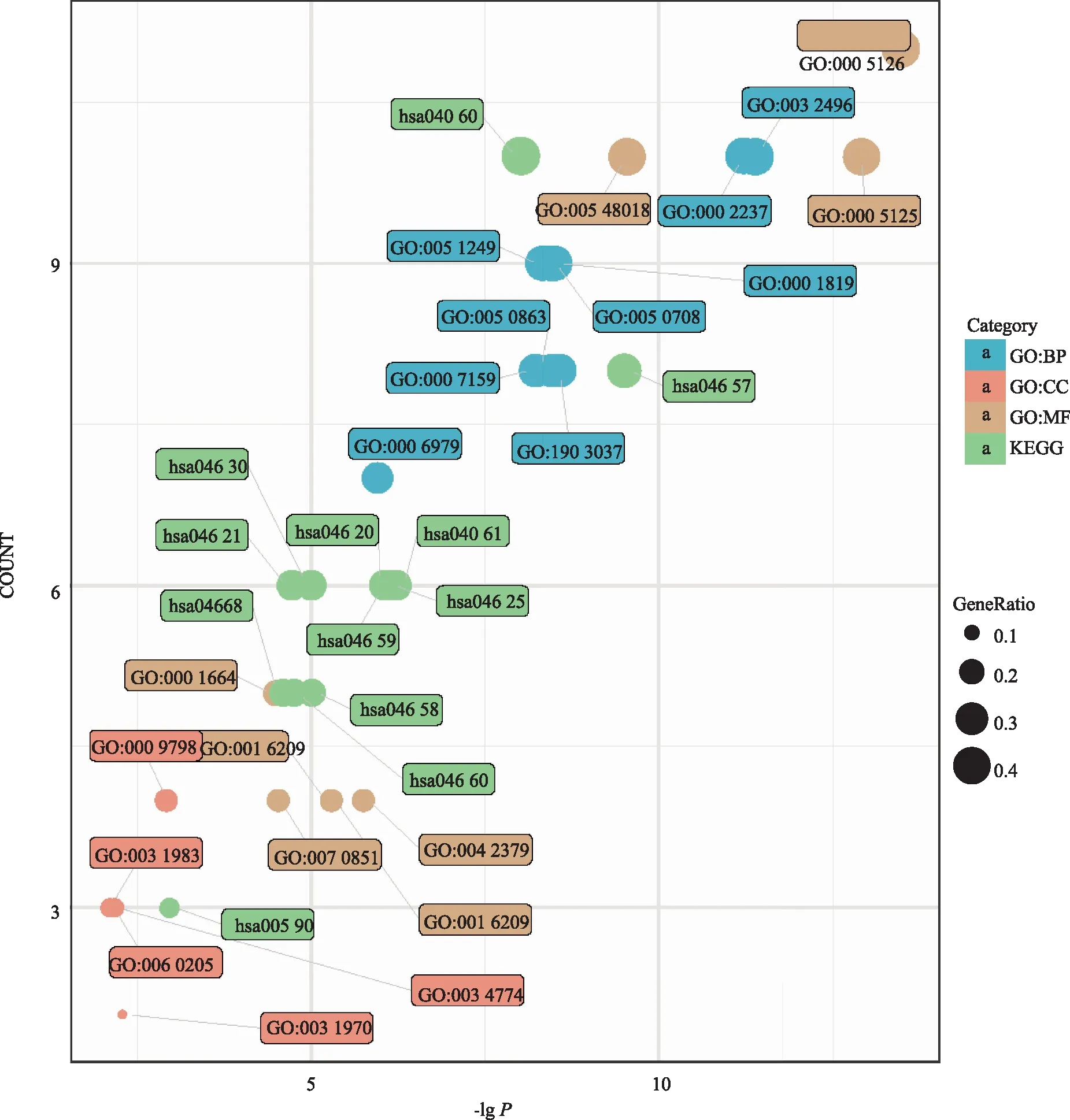
图5 四季抗病毒合剂靶点GO富集及KEGG通路注释
2.3.2四季抗病毒合剂化合物对接测试 分子对接的打分值(docking core)绝对值越大说明配体-受体亲和力越强,两者结合越牢固。将筛选得到的88个化合物与6LU7体系(包括预处理受体和格点文件)进行对接测试,以对接打分值≤-6.0作为筛选条件。结果得到符合筛选标准的化合物12个(见表2)。12个化合物中9个为黄酮类化合物,其他分别为酚酸、单萜和生物碱类化合物。对接结果表明,大部分化合物和受体结合以发生氢键作用为主,且四季抗病毒合剂中具有2019-nCoV 3CL pro蛋白抑制作用的化合物主要为黄酮类化合物,其结合位点主要为GLU166、LEU141、CYS145、ASP187和HID163。结果见表2。
4 讨论
四季抗病毒合剂组方是以汉代名医张仲景《伤寒论》的古方和清代医家吴鞠通《温病条辨》中的桑菊饮、银翘散为基础,尊古创新,加减化裁而得。方中鱼腥草微寒,味辛,归肺经,以清解肺热见长,又具化痰排脓之效。连翘性微寒,味苦,归肺、心、小肠经,辛凉透邪清热,又可芳香辟秽解毒。桑叶性寒,味甘、苦,归肺、肝经,既可疏散上焦风热,
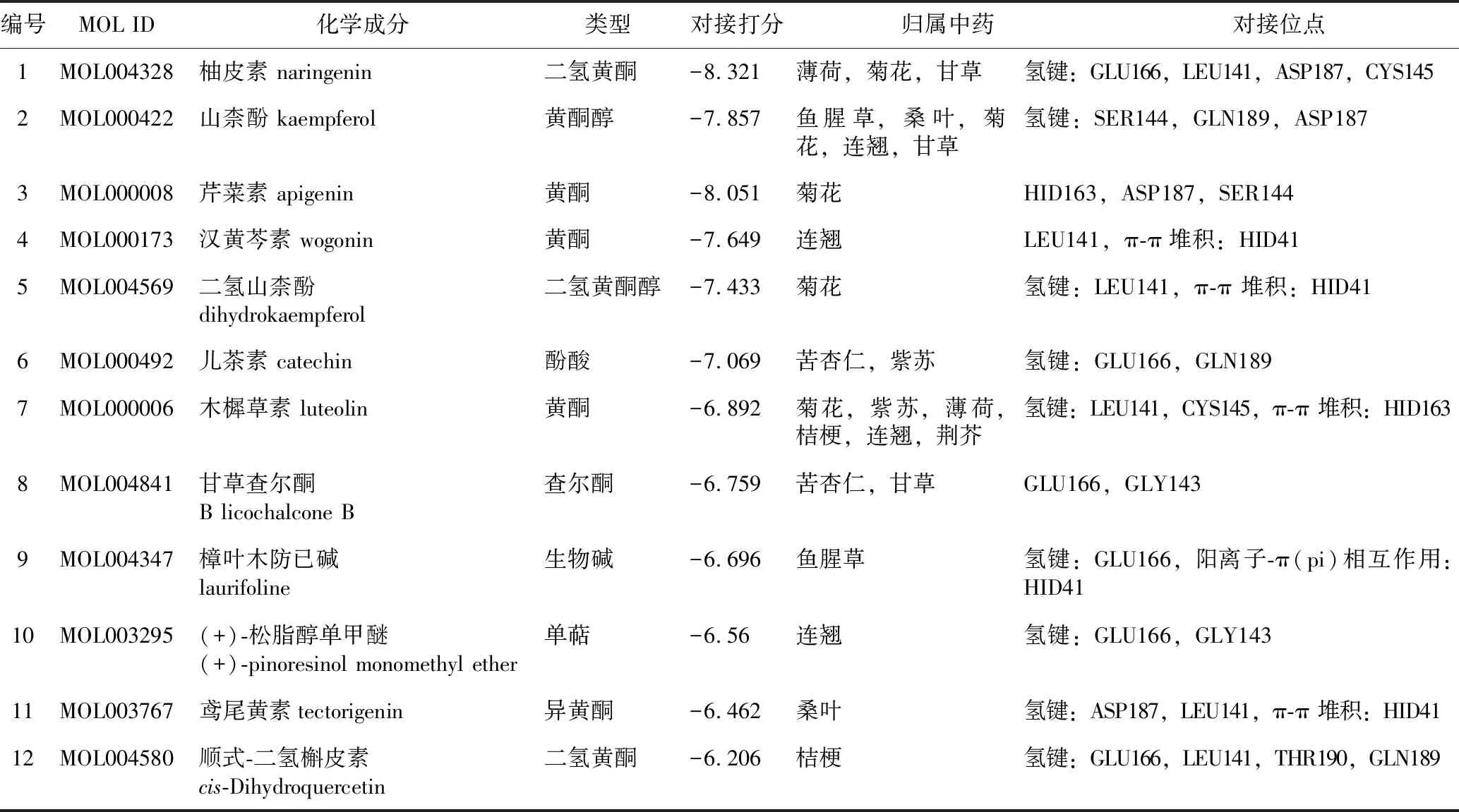
表2 四季抗病毒候选化合物对接结果
又可清宣肺热,凉润肺燥;三药协同为用,清热解毒,疏散风热,宣肺止咳,为方中之君药。菊花微寒,味甘、苦,归肺、肝经,具有清散风热,清利头目的功效;杏仁苦降,归肺、大肠经,能够肃降肺气,止咳平喘;桔梗辛散,归肺经,具有开宣肺气,祛痰利咽的作用,二药宣降相伍,桔梗又能祛痰利咽,三药和合,清泄肺热并解其毒,宣降肺气以复其清肃,使君药清热宣肺之力大增,故而为臣药。薄荷辛凉,归肺、肝经,佐君臣发散风热,又可清利头目,通鼻窍;荆芥、紫苏叶辛温发散,主归肺经,助连翘发汗逐外邪;芦根甘寒,归肺、胃经,其功效清热,生津止渴,配伍佐药,主症兼症得以消散,皆为佐药之用。甘草合桔梗使用,既可宣肺止咳,利咽化痰,又可调和药性,兼具佐使之功。诸药配合,全方共奏疏风透表,清热解毒,宣肺止咳之功。
四季抗病毒合剂主要用于小儿呼吸系统感染,本研究对15项临床研究,3247例病例进行循证meta分析。从分析结果来看,目前四季抗病毒合剂的临床应用多采用联合消炎、退热给药的治疗方法,多与抗病毒药物利巴韦林、干扰素进行对照比较。从meta分析结果来看,四季抗病毒合剂单用或联合常规给药的临床总有效率明显优于对照。在缩短发热时间、咳嗽时间、咽喉肿痛时间方面,四季抗病毒合剂不论是单用、联合常规治疗,还是联合对照给药,其疗效均明显优于利巴韦林或干扰素联合常规治疗。在治疗过程中,四季抗病毒合剂的不良反应较少,在有报道安全性指标的6项研究中,仅有3项研究出现了头痛、腹泻、呕吐的报道,而对照利巴韦林给药后往往出现WBC降低,且出现更多的不良反应病例。这些结果说明在常规治疗基础上,联用四季抗病毒合剂是治疗小儿呼吸系统感染安全、有效的措施。然而纳入文献在数量、质量上的缺陷,降低了本次分析的可靠性,因此需要采用国际统一的诊断标准,开展更多大样本、多中心的随机对照双盲试验。
到目前为止,COVID-19的发病机制尚未完全阐明。已有一些研究发现,COVID-19主要为2019-nCoV直接致病,病毒的刺突蛋白通过与血管紧张素转换酶2(ACE2)蛋白结合,介导病毒进入宿主,从而激活机体的免疫细胞,并使其分泌大量细胞因子和趋化因子,进而导致呼吸系统出现免疫性炎症和病理损伤[25]。目前临床常用具有抗炎、调节免疫、抗氧化作用的清热解毒中药,来缓解病毒感染诱发的“过度保护”免疫反应,减轻肺脏等组织损伤。四季抗病毒合剂具有清热解毒、清热消炎的功效,有效性、安全性较高,有治疗小儿COVID-19的潜力。然而其组方复杂,作用机制难以预测,使其临床应用受到阻碍。因此,本研究采用网络药理学方法对四季抗病毒合剂潜在的活性成分和作用靶点进行预测,从系统层面研究其作用机制。通过构建“中药-成分-疾病-靶点”关联网络,对其中因素进行网络拓扑学分析,结果发现,四季抗病毒合剂中的活性成分与冠状病毒(SARS-CoV)感染诱发的“急性呼吸综合症”的27个靶点相关。其中,复方的黄酮类成分如槲皮素、木樨草素、山柰酚、芦丁和柚皮素是干预疾病的主要成分。已有研究显示,黄酮类化合物对呼吸道感染病毒如SARS-CoV、轮状病毒、柯萨奇A16、合胞病毒、甲型流感亚型病毒等有显著的抑制作用,其作用机制可能通过破坏病毒RNA复制,干预病毒解旋酶,抑制神经氨酸酶来发挥抗病毒作用[26]。本研究结果与文献报道一致,说明通过“中药-成分-疾病-靶点”关联网络分析四季抗病毒合剂抗COVID-19作用的合理性和科学性。
本研究的生物信息学富集结果显示,四季抗病毒合剂中的活性成分可通过多个靶点发挥抗COVID-19的作用。预测结果的环氧化酶1(PTGS1)、βT肾上腺素能受体(ADRB2)、c-Jun蛋白(JUN)、白细胞介素6(IL6)、白细胞介素1素(IL1B)、白细胞介素10(IL10)、干扰素γ(IFNG)、乙酰胆碱酯酶(ACHE)和白细胞介素2(IL2)在关联网络中占有重要地位,这些靶点与多种生物过程相关,主要涉及白细胞介素-17(IL-17)信号通路、细胞因子受体相互作用通路、病毒蛋白与细胞因子-细胞因子受体相互作用通路和花生四烯酸代谢通路,这些生物过程与病毒感染造成的自身免疫反应和炎症发生、发展密切相关。IL-17信号通路是四季抗病毒成分作用靶点的重点富集通路,IL-17由辅助性T细胞(Th17)和先天性免疫细胞分泌,是一个重要的促炎症细胞因子,IL-17受体(IL-17R)通过信号转导复合体IL-17R-Act1-TRAF6激活下游IL-6、IL-1β、核因子κB(NF-κB)、c-Jun氨基末端激酶(JNK)等炎症相关信号通路,在多种炎性反应及自身免疫性疾病病理过程中发挥关键作用。从本研究的PPI分析及代谢通路富集结果来看,四季抗病毒合剂活性成分主要作用于 IL-17信号通路,推测其机制为通过抑制白细胞介素8(IL8)/ C-X-C-趋化因子配体8(CXCL8)、C-X-C-趋化因子配体10(CXCL10)、C-X-C-趋化因子配体2(CXCL2)和C-C趋化因子配体2(CCL2)等多种趋化因子的产生,降低粒细胞、巨噬细胞和淋巴细胞在炎症部位的聚集,来降低炎性效应。同时,还可以通过降低IL-17对环氧化酶1(PTGS1)的诱导作用,对感染COVID-19后出现的多种并发症有缓解作用,如维持血小板水平、保护胃肠道黏膜、改善肾脏损伤等。而PTGS1也是关联网络中的核心靶点,和四季抗病毒合剂中多个重要活性成分显著相关。GO富集分析及网络关联结果显示,四季抗病毒合剂中的化合物可能通过直接或间接作用于PTGS1来降低前列腺素H2(PGH2)的扩血管作用,从而抑制炎症细胞进入炎症部位;也可能通过抑制PGH2下游代谢促炎物质前列腺素E2(PGE2)、前列腺素D2(PGD2)、前列腺素F2α(PGF2α)大量生成,来修复组织器官损伤[27]。
在阐释四季抗病毒合剂对COVID-19及并发症具有抗炎的“治标”作用同时,也对其在新型冠状病毒复制过程中的干扰作用进行了分析,以期找到“治本”的关键信息。3C样蛋白酶(3CLpro)是在2019-nCoV复制过程中的重要蛋白,其序列高度保守,是一类半胱氨酸水解酶,主要作用是水解冠状病毒复制过程中编码的多聚蛋白pp1a和pp1ab来产生功能蛋白,人体中尚未发现相似的水解酶[28]。因此,本研究采用计算机辅助药物设计的分子对接技术,以2019-nCoV 3CLpro作为抗新型冠状病毒靶标筛选的首选蛋白,提取“成分-疾病-靶点”网络中的关键化合物作为配体,通过搜索受体-配体结合的优势构象,评价对接分子的结合强度,找到兼有“治标”和“治本”作用的活性化合物。通过结合药代动力学和药物设计学参数,筛选得到12个对3CLpro有潜在抑制作用的化合物。通过分析其类型和结合位点发现,这些化合物中大多为黄酮、黄酮醇类化合物,主要和受体的GLU166、LEU141、CYS145和HID163位点发生氢键作用,说明这些化合物在发挥抗炎作用同时,也具有抗病毒的潜力。
综上所述,本研究对四季抗病毒合剂临床用药的有效性、安全性进行了循证医学评价,提出其在治疗小儿COVID-19方面具有潜在的可行性。同时对其在干预COVID-19及并发症中的活性成分、作用靶点、相关通路和作用机制进行了探索性研究。研究结果初步表明,四季抗病毒合剂在干预新型冠状病毒感染方面,不但与炎症通路相关性较高,其重要活性成分还有潜在的抗病毒作用,说明四季抗病毒合剂可通过多成分、多靶点、多通路的互作模式达到兼顾“治标”和“治本”的治疗作用。