消化条件对大豆油O/W乳状液脂肪消化的影响
王萌 蒋芸 赵世豪 万刘灵 张文丽 伍娟 程宇


摘要:以游离脂肪酸释放量为指标,通过pH-stat方法考察脂肪酶、胆盐、CaCl2浓度对大豆油O/W乳状液在静态胃消化和动态胃消化模型中脂肪消化的影响。结果表明,乳状液消化过程符合一级动力学方程y-y0=ae-kt。脂肪酶活性升高可增大脂肪酸释放速率,增加脂肪酸释放量。在一定浓度范围内,胆盐和CaCl2浓度增加可提高脂肪酸释放速率,增大游离脂肪酸释放量。在相同消化条件下,乳状液中的脂肪在动态消化模型中的消化程度高于静态消化模型。
关键词:乳状液;pH-stat;体外消化模型;脂肪酸释放
中图分类号:TS201文献标志码: A
文章编号:1002-1302(2020)07-0221-05
随着人们生活水平的提高,体质量超标导致的肥胖已经成为影响人们健康的因素之一。通常,控制脂肪的消化进而调控其吸收被认为是实现体质量控制的有效手段之一[1]。食品乳状液是食品中脂肪存在的主要形式之一,因而关于食品乳状液中脂肪消化的研究受到了关注。目前,模拟消化模型结合pH-stat法是研究食品乳状液中脂肪消化的主要手段[2]。然而,由于脂肪消化主要发生在肠消化阶段,因而这些模型通常只是考察肠消化阶段的影响而较少考虑胃消化阶段对乳状液中脂肪在后续肠消化阶段的影响。同时,不同研究人员使用的消化模型存在一定差异,因而多国科学家共同讨论出了一个标准化的静态消化模型[3]来消除模型带来的差异,这一模型在目前的研究中被广泛地用于脂肪消化研究。但是由于是通用模型,这一模型并未探讨脂肪酶活性和胆酸盐浓度这2个对脂肪消化影响较为显著的因素[4]对乳状液中脂肪消化的影响。此外,研究表明,外源钙离子浓度对乳状液中脂肪消化有显著影响[5],这一模型中同样未涉及。因此,本研究拟以模型乳状液为对象,考察静态胃消化和动态胃消化、脂肪酶活性、胆酸盐浓度以及钙离子浓度对乳状液在肠消化过程中脂肪消化的影响,为含乳状液食品的开发和配方设计提供参考。
1 材料与方法
1.1 试验材料与设备
胃蛋白酶Pepsin(酶活性250 U/mg)、脂肪酶Lipase(酶活性38 U/mg)、Tween 20,购自美国Sigma-Aldrich 试剂公司;猪胆盐、CaCl2及其他试剂,购自国药集团化学试剂有限公司;福临门大豆油,购买于当地超市;实验室用水为去离子水,自制。
HG15A高速分散机,大韩科学仪器有限公司生产;AH-basic 型高压均质机,ATS 工业系统有限公司生产;KMO-2B 磁力搅拌器,艾卡(广州)仪器设备有限公司(IKA中国)生产;蠕动泵 BT/01L,保定雷弗流体科技有限公司生产。
1.2 试验方法
1.2.1 乳状液的制备
将大豆油和质量分数为1.125%的Tween20溶液(100 mmol/L醋酸缓冲液、pH值为3)以1 ∶9质量比混合后用高速分散机在21 600 r/min下乳化2 min,再用高压均质机将乳状液在30 MPa下均质2次,得到乳状液。
1.2.2 体外模拟消化 (1)乳状液的静态消化模型。静态消化模型参考 Minekus等的方法[3]。取样品10 mL置于酶解杯中并在 37 ℃下保温 5 min,接着加入 6.4 mL模拟胃液浓缩液和5 μL CaCl2溶液,混匀后分别加入0.360 mL 1 mol/L HCl和1.635 mL 超纯水,调pH值至3.0后加入 1.6 mL 胃蛋白酶溶液(25 000 U/mL),在 37 ℃、100 r/min 条件下模拟胃消化2 h。然后,在消化液中加入 1 mol/L NaOH 调节 pH 值至 7.0,接着分别加入 11 mL 模拟肠液浓缩液、2.5 mL猪胆盐溶液、40 μL CaCl2溶液、1.460 mL超纯水,混匀后加入 5 mL 脂肪酶,在 37 ℃、100 r/min 条件下保持pH值为7模拟肠消化1 h。
(2)乳状液的动态消化模型。动态消化模型中只考虑动态胃模型,肠消化为静态。动态消化模型参考刘运的方法[6]。取配制好的样液 10 mL 在 37 ℃ 下温育 5 min,向消化体系中以恒定的速率42 L/min 同时滴加模拟胃液(8 mL模拟胃液浓缩液、320 mg 胃蛋白酶、5 μL CaCl2溶液、2 mL 超纯水)和盐酸(1 mol/L),在 37 ℃、100 r/min条件下反应 2 h;胃消化结束后加1 mol/L NaOH 调节 pH值至7,静置2 min后,肠消化同(1)。
1.2.3 乳状液中游离脂肪酸释放量
参考 Li等的方法[2]计算消化过程中脂肪酸的释放量。游离脂肪酸释放的百分比(FFA)计算公式如下:
式中:V为消耗NaOH溶液的体积,L;C为NaOH溶液的浓度,mol/L;m为消化体系中三酰基甘油的总质量,g;M为三酰基甘油的平均分子质量,大豆油为876.56 g/mol。
1.2.4 消化条件对乳状液中脂肪消化的影响 在肠消化试验中,调节脂肪酶、胆盐的添加量,考察脂肪酶活性(终浓度19、38、76 U/mL)、膽盐浓度(终浓度0、5、10、20 mg/mL)对乳状液脂肪酸释放的影响。
1.2.5 CaCl2的添加对乳状液中脂肪消化的影响 在肠消化试验中,调节CaCl2的添加量,考察CaCl2 浓度(0、5、10、20 mmol/L)对乳状液脂肪酸释放的影响。
1.2.6 乳状液消化过程中显微结构的表征 在消化过程中取不同消化时间(胃消化0、1、2 h,肠消化0、1、2 h)的消化样品置于显微镜载玻片,在显微镜(物镜40×)下观察乳状液经过消化样品的微观结构。
1.3 数据分析
试验进行3次重复。单次重复试验在不同时间进行,并设置至少2次平行试验。试验数据的差异性通过DPS 7.05软件进行方差分析,数据差异性的分析方法为LSD法,显著差异用P<0.05表示。
2 结果与分析
2.1 胆盐对乳状液中脂肪消化的影響
乳化脂肪在消化的过程中,具有高表面活性的胆盐会替代乳化脂肪表面的乳化剂吸附在脂肪表面,使脂肪酶可以吸附在脂肪表面水解脂肪形成游离脂肪酸,因而胆盐对脂肪消化有明显影响。如图1所示,以消化时间和游离脂肪酸释放量分别为变量和因变量,利用一级动力学方程y-y0=ae-kt对不同模型中不同胆盐浓度下乳状液中脂肪消化的曲线进行拟合,得到拟合曲线的回归系数R2在0.974~0.997范围,表明一级动力学方程y-y0=ae-kt可以较好地描述游离脂肪酸释放随时间的变化。
在乳状液中,脂肪处于乳化的状态,有利于脂肪酶在界面上的吸附,因而在不添加胆盐的情况下乳状液中脂肪也会被脂肪酶消化。但是不添加胆盐时,乳状液中脂肪消化程度不高,游离脂肪酸的释放速率较低且释放总量较低;在0~5 min肠消化过程,乳状液在静态胃肠模型中游离脂肪酸的平均释放速率是动态胃肠模型的1.47倍。但是提高胆盐浓度后,乳状液在动态胃肠模型中前5 min的游离脂肪酸平均释放速率有较大增加,是静态胃肠模型的1.22倍。在0~5 min肠消化过程,添加10 mg/mL 胆盐的乳状液中游离脂肪酸的平均释放速率在静态胃肠和动态胃肠模型消化模型中分别比未添加时提高了0.46、1.62倍,游离脂肪酸总释放量提高了21.6%、32.1%,平均反应速率常数k提高了31.7%、91.2%。游离脂肪酸释放速率和释放量的结果表明,胆盐浓度对乳状液中脂肪消化有较大影响。
从图1还可以看出,合适的胆盐浓度(10 mg/mL)会促进脂肪的消化,继续提高胆盐浓度(从10 mg/mL提高到20 mg/mL)则不利于脂肪的消化。这可能是由于胆盐浓度过高,胆盐会占据过多脂肪的表面,从而不利于脂肪酶的吸附,并限制了脂肪酶与底物的接触。可见,乳化脂肪界面组成对脂肪有较大影响,改变界面组成可能是调控脂肪消化的一个有效手段[7]。
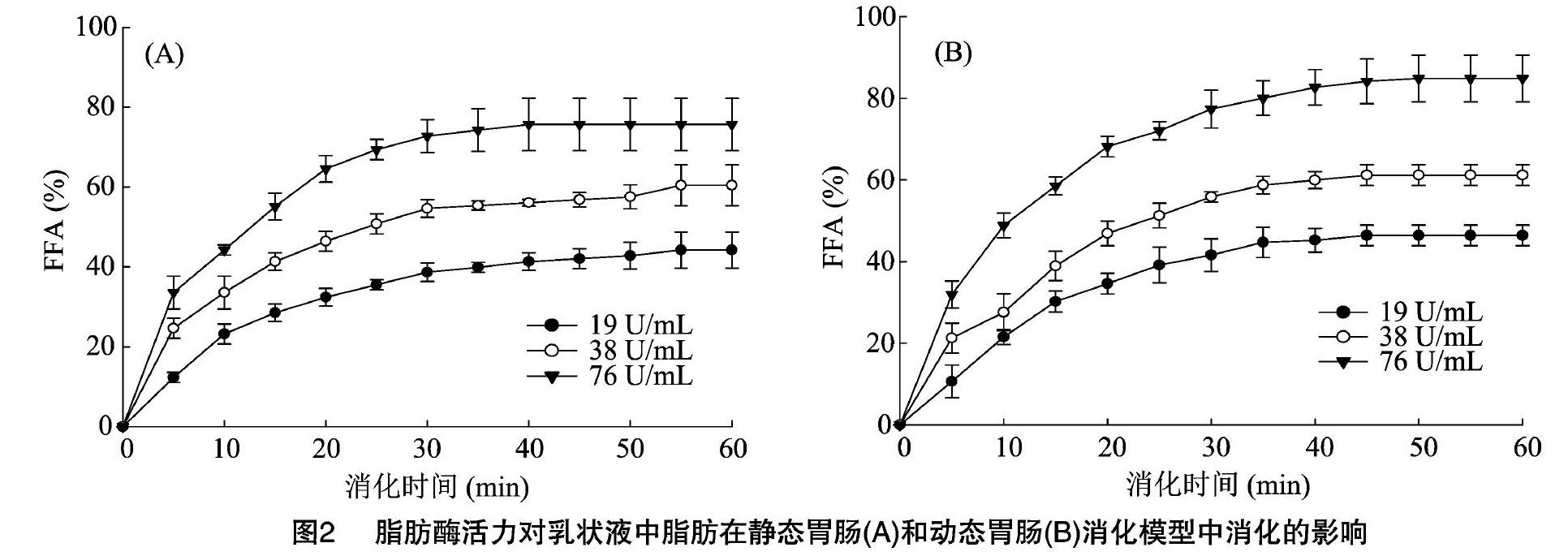
2.2 脂肪酶活性对乳状液中脂肪消化的影响
脂肪经过脂肪酶的消化会形成游离脂肪酸,改变脂肪酶的活性则可能影响脂肪的消化,从而改变游离脂肪酸的释放速率和释放量。如图2所示,提高脂肪酶活性不仅提高了消化前5 min的游离脂肪酸平均释放速率,还可以增加游离脂肪酸的释放量。这可能与增加脂肪酶活性提高了酶底比,增加了酶和底物的接触有关。在静态胃肠消化模型中,脂肪酶活性从19 U/mL提高到38、76 U/mL,乳状液前5min的游离脂肪酸平均释放速率分别提高了1.0、1.7倍,游离脂肪酸的总释放量分别提高了36.6%、70.0%。在动态胃肠消化模型中,脂肪酶活性从19 U/mL提到38、76 U/mL,乳状液前5 min的游离脂肪酸平均释放速率分别提高了1.0、2.0倍,游离脂肪酸的总释放量分别提高了31.8%、81.8%。以消化时间和游离脂肪酸释放量分别为变量和因变量,利用一级动力学方程y-y0=ae-kt对不同模型中不同脂肪酶活性(19、38、76 U/mL)下乳状液中脂肪消化的曲线进行拟合,得到拟合曲线的回归系数R2在0.992~0.998范围,因此模型可以较好地反映数据的变化趋势。乳状液中脂肪在静态胃肠和动态胃肠消化模型消化的平均反应速率常数k分别为0.0 667、0.0 807、0.0 915 min-1和0.0 640、0.0 650、0.0 794 min-1。尽管乳状液中脂肪在动态胃肠消化模型中消化初始速率相比静态胃肠消化模型较高,但是由于其在动态胃肠消化模型中的反应速率低于静态胃肠消化模型,2个模型在最终的游离脂肪酸释放上差异较小。这可能是由于脂肪消化过程中释放出来的单甘油酯吸附在油水界面,影响了脂肪酶与底物的作用,从而降低了后期的反应速率。
从脂肪酶活性变化对游离脂肪酸最终释放量的影响可以看出,相对于改变胆盐浓度,控制脂肪酶的活性是调控脂肪消化更有效的手段。添加脂肪酶活性的抑制剂可能是改变含乳状液食品中脂肪消化的有效手段。
2.3 CaCl2对乳状液中脂肪消化的影响
Ca2+由于可以与游离脂肪酸作用形成溶解度低的脂肪酸盐,这有利于降低油水界面上脂肪水解生成的游离脂肪酸浓度,因此Ca2+的加入对脂肪酸的释放有着很大的影响。如图3所示,由于游离脂肪酸在界面上的吸附不利于脂肪酶的作用,加入一定浓度Ca2+(10、20 mmol/L)提高了乳状液中脂肪消化程度,游离脂肪酸释放速率和释放量都有较大幅度的提高。利用一级动力学方程y-y0=ae-kt对不同模型中不同CaCl2添加浓度下乳状液中脂肪消化的曲线进行拟合,得到拟合曲线的回归系数R2在0.979~0.994范围,模型可以较好地描述数据的变化趋势。在静态胃肠消化模型中,Ca2+浓度为10、20 mmol/L与Ca2+浓度为0时相比,乳状液中游离脂肪酸前5 min的平均释放速率分别提高了1.4、4.0倍,游离脂肪酸的总释放量分别提高了1.0、1.5倍,通过一级动力学方程y-y0=ae-kt拟合曲线得到的平均反应速率常数分别提高了20.0%、58.6%。在动态胃肠消化模型中,Ca2+浓度为10、20 mmol/L与Ca2+浓度为0时相比,乳状液中游离脂肪酸前5 min的平均释放速率分别提高了1.6、4.1倍,游离脂肪酸的总释放量分别提高了1.2、1.5倍,通过一级动力学方程y-y0=ae-kt拟合曲线得到的平均反应速率常数分别提高了44.7%、96.0%。对比不同模型中游离脂肪酸的总释放量,Ca2+浓度为0、5、10、20 mmol/L时动态胃肠消化模型比静态胃肠消化模型分别增加了18.0%、31.3%、28.1%、18.5%。同时,Ca2+浓度为20 mmol/L 时,乳状液中脂肪在动态胃肠消化模型中的释放量达到了95.0%。
2.4 消化过程中乳状液微观结构变化
为了反映乳状液在消化过程中的变化,通过显微镜观察了乳状液在胃肠消化不同时间的微观结构。不同处理过程中,微观结构的变化趋势相同,因此选择了试验中1个代表性的消化样品進行了观察,结果如图4所示。从图4可以看出,在胃消化过程中,随着消化的进行,乳状液的稳定性有一定变化,乳液颗粒直径逐渐增大并聚集。尽管胃消化阶段无脂肪酶的消化,但是胃消化阶段的低酸环境会降低乳状液稳定性,从而影响其在肠消化阶段的消化过程。从胃消化进入肠消化阶段,在脂肪酶、胆盐的作用下,乳状液的颗粒逐渐变大并产生聚合,随着消化的进行,形成形状不规则的聚集体,从表观上表现为消化后期有油滴漂浮在液面上。同时可以看到,在肠消化过程中小颗粒数量增加,这一过程可能是由于脂肪消化后破坏了乳化剂界面,破坏了乳状液的稳定性,从而产生了乳化颗粒的聚合。可见,乳状液的稳定性与乳化脂肪的消化有一定的关联,提高含乳状液的食品中乳液的稳定性可能可以调控其脂肪消化。
3 结论
乳状液消化试验的结果表明,消化条件(脂肪酶和胆盐)以及外源添加的CaCl2对吐温20稳定的大豆油水包油乳状液中脂肪消化有明显影响。乳状液中脂肪的消化程度与脂肪酶浓度升高呈现正相关。在一定浓度范围内,胆盐和Ca2+浓度的提高有利于脂肪的消化。和静态胃肠消化模型相比,动态胃肠模型中脂肪消化的速率和程度都较高。研究表明,调节脂肪酶活性和控制外源CaCl2浓度是调控乳状液中脂肪消化的有效手段。
参考文献:
[1]Guo Q,Ye A Q,Bellissimo N,et al. Modulating fat digestion through food structure design[J]. Progress in Lipid Research,2017,68: 109-118.
[2]Li Y,McClements D J. New mathematical model for interpretingpH-stat digestion profiles: impact of lipid droplet characteristics on in vitro digestibility[J]. Journal of Agricultural and Food Chemistry,2010,58(13): 8085-8092.
[3]Minekus M,Alminger M,Alvito P,et al. A standardised static in vitro digestion method suitable for food—An international consensus[J]. Food & Function,2014,5(6): 1113-1124.
[4]Klinkesorn U,McClements D J. Influence of chitosan on stability and lipase digestibility of lecithin-stabilized tuna oil-in-water emulsions[J]. Food Chemistry,2009,114(4): 1308-1315.
[5]Ye A Q,Cui J,Zhu X Q,et al. Effect of calcium on the kinetics of free fatty acid release during in vitro lipid digestion in model emulsions[J]. Food Chemistry,2013,139(1/2/3/4): 681-688.
[6]刘 运. 超声预处理促进马铃薯蛋白酶解机理及影响其水解物模拟消化的研究[D]. 镇江:江苏大学,2017.
[7]Golding M,Wooster T J. The influence of emulsion structure and stability on lipid digestion[J]. Current Opinion in Colloid & Interface Science,2010,15(1/2): 90-101.

