炎症-肿瘤转化在眼部相关疾病中的研究进展
刘诗博, 吴昊, 洪焦, 刘梦昱, YAO Mawulikplimi Adzavon, 赵鹏翔*
1.北京工业大学生命科学与生物工程学院, 北京 100124;2.徐州市中心医院, 江苏 徐州 221009
慢性炎症-肿瘤转化的过程是癌症相关研究的重点之一,通过挖掘这一过程中的关键分子,进而设计出以其为靶点的药物,有效利用靶向治疗来缓解甚至抑制癌症的发生及恶化。慢性炎症的积累能通过多种途径导致靶器官和不同组织类型的癌症产生[1],并造成肿瘤进展、转移和耐药性的产生[2]。临床研究及流行病学数据显示,慢性幽门螺杆菌胃炎-胃癌、肝炎-肝癌、慢性前列腺炎-前列腺癌和炎症性肠病-肠癌等疾病的发展均表明炎症是肿瘤发生的潜在危险因素[3-4]。其中最为主要的观点是慢性炎症为肿瘤生成提供了有利的微环境。1889年,Paget提出微环境与癌细胞互作可调控肿瘤进展[5]。肿瘤的恶性表型转归受到微环境内成分的调节,如肿瘤相关细胞、可溶性因子、细胞外基质(extracellular matrix,ECM)等,这也成为肿瘤医学的研究热点之一[5]。对于慢性炎症促进肿瘤生成机制的其他观点还有很多,例如:慢性炎症会干扰自噬的启动或终止,从而促进癌症的发展[6];慢性炎症和代偿性细胞增殖的协同作用可能促进部分癌症的发展[7]等。在慢性炎症和癌变等多种病理过程中,DNA损伤反应(DNA damage response,DDR)起关键作用[8]。尽管已有大量关于慢性炎症对癌症发生发展的不同程度促进作用的研究,但针对眼部微环境中炎症-肿瘤转化的综述并不多见。因此,本文将通过对基底细胞癌、眼表鳞状肿瘤、眼附属器MALT淋巴瘤、视网膜母细胞瘤以及腺样囊性癌等眼部肿瘤的致病成因、分子机制等进行综述和讨论,指出在其炎症-肿瘤转化过程中普遍涉及和特异性相关的分子,以期为今后眼部肿瘤治疗的相关研究提供思路。
1 炎症-肿瘤转化及肿瘤恶性转归的调控因素
从微环境组成的角度来看,肿瘤恶性转化及转移主要受到炎症或肿瘤相关的细胞、趋化因子和生长因子等细胞因子以及细胞外基质的影响。
1.1 肿瘤相关细胞
肿瘤干细胞(cancer stem cells,CSCs)能自我复制并分化成多种肿瘤细胞,是肿瘤侵袭能力的标志。缺糖和低氧能使CSCs激活癌细胞的抗凋亡作用[9]。在骨髓炎症环境中,CSCs易通过非肿瘤干细胞的转化获得补充[9]。多种实体瘤病例在分子层面上证实,CSCs微环境成分中的乙醛脱氢酶-1(acetaldehyde dehydrogenase 1,ALDH1)与癌症转移具有正相关关系;三磷酸腺苷结合盒转运体-2(ATP binding cassette transporter G2,ABCG2)也是CSCs的重要标志物之一[10]。另一类与恶性转化相关的细胞群体是肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)。这类细胞的极化作用也和肿瘤转化的各阶段之间存在联系。特定微环境下,促炎性M1和抑炎性M2 2种类型的巨噬细胞彼此之间能产生相互转化。前者能够表达如肿瘤坏死因子等促炎介质,而后者能表达抵抗素样α等分子,在肿瘤进展过程中起到免疫调控作用。通常在肿瘤的起始阶段,TAM会释放大量炎性因子,创造炎性环境,这主要是M1型TAM激活NF-κB通路所产生的生物学功能。当肿瘤向恶性转化时,TAM渗透进入靶组织并为即将到达的肿瘤细胞创造合适的环境。此时,TAM在白细胞介素-4(interleukin4,IL-4)、干扰素调节因子(interferon-regulatory factor,IRFs)等的作用下转化为M2表型,促进肿瘤组织的血管生成、侵袭和转移过程;而肝肿瘤等的进展阶段则稍有不同,此时TAM会转换成M2型巨噬细胞样,下调NF-κB等相关通路[11]。
1.2 细胞因子
炎症产生的持续性抗原刺激能够导致细胞因子过量产生[12-13]。其中,生长因子和趋化因子等能通过刺激血管、淋巴管等的生长,以及趋化肿瘤细胞向这些位点扩散、粘附等机制,促进肿瘤的浸润、转移过程。其中,炎性环境中生长因子对肿瘤进展调控作用显著。研究发现,表皮生长因子(epidermal growth factor,EGF)与其受体(epidermal growth factor receptor,EGFR)结合后,能介导下游DNA合成及有丝分裂等通路[14]。在小细胞肺癌等肿瘤内,EGFR能结合并失活自噬相关蛋白质Beclin1,促进肿瘤发展[14]。EGFR的作用可受到富含亮氨酸重复序列免疫球蛋白样蛋白1(leucine-rich repeats and immunoglobulin-l ike domains 1,LRIG-1)的负调控作用。在肝细胞和肠道中,LRIG-1能抑制干细胞增殖并维持表皮稳态[4]。该分子的上调表达能够抑制肿瘤的恶性转化,对于眼表鳞状肿瘤(ocular surface squamous neoplasia,OSSN)的研究显示,其下调则能促进肿瘤发展,完全去除LRIG-1则会诱导肿瘤细胞去分化[15]。而趋化因子涉及肿瘤远端转移、肿瘤细胞向血管内皮粘附等过程,也可在免疫应答过程中起到保护肿瘤的作用[16]。部分趋化因子形成异源二聚体并受该二聚体调控[17]。CCR7、CXCR4、CXCR5等趋化因子的表达水平受组织学亚型种类调节。它们高表达于套细胞瘤和淋巴细胞白血病中,证明其具有向淋巴结侵袭的作用[17]。
1.3 细胞外基质
ECM在肿瘤细胞的粘附和转移中发挥着重要功能。从结构上看,ECM能够对肿瘤细胞起到支撑作用,形成的基底膜通过机械力产生基质层,促进肿瘤细胞附着。另外,ECM能够形成一种脚手架状结构,该结构中的纤维状ECM蛋白能够承受细胞及其转移过程中产生的机械张力,为细胞生存及转移过程提供结构基础[18]。ECM中含有的钙粘附蛋白还能在肿瘤扩散中介导上皮细胞-间充质转化过程。它们能够选择性使上皮细胞通过细胞间作用力聚集成层,之后在整合素、转化生长因子-β(transforming growth factor β,TGF-β)等的作用下,细胞间连接减弱,上皮细胞出现形态上的改变并具有活动能力,从原位癌中脱离并扩散[18]。此外,肿瘤细胞能够与ECM之间相互作用,通过基质沉积作用来保护肿瘤细胞免受部分趋化因子的诱导而凋亡[19]。
2 眼部炎症-肿瘤转化相关分子机制
眼部炎症向肿瘤转化以及恶化的过程,大多涉及到T细胞、上皮细胞、内皮细胞等的增殖、细胞周期调控、肿瘤转移等过程。生长因子、趋化因子等细胞因子及其受体以及白细胞分化抗原CD31等免疫分子也参与其中[14,20],通过不同通路之间分子互作实现调节功能(图1)。
2.1 细胞因子
炎性环境中的细胞因子(如趋化因子、生长因子等)在眼部肿瘤的恶化、转移过程中起到关键作用。生长因子在眼部肿瘤的研究中涉及较多的是EGF及其受体。它们的结合能激活下游的NF-κB等重要通路,并产生恶性表型和侵袭现象,此情况多在眼附属器黏膜相关淋巴瘤(mucosa associated lymphoma of ocular accessory,OAML)中出现[20]。其他生长因子,如脑源性神经营养因子等还会根据自身的结构和性质,在腺样囊性癌等疾病中调控肿瘤沿神经进行浸润和侵袭[21]。而95%的葡萄膜黑色素瘤患者会因趋化因子CXCR4和CCR7的表达出现肝转移[10]。而CXCR4过表达除了能够调节、促进视网膜母细胞瘤中有丝分裂过程,还能通过血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体-3(vascular endothelial growth factor receptor-3,VEGFR-3)的相互作用,激活下游信号通路,调节血管、淋巴管增生[15,22]。新生的血管和淋巴管可以输送更多的淋巴细胞和免疫因子抑制肿瘤的增殖,但同时也促进了肿瘤向淋巴结的转移[23]。
2.2 其他调控分子
除细胞因子外,其他因子也参与到调控炎症-肿瘤转化这一过程中。
一些信号因子及其受体常常能对肿瘤的发展起到调控作用。肿瘤周围的细胞外基质中,通常含有较高水平的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,这类炎症因子能够趋化VEGFR-3+的单核细胞浸润于病灶组织,使其激活向TAMs转化,并且与肿瘤的进展相关[24]。类似的,人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2/neu)在泪腺癌细胞中表达量也高于正常细胞,恶性肿瘤易因Her2过表达向骨发生转移[20,25]。
其他的一些核酸、酶类分子也会对肿瘤的增殖和转移进行调控。核酸中,视网膜母细胞瘤(retinoblast, Rb)内的长链非编码RNA(long chain non-coding RNA,lncRNA)可通过与细胞内染色质、RNA等结构的特定位点结合,激活/失活细胞周期调控因子等重要分子,从而影响细胞的增殖、转移等过程,起到抑癌/促癌作用[26]。另外,炎性环境中的部分酶类,如金属蛋白酶类等起修饰性作用的蛋白质,可能与异常代谢物的产生有关,它们的水解活性会导致DNA损伤和突变,与眼表鳞状肿瘤等疾病的起始存在关联[27-28];环氧化酶-2(cyclooxygenase-2,COX-2)的异常表达也会导致在基底细胞癌等病灶中的血管内皮细胞异常增殖,进而使血管增生[20,29]。
和正常细胞相比,一些细胞中的标志物能够在眼部肿瘤中出现差异表达。对黏膜相关B淋巴瘤等疾病的分析显示:白细胞分化抗原CD31阳性的血管内皮细胞的分化作用以及常见淋巴管内皮标记分子——淋巴管内皮透明质酸受体-1(lymphatic vessel endothelial hyaluronic acid receptor-1,LYVE-1)所表征的淋巴管增生作用在眼部肿瘤中出现较多[30-31],显示这2个过程与肿瘤发展密不可分。而细胞增殖标志物ki-67作为一种增殖分化抗原,其与整合素共同作用能够维持染色体的结构[32],因此ki-67在肿瘤组织增高可能提示肿瘤的进展可能与染色体结构稳定性相关。
激素分子也对肿瘤的增殖、转移发挥关键的调控作用。雄激素受体(androgen receptor, AR),相比癌旁组织,在泪腺肿瘤的恶性癌症组织中会出现过量表达[33]。而且,雄激素受体的表达也能促进肿瘤细胞的迁移和骨转移能力[34]。此外,HER2、COX-2、ki-67、CD31和LYVE-1等调控分子对细胞增殖、肿瘤迁移、骨转移等过程也起促进作用,随着其过量表达,很可能会造成泪腺肿瘤的恶性转化。
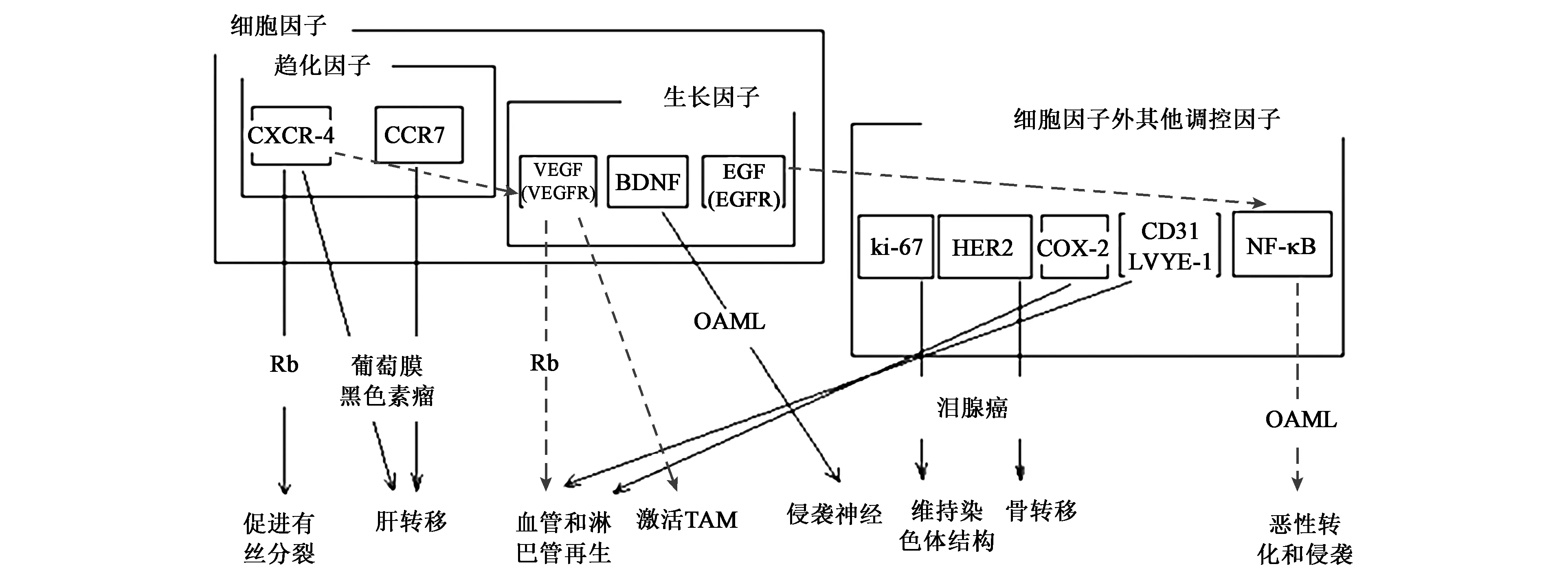
注:部分机制涉及到2个或多个分子之间的上、下游调控作用,将这些分子发挥功能时的上、下游关系用虚线箭头表示。图1 不同眼肿瘤疾病炎症-癌症转化相关分子机制Fig.1 The molecular mechanism of inflammation-carcinoma transformation in ocular tumors mentioned in this paper
3 炎性微环境在不同种类眼部肿瘤中的作用
眼附属器包括眼睑、结膜、泪腺以及眼眶软组织等,这些部位均可被恶性肿瘤累及,比如腺样囊性癌、基底细胞癌、黏膜相关淋巴组织淋巴瘤(mucosa associated lymphoid tissue, MALT)等。另外,眼附属器淋巴瘤是眼附属器淋巴增生疾病的恶性结果,主要出现于60~70岁的老年人,大多数属于非霍奇金B细胞淋巴瘤[33]。下面将对几类特定眼肿瘤的炎症-肿瘤转化机制进行探讨。
3.1 基底细胞癌
基底细胞癌(basal cell carcinoma, BCC)分为纤维性(仅位于下眼睑)和结节状(位于下眼睑和内眦)两类,其类型以及炎性成分与患者年龄无关。这类肿瘤基质中巨噬细胞普遍较多。其中,M1型TAM位于肿瘤肉芽肿性中心及其周围位置,而M2型TAM位于肿瘤基质中,促进了BCC中的血管增生和转移过程。此外,增殖活性标志物ki-67主要表达在位于渗透性边缘的肿瘤细胞;另一方面,COX-2能够通过血管生成促进肿瘤进展[20,29],其在结节状BCC中表达量极少,而在纤维性BCC中主要位于渗透性边缘[35]。由此可推断:渗透性边界的新生血管能帮助纤维化细胞诱发癌症,而产生的炎症环境进一步刺激细胞快速增殖,形成新的肿瘤组织。
Kaiser等[35]得出结论:肿瘤诱导的炎症反应与BCC渗透之间存在关联,但不与巨噬细胞数量以及极化现象相关。炎症细胞可能通过另外的通路促进转移。BCC中巨噬细胞以外的成分与组织的破坏和浸润性生长模式的形成存在相关性。
眼附属器的BCC具有巨噬细胞多、肿瘤类型与患者年龄无关等特点。在其浸润边缘处,肿瘤干细胞快速的增殖以及血管新生的功能为BCC(尤其是纤维化类型BCC)的转移创造了便利条件[35]。
3.2 眼表鳞状肿瘤
眼表鳞状肿瘤(ocular surface squamous neoplasia, OSSN)的具体成瘤机制尚不明确。目前对OSSN高风险因素的假说主要有以下几种:① 长时间紫外线曝光诱导的眼部弹性组织变性和p53基因突变;②人乳头瘤病毒(human papillomavirus, HPV)、人免疫缺陷病毒(human immunodeficiency virus, HIV)等感染因素[4];③EGFR过表达。
其中,EGFR是OSSN研究中的热点领域。EGFR的作用是促进细胞增殖并抑制自噬,而LRIG-1能够抑制EGF与EGFR的结合[28]。在胶质瘤中,LRIG-1的下调激活了表皮生长因子受体/蛋白激酶B/原癌基因c-Myc(EGFR/Akt/c-Myc)通路,使肿瘤侵袭能力增强。而类似的分子机制同样发现于OSSN,其发生发展通常与下调的LRIG-1相关。在表皮生长因子受体-丝裂原活化蛋白激酶-鞘氨醇激酶1(EGFR-MAPK-SPHK1)通路的研究中,LRIG1分子通过抑制鞘氨醇激酶1的表达,降低鞘氨醇1-磷酸(sphingosine 1-phosphate,S1P)的产生,从而抑制下游EGFR活性[15]。因此,LRIG-1在OSSN中出现的下调导致了EGFR表达上调,增强了该信号通路,并且出现ECM重塑,使得肿瘤侵袭能力增强,产生恶性表型。
在几种OSSN标志物中,沉默信息调节因子2相关酶1(silent information regulator 2-related enzyme 1,SIRT-1)能够催化低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)脱酰及其下游的血管增生和转移等[36],可能对肿瘤产生、进展起到促进作用。基质金属蛋白酶(matrix metalloproteinases,MMPs)在鳞状细胞癌中过表达,被推测可能作为分子驱动器促进肿瘤转移和进展[37]。尽管它们在良、恶性组织中均表达,但可作为病理诊断筛查时的重要标志物[37]。
综上所述,OSSN的发生发展很有可能与表皮生长因子信号通路的过量表达相关,且受该通路的抑制剂所抑制。另外,OSSN的转移可能与血管增生有关,但目前并不能通过已有的一些标志物对良性和恶性的该肿瘤做出明确区分。
3.3 眼附属器MALT淋巴瘤
眼附属器中的黏膜相关淋巴瘤(OAML)是一种在胞浆细胞分化及细胞周期、凋亡调控分子改变中特征明显的肿瘤。该肿瘤可能来源于自身失调或慢性炎症[38]。
分子层面上,有文献认为免疫球蛋白分子与MALT疾病存在联系,且相比于其他部位的MALT疾病,前者在OAML中的类型可能具有特异性。免疫球蛋白(immunoglobulins, Ig)是一类具有抗体(Ab)活性或化学结构,与抗体分子相似的球蛋白。血清学和组织学中IgA、M、G、E等的基因/蛋白水平表达量能够提示炎症免疫反应。不同的MALT淋巴瘤能够利用不同的Ig基因进行重排,产生组织特异性抗体,尤其在胃MALT、OAML和唾液腺MALT中得到体现[39]。其中,OAML中对免疫球蛋白重链可变区(immunoglobulin heavy chain variable region,IGHV)中的IGHV4-34和IGHV1-69基因具有偏好性,能够自动进行前者的重排;OAML对IG轻链基因IGKV3-20具有偏好性,且疑似存在对IGHV3-7、IGHV3-23、IGHV3-30这3个基因的偏好性[39]。因此有学者称IGKV3-20可能成为识别OAML的抗原决定物[39]。微生物感染造成的炎症损伤可能与MALT疾病进展有关, Du[39]在其文章中指出,在进行抗生素治疗后,眼附属器和皮肤MALT淋巴瘤出现肿瘤缩小甚至消失。
另一方面,导致OAML中发生慢性炎症的因素之一可能是NF-κB信号通路的持续激活,而该通路的激活与MALT1和TNFAIP3相关。其中,MALT1包含1个N端的死亡结构域、3个免疫球蛋白功能域和1个蛋白质组学活性的Caspase样功能域。眼附属器的免疫球蛋白重链(immunoglobulin heavy chain,IGH)-MALT1受到抗原刺激后会出现在的t(14;18)(q32;q21)易位(7%)[39],造成MALT1的过量表达;MALT1通过募集E3连接酶TRAF6到NF-κB激酶抑制剂IKK上面,通过EGF刺激EGFR通路,使该通路下游的蛋白激酶C分子诱导NF-κB通路激活[20]。TNFAIP3能够使一些激活通路的包括受体相互作用蛋白RIP1/2、泛素连接酶TRAF6和IKKγ在内的调控因子失活。在没有染色体易位的条件下,TNFAIP3的缺失或失活突变在OAML中非常常见[39]。
3.4 视网膜母细胞瘤
视网膜母细胞瘤(Rb)可分为遗传性和非遗传性两种,大部分单侧发病,表现为RB1双等位基因失活[26]。在人视网膜母细胞瘤细胞系WERI-Rb1的研究中,趋化因子CXCR4在肿瘤的进展中起到重要的作用。使用CXCR4的抑制剂,能够显著抑制有丝分裂过程中DNA的合成,造成肿瘤的生存能力降低、细胞密度减小[40]。成视网膜母细胞瘤蛋白(retinoblastoma protein,pRB)在Rb以及多种其他肿瘤中作为一种肿瘤抑制蛋白。pRB能够阻止细胞周期异常导致的细胞过度增殖。而细胞因子中的干扰素IFN-γ能够对pRB蛋白进行去磷酸化作用,从而减少神经干细胞和祖细胞(neural stem and progenitor cells,NSPCs)的增殖,避免NSPCs造成有害的炎性损伤。该过程依赖于STAT1信号通路的激活[41]。由此可见,Rb的发生与炎性成分中的趋化因子等细胞因子具有相关性。
此外,大量长链非编码RNA能调节Rb的发生及发展。Rb细胞与正常细胞相比,表达显著上、下调的lncRNA包括:表达上调的MEG3、CCAT1(结肠癌相关转录因子);表达下调的MIR31HG、BCAR4(乳腺癌抗雌激素耐药基因)[42]。其中有一些lncRNA作用关键:促进细胞增殖和迁移且能降低细胞凋亡的CCAT1[42-43]和促进细胞浸润的HOTAIR[26,44]均是促癌因子,而激活抑癌基因p53表达且能诱导细胞凋亡的MEG3[34,45]以及同样能诱导细胞凋亡抑制细胞迁移的BDNF-AS[46]都是抑癌因子[47]。
3.5 其他类型眼部肿瘤
腺样囊性癌(adenoid cystic carcinoma, ACC)分布于泪腺、上颌窦等部位[48],其肿瘤组织具有筛状和管状相结合的形态特征,晚期可向多器官转移[48]。泪腺ACC发生机制尚不明确。免疫组织化学染色显示,肿瘤干细胞的重要标志物ABCG2在干细胞亚群中阳性最强,而细胞增殖标志物ki-67在此类细胞中显阴性。由此推测此类细胞干性明显但增殖能力低。在干细胞亚群周围,一般呈现ABCG2和ki-67的双阳性[49]。眼周疼痛是ACC的独特临床特征,主要由肿瘤浸润性侵袭神经所导致。类似的结果也表现在唾液腺ACC中,这可能与病灶组织中高表达的脑源性神经营养因子有关[21]。因此,ACC的进展过程可能与长期局部眼眶的生长因子环境有关。
眼附属器孤立性纤维瘤(solitary fibrous tumor, SFT)能够累及眼眶、眼睑、泪腺、泪囊和结膜,其中以眼眶病变最为常见。60% SFT病人出现了眼球突出,40%的病人能意识到出现了肿物。Petrovic等[50]在一项病例报道的研究中发现,患有SFT的孕妇肿瘤体积增加迅速,分析可能与其体内较高的雌激素和孕酮受体水平有关,这也是激素与SFT进展相关的证据之一。另外,作为EGR1转录抑制剂的NGFI-A结合蛋白2(NAB2)与白细胞介素4的转录活化因子STAT6相互融合,会导致一种嵌合型蛋白的产生[50]。体外试验发现这种蛋白能够诱导细胞增殖,是SFT发病的诱因之一[50]。
4 展望
随着人们对慢性炎症和恶性肿瘤的了解日渐深入,慢性炎症向肿瘤的恶性转化成为肿瘤微环境研究中的重要科学问题之一。慢性炎症对于癌症发生、进展、复发、转移及耐药性产生过程中都发挥着重要作用,在肿瘤细胞的炎症微环境中,免疫细胞和炎症因子大部分无法发挥清除肿瘤的功能,反而被肿瘤细胞所利用。
眼部肿瘤在所有肿瘤中所占比例较低,但正因为其较低的发病率,一般情况下容易被忽视,且眼科医生大部分缺乏相关经验,因而易造成疾病拖延。因此,研究眼部肿瘤的发病机理能够填补临床眼肿瘤诊断治疗的重要空白。慢性炎症在眼部周围的浸润通常是诱发恶变产生的重要因素。其中,炎症因子、趋化因子、生长因子、炎症相关细胞、炎症导致的基因突变等是炎症-肿瘤转化的关键因素,也将成为今后扩展对这些疾病认知的突破口。
细胞水平上,今后在眼部炎症-肿瘤转化方向可以着重于肿瘤干细胞及TAM这两类细胞的研究。首先,肿瘤干细胞在低糖、缺氧的炎症环境的滋养下快速增殖,分化成各类肿瘤细胞,使得肿瘤容易复发,难以根治,且容易出现向其他部位的转移。在眼部微环境中,炎性部位即具有以上特征。在研究治疗方法时,这些特性可帮助研究者通过系统性、全局性的代谢微环境重编程改变CSC所适宜的炎性环境来抑制增殖、分化活性,从根本上降低癌症转移、复发、恶性转归的几率。其次,促炎型TAM所释放的炎性因子能够被肿瘤所利用,实现侵袭、转移和恶化;而在一些肿瘤中,抑炎型TAM是一种可下调NF-κB等炎症相关通路活化并抑制肿瘤进展的细胞。抑炎和促炎型TAM之间能相互转化,且该过程与不同肿瘤以及细胞所处环境关系密切,故将来可通过促进内源性分泌或引入外源性Th2相关细胞因子如IL-4和IL-13等,诱导TAM向M2抑炎型极化。
分子水平上,通过靶向调节慢性炎症微环境中一些关键的分子来控制炎症,最终抑制肿瘤的进展。其中,基质金属蛋白酶在肿瘤起始阶段普遍表达,能造成DNA突变,利用MMPs抑制剂BB-94或四环素抗生素Doxycycline诱导其失活能够在肿瘤的起始阶段遏制肿瘤发展;CXCR4、CCR7等炎性环境中常见的趋化因子能帮助包括眼部肿瘤在内的肿瘤向特定器官转移,使用CXCR4抑制剂AMD3100等药物对趋化因子进行抑制能够减缓肿瘤的转移和进展速度;眼部肿瘤所处的微环境比较特殊,多存在腺体、腺泡和毛细血管,因此,在肿瘤转移过程中能够促进血管、淋巴管增生的物质例如环氧化酶-2、血管内皮生长因子及其受体等,可以作为COX-2抑制剂尼美舒利、塞来昔布和VEGF抑制剂康柏西普的治疗靶点以抑制肿瘤转移。这些普遍出现的分子都能作为诊断、治疗研究的突破口,帮助研究者更好的理解炎症-肿瘤转化的全貌。此外,一些广谱性和眼肿瘤特异性的重要标志物,如增殖相关的ki-67和ABCG2、OSSN中存在的SIRT和MMPs、OAML中特有的CD5、Rb中特有的CCAT1等分子。它们能够帮助监测肿瘤所处的发展阶段,都值得深入研究。
无论眼部肿瘤还是其他组织类型的癌症,从代谢角度进行炎症-肿瘤微环境的重编程是未来治疗肿瘤的可能途径之一,但目前可能存在一定问题。在炎症的治疗中,甲氨蝶呤和二甲双胍等治疗以细胞代谢为靶点,而2-脱氧葡萄糖、DCA或DON等以乙二醇分解、丙酮酸氧化和谷氨酰胺代谢为靶点的临床前治疗可保护动物模型免受多种炎症疾病类型的损伤。然而,针对肿瘤代谢微环境药物的治疗效果却并不如人意。体内实验显示,其治疗效果远不如针对免疫、炎症代谢微环境相关药物的作用。分析主要原因在于,在免疫抑制和抗炎的微环境重塑过程中,必须保证对肿瘤细胞的抑制作用,而过低的炎症免疫反应不利于肿瘤细胞的清除和凋亡。因此,判断和区分肿瘤微环境中炎症免疫细胞和肿瘤细胞不同的代谢压力敏感性,从而进行特异性的代谢微调,可能是今后代谢重编程研究的重点问题。

