产油微藻的选育及其培养条件优化
张红兵, 刘荟, 史秀英, 李会宣, 范道春
河北经贸大学生物科学与工程学院, 石家庄 050061
21世纪,随着工业化生产迅猛发展,人类对化石能源的消耗有增无减,据报道,全球约80% 能源消耗来自化石燃料[1]。然而化石能源的不可再生性导致其储存量日趋下降,同时使用中产生的污染,严重威胁着环境和人类健康。我国人口众多,是世界第二大能源消费国,研发可再生清洁能源取代化石燃料迫在眉睫[2,3]。
生物燃料的开发近年来如火如荼,有望成为石油能源的替代品[4],而微藻作为第三代、第四代生物能源有着巨大优势[5],微藻分为原核藻类和真核藻类,多为单细胞生长,易于培养、生长迅速、环境友好,可进行光合作用[6],含油量高,部分微藻油脂可达到50%~90%,占地少,较农作物类油脂、动物油脂培养周期短,部分微藻可在海水、盐碱地、废水等地大规模培养,减少耕地资源的浪费[7]。微藻富含蛋白质、脂质等多种代谢产物,具有抗肿瘤、抗病毒、抗真菌、防止心血管疾病等生理保健功能。利用污水培养产油微藻并耦合生物质能源生产,既可治理水污染、又可缓解能源紧缺,有益于人类摆脱对化石资源的过度依赖[8-9],然而,如何提高微藻的产油效率、降低微藻产业化生产成本等问题亟待解决[10],因此筛选生长状况良好且产油率高的微藻,是微藻产业化进程中的关键技术之一。
我国幅员辽阔,不同区域气候条件差异较大,一方水土养一方“藻”,不同区域的藻类表现出的差异较大。石家庄位于华北平原腹地,四季分明、昼夜温差较大,但夏季日照充足、气温高,常规实验室的藻株并不能适应石家庄室外的培养条件,本试验试图从石家庄本地自然河流采集更加适应本地环境条件的藻种,在室外培养用于废水处理,试验采用富集培养并结合18S rDNA鉴定,筛选生长状况良好、产油率高的微藻,然后利用响应曲面法(RSM)耦合Box-Behnken设计探索微藻最佳异养培养条件,为微藻的产业化生产奠定试验基础。
1 材料与方法
1.1 水样采集
水样分别取自于河北乐源牧业奶牛养殖场废水、河北经贸大学人工湖水、正定县护城河水以及石家庄滹沱河水。
1.2 藻种筛选
采用富集培养法对微藻进行筛选,用纱布(50目纱布,3次折叠)过滤水样以去除大型固体杂质,取10 mL水样加入90 mL BG11[11]培养液,放置于光照培养箱(GZX-400BSH-Ⅲ,上海新苗医疗器械制造有限公司)内培养[温度为(27±1)℃、光照强度8 000 lx、光暗比24 h∶0 h]至15 d左右。待微藻生长至浅绿色时用接种环划线到BG11固体培养基上培养(培养条件不变)至单菌落,选择肥沃的单菌落接种到BG11液体培养基中,对微藻进行进一步扩大培养。抽取适量混合藻液,在显微镜下观察微藻细胞形态,选取形态不同的藻种继续扩大培养3次,供后续试验使用。
1.3 分析方法
藻细胞密度生长曲线的测定:测定微藻培养时间与藻细胞密度生长的关系,在光照培养箱中培养微藻[温度为(27±1)℃、光照强度8 000 lx、光暗比24 h∶0 h],每天定时取样,采用紫外分光光度计(UV-2500型,上海元析仪器有限公司)测定微藻680 nm处的吸光度值,实验重复3次取平均值,记录数据。
生物量的测定:在光照培养箱中培养微藻[温度为(27±1)℃、光照强度8 000 lx、光暗比24 h∶0 h],待微藻生长至稳定期,将离心管在90℃烘箱中烘干至恒重(M0),取混合均匀的微藻液30 mL置于上述烘干的离心管内,离心5 min(4 000 r·min-1,4 ℃),倒掉上清液,保留离心管底部离心产物,并用蒸馏水3次洗涤离心产物,以上离心操作步骤重复3次,随后将离心产物放入冰箱内冷冻(-20℃,2 h),最后将离心产物在干燥箱中烘干(50℃)至重量恒重M1。以上操作步骤实验重复3次,按如下公式计算生物量。
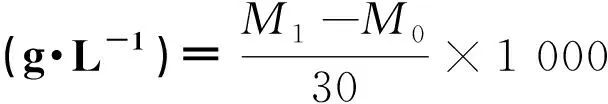
用冷冻干燥法测量藻细胞的油脂含量[12-13]。油脂含量按照以下公式计算得出。

最后计算油脂的产油率,油脂产率的计算公式如下。
式中,m为培养末期藻体生物量,m0为初始藻体生物量,n为培养末期藻体的油脂含量,n0为初始藻体油脂含量,t为培养时间,x为油脂产率。
用Microsoft Excel 2016对数据进行处理,采用SPSS 19.0对数据分析,并采用最小显著差数法(LSD)进一步分析10株微藻生物量之间的差异,P<0.05认为差异具有统计学意义[14]。
1.4 藻种鉴定
形态学鉴定:筛选的10株藻种经分离纯化后,用显微镜进行形态观察。
对微藻进行分子生物学鉴定:采用试剂盒(OMEGA BIO-TEKDNA,安诺伦生物科技有限公司)提取微藻基因组DNA,进行PCR扩增,引物序列为:18S rDNA-F:5′-CAAGTTTCTGCCCTATCGCT-3′;18S rDNA-R:5′-GCTTTCGCAGTAGTTCGTCTT-3′。PCR程序为: 94℃, 5 min; 94℃ 30 s, 55℃ 30 s, 72℃ 60 s,35个循环; 72℃, 7 min。琼脂糖凝胶电泳验证扩增产物,切下目的条带,将其用OMEGA BIO-TEK回收试剂盒回收,进行测序(赛默飞世尔科技公司),在GenBank数据库中,进行Blast序列比对,采用MEGA 7.0.14软件进行多重序列分析,并构建系统发育树。
第六,加强肠道的调理。养鸡就是养肠道,肠道的健康程度决定了鸡群的营养吸收能力和抗病水平的高低,肠道微生态系统的稳定关系重大,根据鸡群的肠道状况,适当的添加微生态制剂,用以调节肠道菌群平衡,提高饲料的消化利用率,减少肠道有害菌的数量,进而达到降低料肉比和料蛋比,减少肠道疾病,提高经济效益的目的。
1.5 异养培养条件的优化
根据单因素基础试验,选择调控微藻培养基中碳源、磷源和镁源浓度成分,其中以葡萄糖作为碳源设置3个浓度梯度分别为15、20、25 g·L-1。以K2HPO4·3H2O作为磷源分别为60、90、120 mg·L-1。以MgSO4·7H2O为镁源设置3个浓度梯度分别为160、200、240 mg·L-1。按照Design-Expert(V8.0.6.1)软件耦合BBD设计三因素三水平实验(表1),按照BBD中成分组合将这3种成分添加到含225 mL培养基锥形瓶中培养(表2),共计17组试验,基础培养基为不添加碳源、磷源和镁源的BG11液体,放置在光照培养箱中培养[温度为(27±1)℃、光照强度8 000 lx、光暗比24 h∶0 h],每天摇瓶培养3次,定时取样测定生物量,采用RSM对培养结果进行分析。
2 结果与分析
2.1 10株微藻筛选结果
由表3所示,本次试验共从4个取样点取样,每处取样点在不同区域取样3次,每次取样500 mL·瓶-1,每次取样2瓶,共计24个样品,对样品进行富集培养后共筛选出10株藻株,形态多为圆形藻。护城河筛选的藻株最多,护城河筛选出4株藻,养殖废水中筛选出2株藻,滹沱河筛选出2株藻,河北经贸大学人工湖筛选出2株藻。

表1 响应曲面分析因素及水平Table 1 Factors and levels of response surface analysis
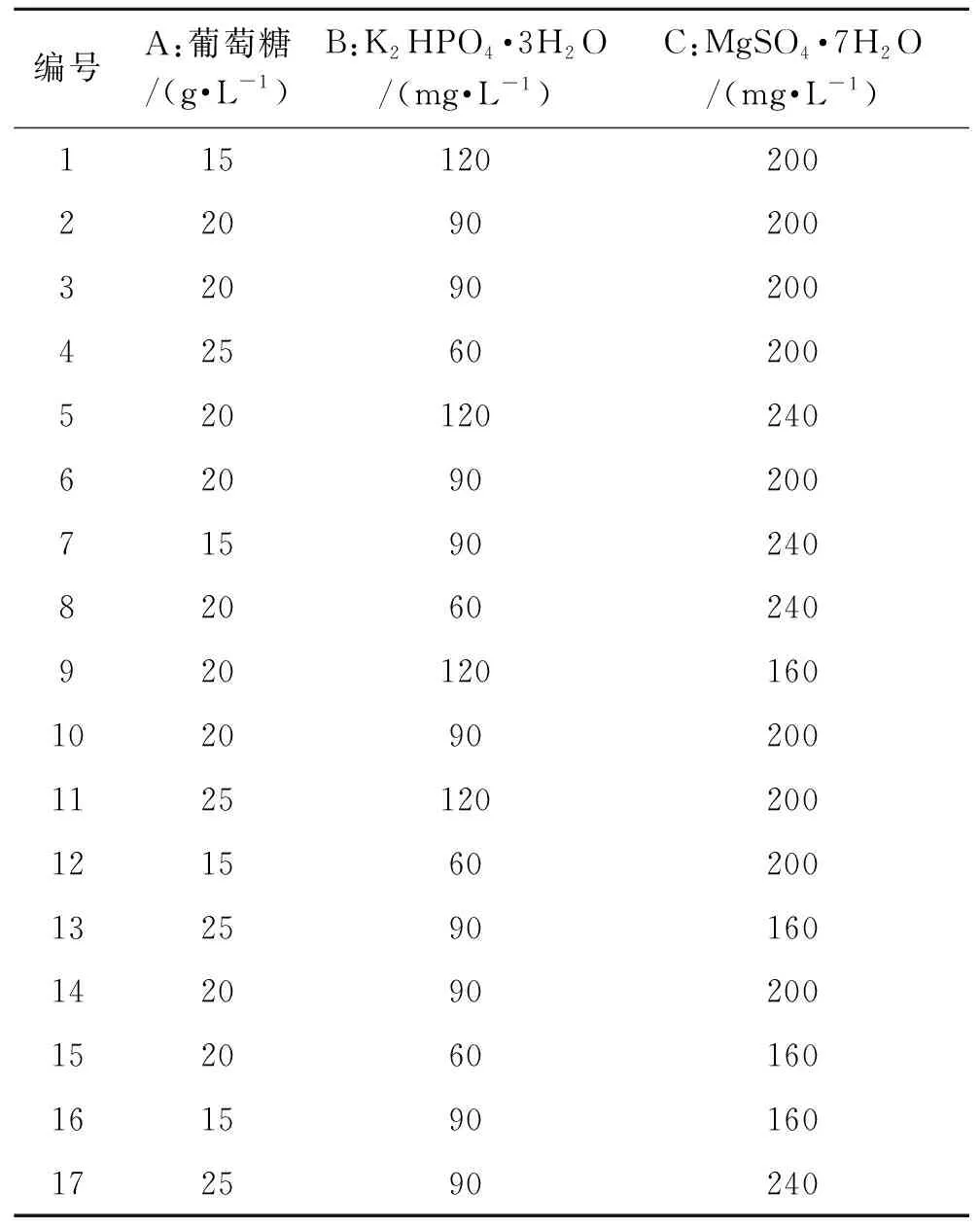
表2 响应曲面试验表Table 2 Response surface test table
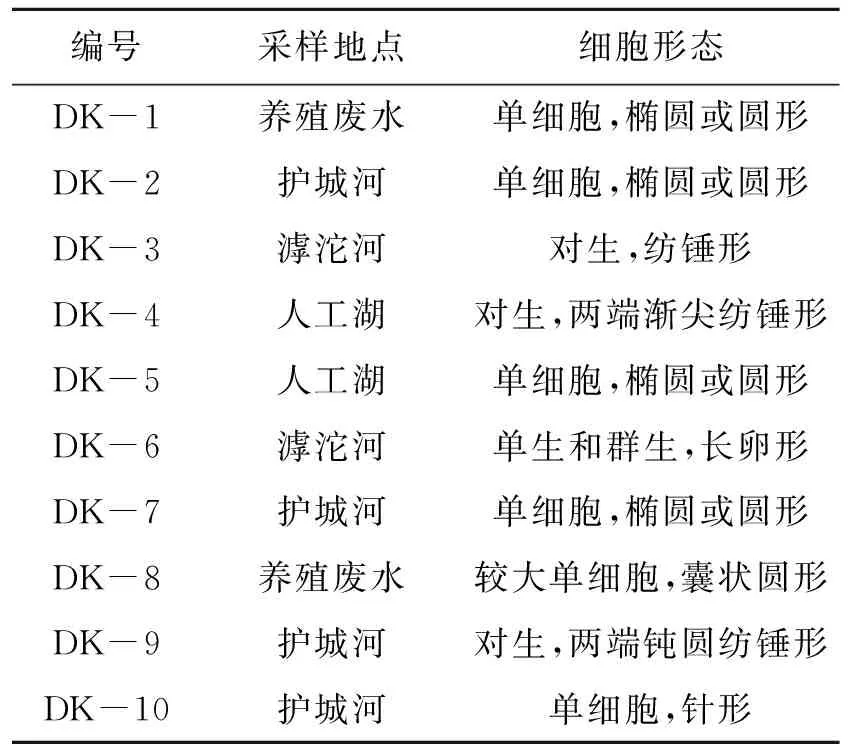
表3 10株微藻细胞形态Table 3 Morphology of 10 microalgae strains
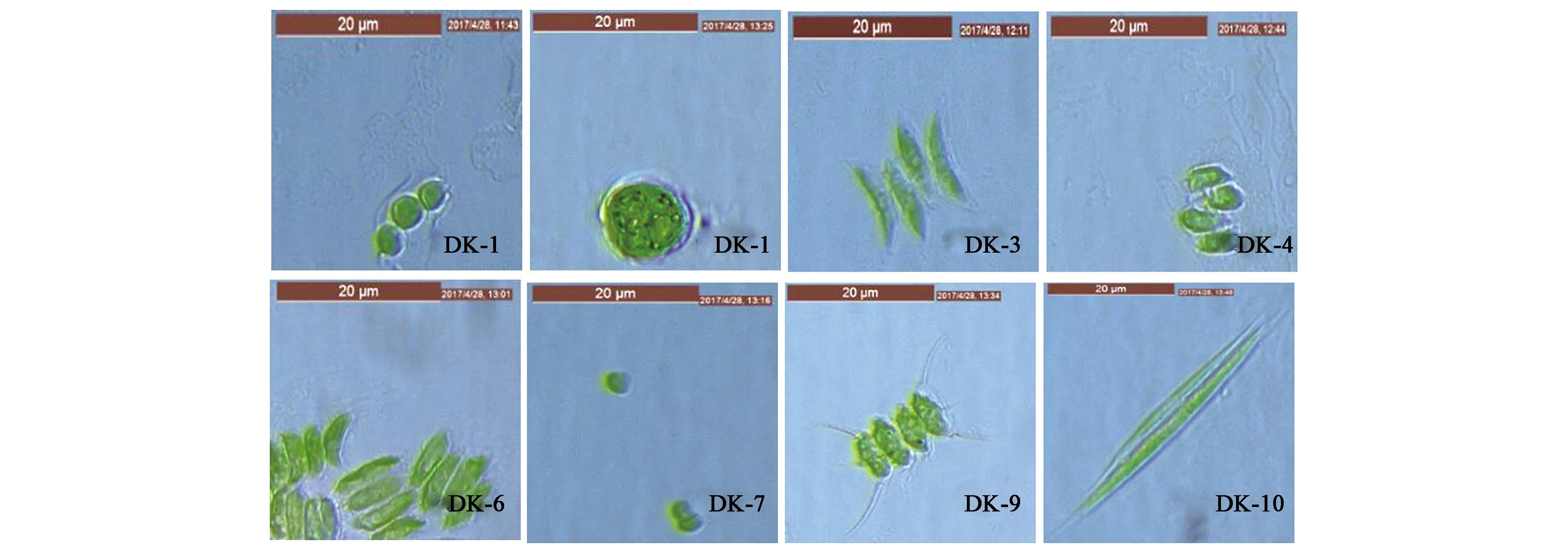
图1 部分微藻照片Fig.1 Pictures of part microalga
图1为部分微藻的显微镜照片,藻体呈绿色,单个微藻细胞长度均在50 μm以内,有单生、对生、丛生藻细胞,形状有球状、纺锤状、针形,藻种DK-1、DK-9肉眼可见鞭毛,藻种的鞭毛可用来繁殖或运动,其中,除藻种DK-9、DK-10不易沉降,其他藻种均易沉降,易沉降的微藻可降低采收成本,同一采样区域可筛选出不同藻种。
2.2 微藻生长曲线(microalgae growth curve)
如图2所示为10株藻的细胞生长密度曲线图,不同藻属的藻细胞生长状况不同,1~9 d时10株微藻进入指数生长期,细胞密度值呈指数快速增长,9 d后进入稳定期,细胞密度增长缓慢,故选择在第10 d收获微藻,其中DK-3、DK-7的差异优势较为明显,细胞密度曲线一直处于其他藻株的上方。
2.3 微藻理化指标的比较
如图3所示,10株微藻的生物量、油脂含量、单位体积生物量产率和油脂产率均有差异,这是由于不同藻株的生理生化特性有差异。其中藻株DK-3是滹沱河中筛选出的藻,生物量(1.86 g·L-1)、总脂含量(14.27%)、单位体积生物量产率(14.27%)、油脂产率(10.23 mg·L-1·d-1)四项指标均为10株微藻中最高,比最低微藻DK-10的生物量(0.67 g·L-1)高出177.6% ,比总脂含量最低DK-8的5.81%高出145.6%。因此藻株DK-3具有较高的研究潜能,而从滹沱河筛选的另一株藻DK-6生物量和总脂含量并未表现出优势,说明从同一区域筛选出的藻的生理指标有所差异。从护城河筛选出的藻DK-7四项指标也表现出优势,生物量为1.43 g·L-1,总脂含量为10.96%,仅次于藻株DK-3。从养殖废水中筛选出的藻株DK-8,生物量为1.15 g·L-1,但其总脂含量为5.81%。研究价值较低,结合图2中的细胞密度,生长后期藻种细胞密度表现的优势趋势与生物量优势趋势并不相同,如藻株DK-3的细胞密度曲线在10株藻中并不占优势,但其生物量生长优势趋势明显。分析原因是由于藻种不同所导致的,不同藻种生长时结团率不同,结团率影响细胞密度的测量。如图3所示,10株微藻的四项基本指标,使用SPASS 19.0软件对10株微藻的油脂产率进行方差分析,并通过LSD多重比较得出,微藻DK-3的油脂产率较高(P<0.05)。因此,微藻DK-3具有较好的产油脂能力,故选微藻DK-3作为后续研究对象。

图2 10株微藻的生长曲线 (n=3)Fig.2 Growth curves of 10 microalgae strains (n=3)

图3 10株微藻的生物量、总脂含量、单位体积生物量产率和油脂产率的比较Fig.3 Comparison of biomass, total lipid content, biomass yield per unit volume, and oil yield rate of >10 microalgae strains
2.4 藻种鉴定结果
提取藻种DK-3总基因组DNA,用特异性引物PCR扩增出目的条带,琼脂糖凝胶电泳检验结果如图4,图中左侧条带为Maker,右侧为目标产物条带,将切下的目的条带用OMEGA BIO-TEK回收试剂盒回收后测序,得到测序结果为707 bp。
如图5所示,将所得序列,提交GenBank中进行Blast序列比对分析,然后利用MEGA7.0构建系统发育树,藻种DK-3与栅藻(ScenedesmusmeyenJQ315792.1)的18S rDNA具有较高的相似性,两者同源性高达99.37%,结合藻种DK-3的形态学分析,藻种DK-3隶属于栅藻属,初步鉴定为栅藻(Scenedesmusmeyen)。
2.5 藻种DK-3异养培养优化结果
采用BBD设计3种培养基不同成分组合,共计17组试验组合,通过RSM对实验结果建立模型,进行方差分析及显著性检验(表4)。结果表明,回归模型极显著(P<0.00 1),失拟不显著,该模型的拟合系数(R2)为0.987 1,说明测量值与预测值具有较高的拟合度;校正决定系数(AdjR2)为0.970 4,表明有97.04%的响应值变化可用该模型来解释,精密度(Adeq Precisior)为24.619>4.0,进一步说明该模型具有良好的拟合度,能够对结果进行分析和预测,该模型具有统计学意义。
为了综合考察葡萄糖,K2HPO4·3H2O和MgSO4·7H2O成分含量及其交互作用对微藻DK-3生长的影响,采用 Design-Expert(V8.0.6.1)软件辅助分析,3D 响应曲面结果如图6所示。
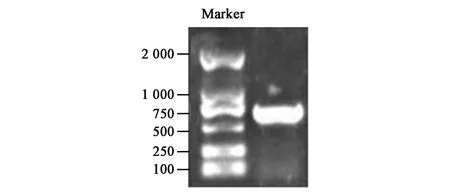
图4 藻种DK-3的18S rDNA序列PCR电泳结果Fig.4 PCR electrophoresis results of 18S rDNA >sequences of algae DK-3
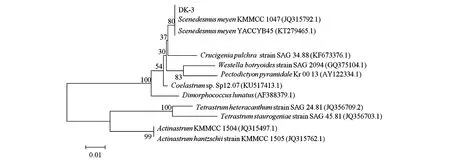
图5 藻种DK-3系统发育树Fig.5 Phylogenetic tree of algae species DK-3
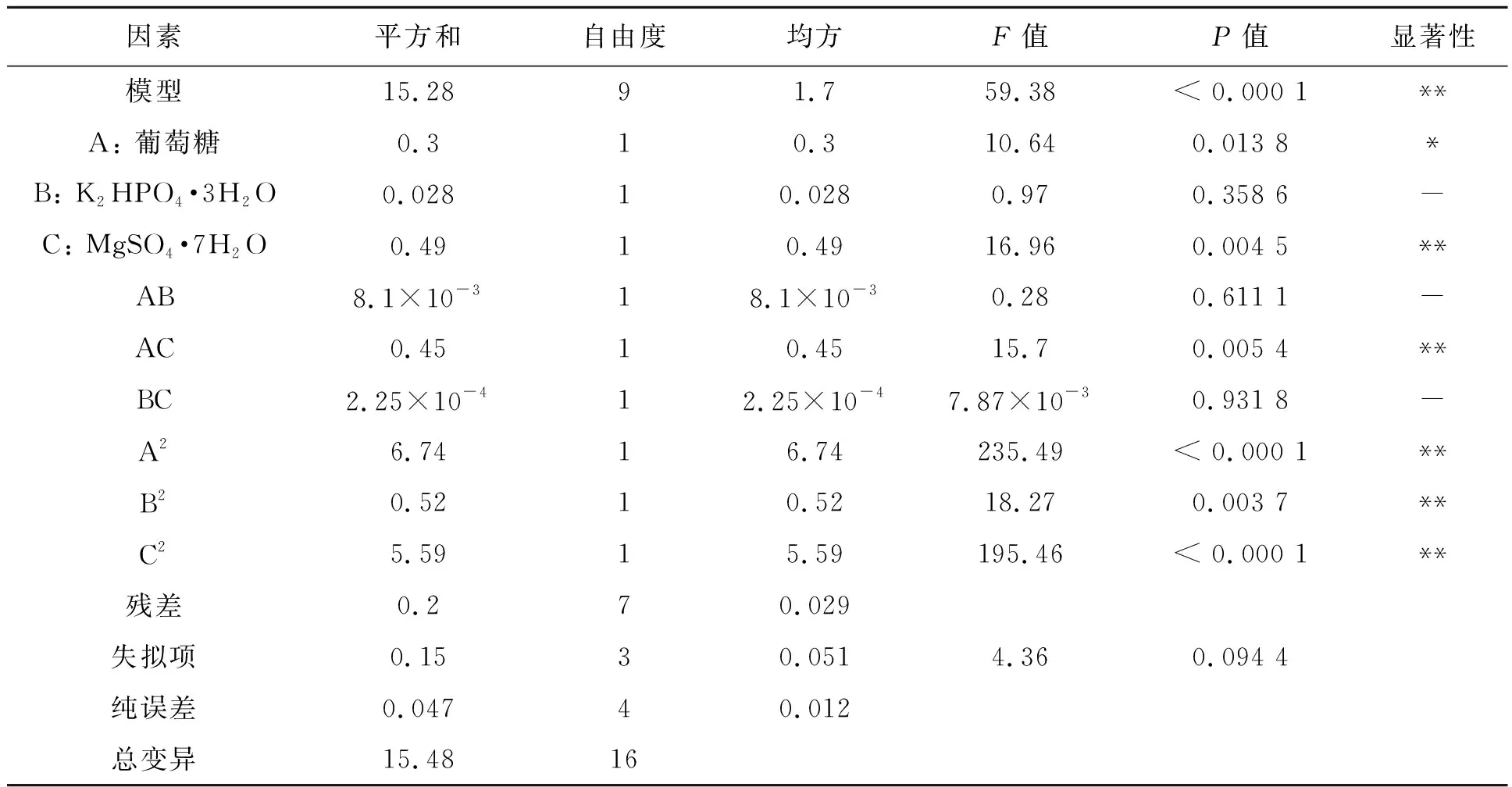
表4 响应面二次模型的方差分析Table 4 ANOVA for response surface quadratic model
注:“**”表示差异在P<0.01水平上有统计学意义;“*”表示差异在P<0.05水平上有统计学意义;“ - ”表示差异没有统计学意义(P>0.05)。
图6展示了以葡萄糖、MgSO4·7H2O、K2HPO4·3H2O三者含量交互作用对微藻生物量的影响,其中图6A显示当葡萄糖的浓度不变时,随着MgSO4·7H2O含量的增加,微藻生物量值先升高后降低,当葡萄糖浓度为20.33 g·L-1,MgSO4·7H2O浓度为203.90 mg·L-1时,两者交互作用最明显,生物量值达到最大5.49 g·L-1。由方差分析结果可知,单因素葡萄糖浓度、MgSO4·7H2O浓度及其两者交互作用对微藻生长量的影响均达到极显著作用(P<0.01)。当葡萄糖浓度在17~23 g·L-1,MgSO4·7H2O浓度在184~220 mg·L-1时对微藻生物量的提高最有效。
图6B展示了葡萄糖浓度、K2HPO4·3H2O浓度对微藻生物量影响的交互作用,显示当葡萄糖浓度不变时,随着K2HPO4·3H2O浓度的增加,微藻生物量总体呈现先升高后降低的趋势,在葡萄糖浓度为20.33 g·L-1、K2HPO4·3H2O浓度为92.58 mg·L-1时微藻生物量达到峰值5.49 g·L-1,随着K2HPO4·3H2O含量继续增加,微藻生物量逐渐减少,有方差分析结果可知,单因素K2HPO4·3H2O浓度(P<0.05),显著水平为0.003 7,但两者的交互作用并未达到显著水平。
图6C展示了K2HPO4·3H2O的浓度水平和MgSO4·7H2O浓度水平对微藻生物量影响的交互作用,显示K2HPO4·3H2O浓度与MgSO4·7H2O浓度交互作用并不明显,同方差分析结果一致。
利用该软件分析得到微藻优化培养条件为:葡萄糖为20.33 g·L-1、K2HPO4·3H2O为92.58 mg·L-1、MgSO4·7H2O为203.90 mg·L-1。为了方便实际操作,将DK-3的异养培养最终条件确定为:葡萄糖为20 g·L-1、K2HPO4·3H2O为90 mg·L-1、MgSO4·7H2O为200 mg·L-1,经验证在此培养条件下,微藻DK-3经240 h培养后,3组平行试验平均生物量为5.47 g·L-1,与模型预测值相差不大,说明模型可行,油脂产量为1.28 g·L-1,比空白对照组藻种生物量3.37 g·L-1提高了62.31%。
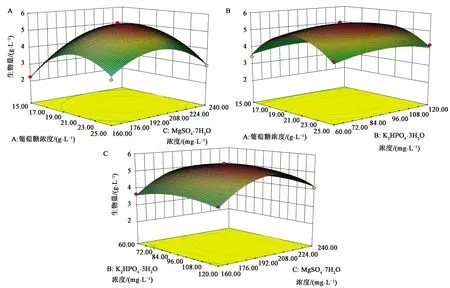
A:葡萄糖与MgSO4·7H2O的交互作用;B:葡萄糖与K2HPO4·3H2O的交互作用;C:MgSO4·7H2O与K2HPO4·3H2O的交互作用。图6 响应面法三维图Fig.6 Three-dimensional diagram of response surface
3 讨论
近几年微藻在废水处理方面的作用逐步引起注意,微藻可利用废水中的化合物生长,如残氮、残磷,同时还可净化水质,减少水体富营养化,微藻可处理的废水种类很多,可处理奶牛场废水、味精厂废水、市政污水等,甚至有使用尿液培养微藻研究[15-17]。本研究从石家庄本地自然水体中采集并筛选微藻藻种,通过优化培养条件,并用SPASS 19.0对数据结果进行方差分析,初步确定了一株产率油脂较高的微藻,并通过响应面分析确定了微藻异养培养的最佳培养基成分,为后续的微藻应用奠定了基础。
将微藻作为制备生物能源的新原料,无疑是克服化石能源短缺及环境污染、实现能源循环利用的新曙光[18-19],由于微藻的种类和培养条件是微藻产油的重要影响因素[20],试验中筛选出的藻种DK-3具有较高的生物量及油脂产率,在自养条件下,其油脂产率(10.23±2.63)mg·L-1和油脂产量240.0~290.9 mg·L-1,是黄秋婷等[21]自养培养收获四尾栅藻(Scenedesmusquadricauda)油脂产率为(187.6 mg·L-1)的1.28~1.53倍,是涂泽敏等[22]自养培养栅藻油脂产量(131.69 mg·L-1)的1.82~2.21倍。
微藻异养培养可以加快其生长速度,短期内获得大量目标产物,但培养基组分对培养特性和油脂产率十分重要。葡萄糖是最常见的有机碳源,需求量高;磷元素是构成微藻细胞结构的重要元素,参与微藻蛋白质、脂肪、碳水化合物等物质的合成[23-24];镁元素是光合作用和呼吸作用过程中的重要酶,如各种磷酸激酶和磷酸变位酶的激活剂,同时也是叶绿素合成的重要成分,还可作为DNA和RNA合成过程的催化剂,对微藻的生长有举足轻重的影响[25]。
MgSO4·7H2O含量对微藻生物量影响最为显著,微藻生物量随着MgSO4·7H2O含量的逐渐增高,呈现先升高后降低趋势,原因可能为MgSO4·7H2O浓度较低时,Mg2+供应不足,抑制了其增殖,而MgSO4·7H2O浓度较高时,Mg2+供应过量,可与培养基中的K+、Al3+等离子产生拮抗作用,同时溶液渗透压也随之升高,反而抑制微藻细胞的生长。葡萄糖含量对微藻细胞生物量的影响仅次于MgSO4·7H2O,微藻生物量随着葡萄糖含量的逐渐增高呈现先升高后降低趋势,当葡萄糖浓度过低时无法为微藻细胞提供足够的有机碳源,抑制微藻细胞生长;当葡萄糖浓度过高时,微藻初始生长过于迅速,在短时间内达到峰值,除葡萄糖以外的营养元素消耗过快,同时导致代谢产物浓度较高,使得微藻细胞数量迅速降低。微藻生物量随着K2HPO4·3H2O含量的逐渐增高呈现先升高后降低趋势,主要原因可能是K2HPO4·3H2O浓度过低时无法满足微藻细胞的生长,K2HPO4·3H2O浓度过高时,高浓度的K+可与培养基中的多种离子产生拮抗作用,同时磷元素的含量过高,导致氮磷失衡,抑制微藻细胞分裂繁殖,生物量降低。因此,选择适宜的葡萄糖、K2HPO4·3H2O、MgSO4·7H2O浓度能够有效提高微藻的生物量。
虽然,微藻异养培养能提高微藻的生物量和生长速率,但以葡萄糖作为碳源培养微藻价格昂贵,寻找价格低廉的碳源十分重要。空气中的CO2可作为备选碳源[26],已有研究将烟囱中的废气作为碳源[15],可大大降低培养成本。同时选择合适的光生物反应器也可进一步提高微藻的生物量及油脂含量[27],本团队后续将进一步展开深入研究。

