二氢槲皮素的研究进展
董潞娜, 曹浩, 张欣宇, 王海胜
中国农业科学院研究生院, 北京 100081
二氢槲皮素(dihydroquercetin,DHQ),别名花旗松素(taxifolin)。它存在于多种植物中,在落叶松中含量较高,特别是花旗松[1]。二氢槲皮素最早由日本学者Fukui从针叶植物Chamaecyparisobtusa叶中提取分离,近年来,在很多水果中也发现了二氢槲皮素的存在,如葡萄、橘子和西柚等[2]。二氢槲皮素结构的特殊性,决定了其具有较强的抗氧化特性[3-6]、调节酶活等[7-8]多种生物活性。因此,二氢槲皮素在食品、药品、化妆品等领域均有广泛的应用,市场需求量巨大。但是,目前二氢槲皮素的工业化生产仍然依赖于传统的植物提取,原料稀缺、提取难度大、产率较低等缺点阻碍了其工业化应用的推进。本文主要综述了二氢槲皮素的基本性质和生物合成途径、生物学活性和生产工艺,并对二氢槲皮素以后的研究方向进行了展望,以期为二氢槲皮素的生物合成研究提供理论参考。
1 二氢槲皮素的化学结构与性质
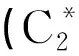
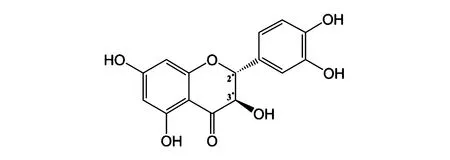
图1 二氢槲皮素分子式Fig.1 Molecular formula of dihydroquercetin
2 二氢槲皮素的生物合成途径及关键基因
2.1 二氢槲皮素的生物合成途径
目前,二氢槲皮素的生物合成过程已基本探明,涉及到苯丙烷和类黄酮两个阶段(图2)。在苯丙烷途径中,在苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)的催化下,来源于莽草酸途径的苯丙氨酸脱去1个氨基生成肉桂酸;接着肉桂酸经过肉桂酸羟化酶(cinnamate 4-hydroxylase,C4H)的催化作用获得1个羟基,生成对香豆酸;在4-香豆酰辅酶A连接酶(coumaryl 4-ligase,4CL)的催化下,对香豆酸发生硫酯化反应,生成对香豆酰辅酶A。1分子的对香豆酰辅酶A和3分子的丙二酰辅酶A在查耳酮合成酶(chalcone synthase,CHS)的催化下进行缩合,生成柚皮素查尔酮,它是类黄酮物质合成的起点。然后柚皮素查尔酮在查尔酮异构酶(chalcone Isomerase,CHI)的催化下生成柚皮素。类黄酮途径中,柚皮素在黄烷酮3-羟化酶(flavanone 3-hydroxylase,F3H)的催化下生成二氢黄酮醇类物质。二氢槲皮素可由二氢黄酮醇经类黄烷酮3-羟化酶(flavanone 3′-hydroxylase,F3′H)催化生成[10-14]。同时,该过程也可先经F3′H催化,再经F3H催化。在类黄酮途径中涉及到2个基因F3H和F3′H,它们是二氢槲皮素生物合成途径中的关键基因。
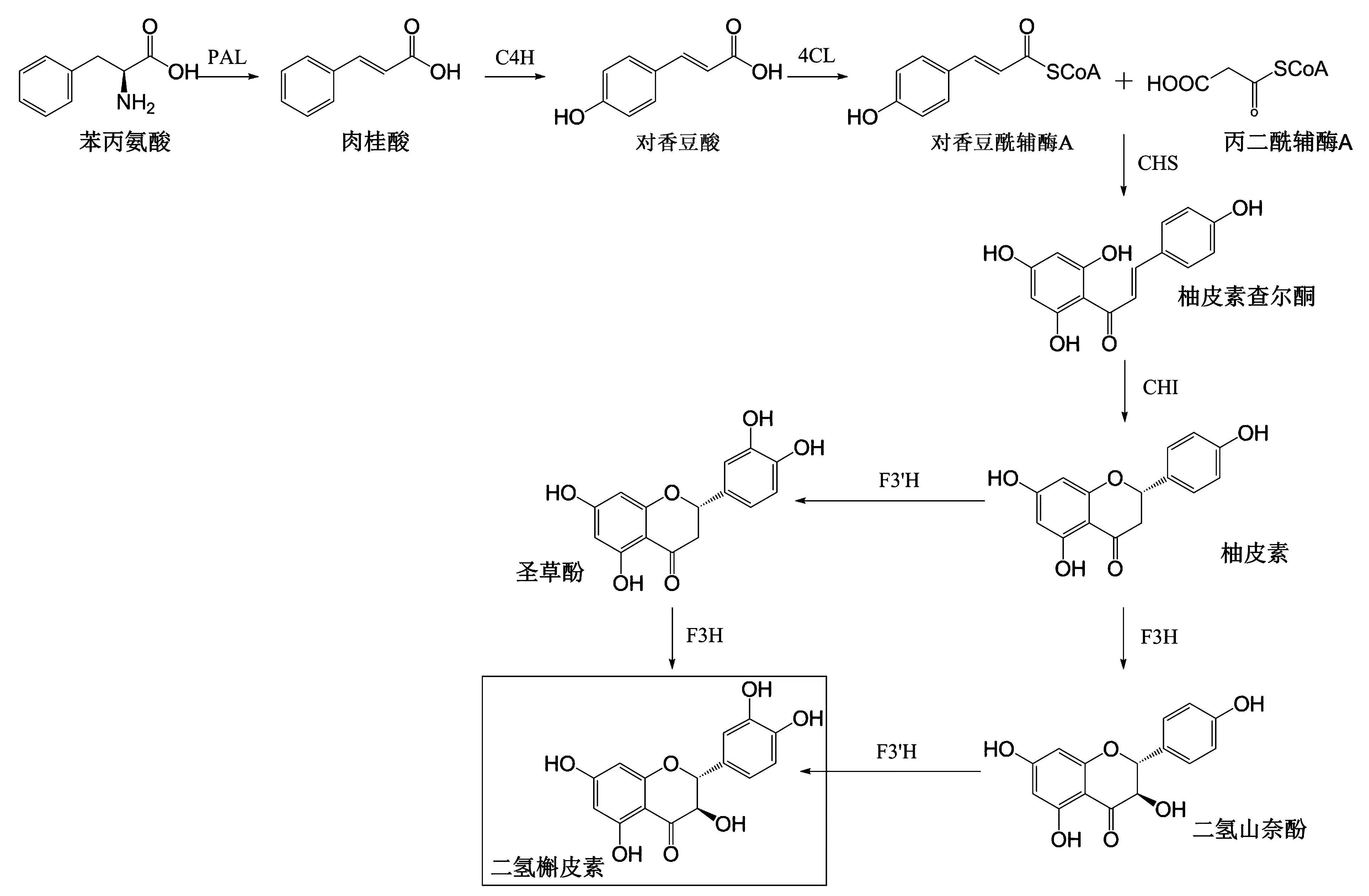
图2 二氢槲皮素的生物合成途径Fig.2 Biosynthesis of dihydroquercetin
2.2 F3H基因
F3H基因的cDNA最早于1991年从金鱼草(Antirrhinummajus)中分离克隆得到[15]。到目前为止,其已在多种植物中被克隆,如枣(ZiziphusjujubaMill.)、紫花苜蓿(Medicagosativa)、拟南芥(Arabidopsisthaliana)、茶树(Camelliasinensis)等[16-19]。F3H基因以单拷贝形式存在[20],在进化上十分保守[21-22]。F3H的作用底物是柚皮素和圣草酚,它调控着黄酮类物质与花青素苷的合成,是黄酮类化合物代谢途径中的关键酶之一[23]。经过对来自矮牵牛的F3H研究表明,F3H是一种单体蛋白,分子量约为42 kD,该蛋白中Ser290、His220、Arg222和His278等氨基酸残基能够较为明显地对酶活性产生影响[24]。它主要催化柚皮素C3位的羟基化,生成二氢山奈酚(dhiydorkaempeforl,DHK),催化过程需要2-酮戊二酸、分子氧、铁和抗坏血酸的参与。此外,研究表明,在不同植物或组织中,F3H具有底物特异性[25]。
2.3 F3′H基因
F3′H基因最早由Brugliera等从矮牵牛(Petuniahybrida)中分离得到,经鉴定属于细胞色素P450亚家族[26-27]。此后,相继在拟南芥(Arabidopsisthaliana)、矢车菊(Centaureacyanus)、金鱼草(Antirrhinummajus)、紫茎泽兰(Eupatoriumadenophorum)、大豆(Glycinemax)、玉米(Zeamays)、葡萄(Vitisvinifera)、苹果(Malusdomestica)等多种植物中克隆得到了F3′H基因[13,28-31]。不同植物F3′H基因的cDNA系列的相似性为69.5%[32]。F3′H可以催化底物为柚皮素(naringenin)和DHK的3′位置发生羟基化反应,分别生成花青素和原花青素生物合成所需的重要中间产物圣草酚(eriodictyol)和DHQ[33]。而花青素和原花青素可以保护植物细胞免受紫外线照射造成的伤害[34]。将多种植物F3′H蛋白的氨基酸序列比对之后发现,F3′H存在于多种植物中高度保守的细胞色素P450结构域“LPPGP”,它可以使F3′H稳定锚定在微粒体膜上[35]。
3 二氢槲皮素的生物学活性
3.1 二氢槲皮素对肝脏细胞的影响
肝脏是人体内的重要器官,它以代谢功能为主,并在身体内起着去氧化、储存肝糖原以及合成分泌性蛋白质等作用。肝脏健康对于维持人体健康至关重要。国内外大量的研究表明,DHQ对肝脏具有较好的保护作用,对肝脏疾病的治疗有着巨大的潜力[36-40],其作用机制包括:①激活或抑制相关酶的活性;②调节相关转录因子的表达;③诱导细胞自噬等。
DHQ可以通过调节酶活和减少活性氧(reactive oxygen species,ROS)的积累来改善机体氧化和血糖过高的现象。研究发现,DHQ以剂量依赖型的方式抑制对乙酰氨基酚(acetaminophen,APAP)诱导肝细胞坏死,并抑制乳酸脱氢酶(lactate dehydrogenase,LDH)的释放,从而调节细胞外信号末端激酶(extracellular signal-terminal kinase,ERK-JNK)的应激反应。此外,DHQ还能够减少ROS的积累、减轻线粒体的功能障碍等[36]。Ding等[37]的研究表明在高脂饮食/链脲佐菌素诱导的糖尿病肾病(diabetic nephropathy,DN)大鼠中,添加剂量为100 mg·kg-1·d-1的DHQ可以显著减弱尿微量白蛋白的排泄并稳定血糖水平和脂质代谢,减轻肾组织的病理学损伤;在体外研究中,DHQ可以显著抑制细胞增殖和过量的ROS生成,并减少核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体的激活和肾脏中肾纤维化相关蛋白的表达。
同时,DHQ对酒精性脂肪肝变性及其伴有的炎症也有一定的抑制作用[38]。Zhang等[39]研究发现DHQ可以通过激活LKB1基因的表达增强腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)磷酸化来调节胆固醇调节元件结合蛋白SREBP1和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的表达;DHQ还可以上调SIRT1(负责去乙酰化)的表达,下调P2X7R(负责促炎因子的合成与释放)和NLRP3等转录因子的表达。综上所述,DHQ可以通过调节相关转录因子的表达从而起到抑制脂肪生成和保肝的功效,提示DHQ对酒精性肝脂肪变性具有一定的治疗潜力。
DHQ还可以在调节酶活的同时,介导细胞自噬。Chen等[40]利用刀豆球蛋白A(concanavalin A,Con A)诱导小鼠免疫性肝损伤,发现DHQ给药显著降低了血清丙氨酸转氨酶和天冬氨酸转氨酶水平,并提高了Con A处理小鼠的存活率,证明了DHQ可起到保肝作用;同时,研究了DHQ对刀豆球蛋白Con A诱导的小鼠肝损伤的免疫调节作用,结果表明,DHQ可以通过抑制Caspase-3、Caspase-7和Caspase-8(Caspase家族是一类与细胞凋亡有关的蛋白)的活化来保护HepG2细胞免受TNF-α/ActD诱导的细胞凋亡。
3.2 二氢槲皮素对心肌细胞的影响
DHQ还具有降低血压、保护心肌缺血再灌注损伤和抑制心肌肥厚等作用。王秋红等[41]研究发现DHQ能改善大鼠心电图J点的位移,显著降低心肌缺血大鼠血清中肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、乳酸盐脱氢酶(lactate dehydrogenase,LDH)的含量,提高心肌组织匀浆中超氧化物歧化酶(superoxide dismutase,SOD)的活力,降低心肌组织匀浆中脂质过氧化终产物丙二醛的含量,从而有效抑制异丙肾上腺素(isoprenaline,ISO)导致的心肌组织缺血,保护心肌细胞免受损伤,进而起到治疗冠心病的作用。
而大鼠离体心脏缺血/再灌注损伤的抗氧化实验结果表明,DHQ对离体大鼠缺血/再灌注损伤具有明显的保护作用,此保护作用可能与DHQ可以减少氧自由基产生、提高氧自由基清除、降低脂质过氧化损伤有关[42]。王知斌等[43]同样发现二氢槲皮素对H2O2诱导的H9c2心肌细胞的损伤具有保护作用。其作用机制可能与其能够提高细胞内抗氧化酶活性、增强细胞稳定性有关。
3.3 二氢槲皮素对淋巴细胞的影响
淋巴细胞在人机体免疫反应中具有关键作用,而DHQ可以特异地抑制白血病淋巴病细胞的增殖,从而在一定程度上保护人的免疫系统。Devi和Das[44]研究了多种天然植物中的黄酮类活性物质对人类普通淋巴白血病细胞系MoIt-4及其组织分化的成人淋巴细胞系IM-9的生长影响。其中,当DHQ的浓度为10~50 μmol·L-1时,普通淋巴细胞中白介素-2(interleukin-2,IL-2)的分泌受到抑制,MoIt-4细胞中的IL-2水平升高,对IM-9细胞没有影响。而IL-2分泌水平与MoIt-4细胞的生长抑制率有直接关系,故这一研究可能成为日后将DHQ等多种天然黄酮类物质开发为治疗急性淋巴白血病药物的依据之一。
3.4 二氢槲皮素的抗炎抗氧化作用
由于DHQ结构的特殊性,其抗炎、抗过敏、止痒作用也得到了广泛研究[45-46]。DHQ能显著对抗二甲苯所致的小鼠耳肿胀,缓解二硝基氯苯诱导的小鼠过敏反应,并且能明显减少4-氨基吡啶诱导的瘙痒反应的舔体次数[40]。Borovskaya等[46]研究了DHQ对大鼠前列腺慢性非细菌性炎症模型的作用。发现施用DHQ之后,大鼠前列腺中结缔组织的面积减少至初始水平,这证明了该氧化剂的抗纤维化性质。此外,DHQ还可以阻止腺泡上皮的萎缩,如研究发现DHQ的抗氧化能力对神经细胞有保护作用,可以有效防治阿尔兹海默氏症或帕金森氏病[47];通过动物实验也证明了DHQ的抗氧化能力使其具有抗心肌坏死的能力[48]。
3.5 二氢槲皮素的抗病毒作用
DHQ还被发现对病毒也有一定的抵抗性。DHQ对由柯萨奇病毒B4(Coxsackie virus B4,CVB4)引起的白色小鼠胰腺炎的影响实验表明,DHQ的使用会导致胰腺组织中病毒滴度的剂量依赖性降低[49]。形态学上,与安慰剂治疗的小鼠相比,经过DHQ处理的小鼠的胰腺组织表现出较少的炎性细胞浸润并且没有组织破坏的迹象;经过利巴韦林和DHQ处理的小鼠产生较少的胰腺炎症病灶,并且这些病灶包含的浸润细胞少于安慰剂治疗的小鼠[49]。此外,DHQ的使用还可导致胰腺炎过程中受损的胰腺组织的抗氧化活性的恢复[49]。研究结果表明了DHQ的高抗病毒活性及其在治疗复杂病毒性胰腺炎中的潜力。
3.6 二氢槲皮素对多种细胞内酶的影响
DHQ能够激活或抑制多种酶的酶活,从而产生不同的生理学效应。研究发现,DHQ可以作为α-淀粉酶的新型抑制剂[7]。利用不同浓度的DHQ处理后,测定α-淀粉酶的酶活,该化合物的半抑制浓度(inhibitory concentration,IC50)接近9 mmol·L-1,证明了它具有竞争性抑制的动力学机制;其抑制常数为(2.25±0.22) mmol·L-1,表明DHQ对酶的高亲和力[7]。因此,DHQ对研究开发治疗糖尿病的新药具有重要意义。
此外,不同来源的DHQ对同一种酶的作用也会有所不同。付警辉等[8]研究了长白落叶松DHQ对酪氨酸酶的抑制作用,并与兴安落叶松DHQ进行了对比。结果表明,质量浓度在0.001~0.01 g·L-1时,长白落叶松DHQ对酪氨酸酶的抑制作用高于兴安落叶松DHQ。长白落叶松DHQ低质量浓度时,纯度越高,对酪氨酸酶的抑制作用越强;高质量浓度时,纯度越高,抑制作用越弱。而且DHQ对酪氨酸酶表现为竞争性抑制,抑制常数KI为0.017。
3.7 二氢槲皮素的其他活性
除了以上活性,DHQ对脑部疾病也有一定的改善作用。Plotnikov等[50]研究发现DHQ可通过改善大鼠大脑皮层的微循环超微结构从而改善脑部微循环,经过DHQ处理的自发性高血压(spontaneous hypertension,SHR)大鼠视皮层局部的脑血流量显著高于未接受DHQ处理的大鼠,且接近京都种大鼠(Wistar-Kyoto,正常对照)的值。其原因可能是DHQ在动脉高血压形成期间改善了SHR大鼠大脑皮层的微血管化。此外,DHQ还具有肠道保护作用,还可以通过促进骨代谢相关蛋白的表达影响骨代谢等[51]。
4 二氢槲皮素的生产工艺
虽然DHQ的生物学活性多样,应用广泛,但目前其产量仍较低,生产方式还主要依赖于植物提取,包括有机试剂萃取、乙醇回流、超声法、微波提取等方法,提取率较低且不环保。此外,还有采用化学试剂进行人工合成等,但此种方法合成的产物纯度较低且原料成本较高。随着国际、国内市场对于黄酮类物质需求量的快速增长,迫切地需要研发一种来源限制少、生产成本低、安全性高和污染排放低的方法进行生产,而微生物合成法或许可以成为解决该问题的关键方法。
4.1 植物提取法
由于DHQ主要以游离状态存在于落叶松中,且含量高达7%,所以植物提取时主要选取落叶松为原料。在植物提取早期,主要采用溶剂提取法将DHQ从植物中提取出来。金建忠[52]以落叶松为原料,用80 ℃的沸水进行提取,再进一步将提取液沉淀之后用有机溶剂进行萃取、重结晶,最终的提取率达到0.29%。而刘妍和王遂[53]分别用水、丙酮-水作为提取溶剂从落叶松中提取DHQ,通过L9(34)正交实验优化了最佳提取条件,结果显示以丙酮-水为提取剂的提取量高于以沸水作为提取剂的提取量。此外,吸附剂的加入也可提高提取率。如以落叶松木屑为原料,以90 ℃沸水为溶剂、聚酰胺为吸附剂提取DHQ,在此条件下DHQ的提取率为0.814%[54]。
后期出现了回流提取法、超声-微波法和酶诱导法等多种提取方法。韩俊凤和贾林艳[55]改进了传统水热提取法,采用微波辅助预处理来提取落叶松中的DHQ,平均提取率为0.981%。与传统的水热提取法比较,微波辅助提取效率提高了22.17%。同时,也有诸多研究表明,采用超声辅助提取法可以不同程度地提高DHQ的提取率[56-58]。苏丹等[59]对热水回流提取法、乙醇回流提取法、微波提取法和乙醇超声辅助提取法进行了比较,热水回流提取和乙醇回流提取所用时间较长,120 min其提取率分别为0.17%和0.20%;微波和乙醇超声提取时间较短,30 min时提取率分别为0.21%和0.22%,其提取率较前2种方法稍有提高。此外,Wang等[60]采用酶诱导法,使用因子设计和中心复合设计方法对兴安落叶松木屑中DHQ的提取进行优化。最优条件为0.5 mg·mL-1纤维素酶和果胶酶0.5 mg·mL-1,在优化条件下DHQ的得率分别增加到(1.06±0.08)~(1.35±0.04) mg·g-1。
可以看出,随着提取工艺的不断改进,不再单纯以沸水作为提取试剂,且提取量有所提高。植物落叶松的提取工艺的提取率一般在1%~2%,纯度在95%以上,可操作性也相对较强,但是这种工艺对植物资源和各种试剂的浪费较多,且存在不环保的缺点。
4.2 化学合成法
为了降低对植物资源的依赖,拓展DHQ的来源,各种化学合成的方法也被开发出来[61],但在其研发过程中也面临着诸多问题。孙淑香[62]以甲基氯甲醚为原料采用AFO(algar-flynn-olyamada)反应法合成了DHQ,其回收率约为20%,但是甲基氯甲醚毒性较大,已有资料显示接触其蒸汽后催患肺癌的概率很高,因此,有学者正在寻找其他酚羟基保护剂做替代品。也有研究人员采用各种化学试剂(如过钌酸四丙胺盐、AD-mix-α等)利用光延反应法合成DHQ,回收率约为30%[63],但这些试剂在我国国内市场并不常见,若不解决这些试剂的获取途径,则该工艺不具备在国内工业化的价值。胡昆等[64]将2,4,6-三羟基苯乙酮与3,4-二羟基苯甲醛进行甲氧甲氧基保护羟基、羟醛缩合、环氧化及脱保护关环反应合成了DHQ,但此合成方法的纯度并不高。此外,也可将其他天然产物作为原料,如可以将儿茶素作为原料利用半合成法制备DHQ,摩尔回收率约为5%[65],但需要注意的是,儿茶素的市场价格约为1 000元·kg-1,可以计算得出,该工艺生产二氢懈皮素的成本在20 000元·kg-1左右,远超过提取法的成本。
4.3 生物合成法
目前基于生物合成法的研究仍处于实验室阶段,尚未进行大规模生产。Leonard等[66]对大肠杆菌进行代谢工程改造,在大肠杆菌内异源表达多种黄酮代谢相关的酶类,当使用黄烷酮为前体分子时,从工程菌株中生物合成了B环三羟基黄酮醇杨梅素,并少量检测到多种类黄酮物质的存在。也有研究表明,可将茶树类黄酮3′-羟基化酶(F3′H)基因应用于圣草酚、二氢槲皮素和槲皮素的生物合成[67-68]。
而本实验室基于二氢槲皮素的生物合成途径,主要对由柚皮素向二氢槲皮素合成的方向进行了研究,筛选了3种不同植物来源(大豆、茶树、银杏)的F3H基因,并将其在大肠杆菌和酿酒酵母中进行了异源表达,现已证实均有活性且表达量较高(未发表数据)。综上,相较于化学合成法来说,生物合成法更为环保,研究潜力较大。
5 展望
二氢槲皮素作为一种重要的黄酮类化合物,普遍存在于多种植物中,由于其在抗炎、抗病毒、抗氧化等方面的突出作用,其药理活性正被逐步探究并被广泛应用于保健品、药品、食品等领域。2018年3月21日,欧盟委员会发布了2017/461号法规,此项法规正式授权了二氢槲皮素提取物可以作为新的食品成分进入欧盟市场。此外,二氢槲皮素可用于治疗脑梗及其后遗症、脑血栓、心脏冠状动脉等疾病,应用于调节脂代谢、抗脂质过氧化、抗病毒、抗肿瘤等医学领域,均具有较大的开发潜力。
然而,二氢槲皮素在研究过程中仍存在以下问题。①对于二氢槲皮素应用过程中的毒副作用研究甚少,该物质应用于临床治疗仍需要大量的研究来确保其安全性。②由于二氢槲皮素水溶性较差,传统的提取工艺复杂且效率低等一些生产工艺问题,尚未实现大规模自动化生产,这种情况使得目前二氢槲皮素单价较高,在各领域应用中的利用度很低。当下,代谢工程、合成生物学快速发展,而二氢槲皮素的基因工程菌株构建的研究报道鲜有报道,因此构建良好的基因工程菌将是解决其大规模应用的重要途径。

