钙循环捕集CO2后CaO的水合/脱水热化学储热性能
孙超颖,李英杰,闫宪尧,赵建立
(山东大学能源与动力工程学院,山东济南250061)
太阳能是一种清洁的可再生能源,集中式太阳 能热发电利用太阳能加热工质进行发电,引起学者的广泛关注[1-2]。但太阳能具有间歇性、不稳定性等缺点,为保证集中式太阳能电站连续运行,大规模储存太阳能是太阳能热发电的关键[3]。热化学储热基于可逆的热化学反应,多数化学反应过程伴随着吸热和放热,通过热能与化学能的转化来实现储存和释放热能[4]。由于CaO/Ca(OH)2体系储热密度高、储热损失小、成本低和无毒,因此被认为是最有前景的大规模热化学储热体系之一[5]。CaO/Ca(OH)2体系的水合/脱水反应是典型的气固反应,所需材料由天然钙基材料如石灰石煅烧获得,其水合/脱水储热可逆反应如式(1)所示。

CaO/Ca(OH)2体系的储热原理为:在太阳能脱水反应器中,Ca(OH)2吸热后脱水分解为CaO 和H2O,将太阳能以化学能的形式储存下来;需要使用热量时,将CaO和H2O送入到水合反应器中,一定条件下发生水合反应,此过程释放大量热量,最高温度可达500℃,因此水合反应器放热可代替汽轮机抽汽,用于加热锅炉给水。同时,水合反应器中重新生成Ca(OH)2,即完成1 次脱水反应和水合反应。Ca(OH)2再次进入脱水反应器即开始下一个循环,实现太阳能与热能的互相转化。可逆的化学反应构成闭式循环,可实现太阳能的大规模常温储存和远距离运输[6]。
在CaO/Ca(OH)2储热体系中,其储热性能受温度的影响较大[7]。Sakellariou 等[8]发现,在环境温度下将CaO与蒸馏水发生水合反应,当脱水气氛是空气时,CaO 的脱水温度会显著降低。赵长颖等[9]发现,温度对CaO 储热和放热效率有较大影响。Shi等[10]研究了煅烧温度和水合温度对分析纯CaO和工业CaO(煅烧石灰石)水合放热速率的影响,发现随水合温度升高和脱水温度降低,两种CaO的水合放热速率都升高,说明适当提高水合温度,降低脱水温度有利于CaO水合放热。反应气氛对煅烧石灰石的储热性能也有影响[11]。Criado 等[12]发现,当水合和脱水都在水蒸气中进行时,CaO的水合放热性能会急剧下降;而在500℃、空气中进行脱水反应时,CaO脱水性能没有明显降低。Sakellariou等[8]研究发现,与CaO和水蒸气水合相比,CaO和蒸馏水水合后所需脱水温度明显更低。然而,CaO在进行多次循环水合/脱水后,其储热性能有一定程度的下降。这是由于在多次水合/脱水储热循环之后,CaO和Ca(OH)2晶粒会发生颗粒团聚现象[13],使CaO的储热性能降低。Azpiazu 等[14]发现,CaO/Ca(OH)2水合/脱水储热性能只能在20 个循环内保持稳定。为保证较高的储热性能,需向水合反应器中不断补充CaO,并从脱水反应器中排出储热性能较低的CaO。
钙循环捕集CO2技术采用石灰石、白云石等天然钙基材料作为CO2吸收剂,利用CaO 与CO2的循环碳酸化/煅烧反应捕集燃煤电站燃烧烟气中CO2[15-16],该技术被认为是目前最具有工业应用前景的大规模捕集CO2技术之一[17-18]。在循环捕集CO2过程中,由于烧结的影响,CaO 的捕集CO2性能不断降低[19],多次循环后,从煅烧炉中排出大量活性较低的CaO,同时补充CaO[20]。目前对于捕集CO2循环后CaO的再利用较少有报道。

图1 基于燃煤电站的钙循环捕集CO2与CaO/Ca(OH)2体系储热耦合工艺
为充分利用捕集CO2循环后排出的CaO,如果结合CaO/Ca(OH)2储热技术,将煅烧炉排出的CaO送入CaO/Ca(OH)2储热体系的水合反应器中,进行循环水合/脱水反应,实现放热和储热,这样可使用经历多次碳酸化/煅烧反应后的CaO 作为储热材料,既可以节省大量的石灰石资源,又能实现捕集CO2循环后CaO 的再利用。同时,Manovic 等[21]发现,水蒸气可以对经历多次捕集CO2循环后的CaO起到再活化的作用,可以使其捕集CO2性能得到提高。因此,如果将经历多次捕集CO2循环后的CaO送入水合/脱水储热体系,其捕集CO2性能会得到提高。基于以上内容,提出了基于燃煤电站的钙循环捕集CO2过程与CaO/Ca(OH)2体系储热耦合的新工艺,工艺流程如图1所示。首先,CaO在碳酸化反应器和煅烧反应器之间循环实现CO2捕集,煅烧炉排出大量捕集CO2活性较低的CaO,这些CaO 部分储存于CaO常温储罐中。当需要储热时,将储罐中的CaO经空气气力输送进入水合反应器,CaO在水合反应器和太阳能脱水反应器之间循环,实现储热。水合反应器中释放的大量热量用来加热锅炉给水,可代替汽轮机抽汽,有望降低锅炉煤耗。CaO在循环水合/脱水过程后储热性能降低,可将这部分储热性能较低的CaO 再次送入碳酸化反应器中,进行再捕集CO2。该工艺可以同时实现钙循环捕集CO2和循环水合/脱水储热,梯级利用了CaO在脱碳和储热过程的反应活性,具有一定的应用前景。此外,目前研究人员一般采用氮气等惰性气体作为煅烧气氛,此时煅烧温度较低,条件较为温和,对应供热方式可以为太阳能或载热体。而实际应用中煅烧反应器热量一般由O2/CO2燃烧提供,该条件能真正实现CO2富集,有利于CO2封存或资源化利用[20]。因此较高的CO2分压力需要较高的煅烧温度才能使CaCO3分解,从而加剧CaO 的高温烧结,不利于CaO 的储热性能和捕集CO2性能。因此,有必要研究不同煅烧条件对经历多次循环捕集CO2后CaO储热性能的影响。
本文围绕此工艺路线研究水合条件、脱水条件对CaO 直接水合/脱水储热性能的影响,分析循环捕集CO2条件对钙循环后CaO水合/脱水储热性能的影响,探讨CaO循环捕集CO2过程和循环水合/脱水储热过程的相互作用,分析循环捕集CO2后CaO在储热过程中的微观结构演变,为该工艺的应用提供理论指导。
1 实验材料和方法
1.1 实验样品
本文所用材料是石灰石,将石灰石进行破碎筛分,筛分后的石灰石的颗粒粒径为0.05~0.074mm。煅烧后石灰石记为CaO。CaO的化学成分经X射线荧光光谱仪(XRF)测试,结果如表1所示。煅烧条件为:850℃,N2气氛和20min。

表1 煅烧后石灰石化学成分质量分数 单位:%
1.2 钙循环捕集CO2后CaO的热化学储热实验
CaO 循环碳酸化/煅烧捕集CO2实验和循环水合/脱水储热实验在常压固定床反应器系统上进行,如图2所示。该反应器系统包括碳酸化反应器、煅烧反应器、水合反应器和脱水反应器。脱水反应器使用电加热方式模拟太阳能加热。
CaO 循环捕集CO2实验过程如下:首先,将装有CaO 样品的瓷舟送入碳酸化反应器中,反应20min后,取出瓷舟在干燥皿中冷却3min,使用电子天平(Mettler Toledo-XS105DU,精度0.1mg)称重;然后将样品送入煅烧反应器中,反应10min后取出瓷舟放入干燥皿,冷却3min并称重,即完成1次碳酸化/煅烧循环。碳酸化条件:700℃、85%N2/15% CO2和20min;煅烧条件:850℃、100% N2和10min;瓷舟在两个反应器内完成多次碳酸化/煅烧捕集CO2循环。采用CO2吸收量衡量CaO 的捕集CO2性能。CO2吸收量为单位质量样品的CO2吸收质量,根据式(2)计算。

图2 常压固定床反应器系统示意图
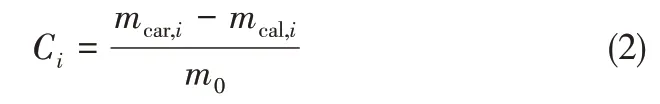
式中,i为碳酸化/煅烧循环脱碳次数;Ci为CO2吸收量,g/g;mcar,i为第i次碳酸化后样品质量,g;mcal,i为第i次煅烧后样品质量,g;m0为未循环初始样品质量,g。
CaO 循环水合/脱水储热实验在水合反应器和脱水反应器中进行。水合反应中使用的水蒸气由设定温度为250℃的水蒸气发生器提供,水蒸气在进入水合反应器之前,用电加热带加热。水合气氛为95% H2O/5% N2,脱水气氛为100% N2。储热实验过程如下:首先将装有CaO样品的瓷舟送入水合反应器中,水合反应完成后,样品放入干燥皿中冷却3min,使用电子天平称重。然后将样品送入脱水反应器中,反应完成后,样品放入干燥皿中冷却3min 并称量,即完成1 次水合/脱水储热循环。样品在水合和脱水反应器中循环,完成多次水合/脱水储热循环。采用水合转化率和脱水转化率来衡量样品的放热和储热性能,分别根据式(3)和式(4)计算。

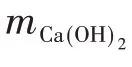
在实验过程中,由于实验室温度、湿度等因素的影响,主要误差来源是样品的称量环节。因此,在进行实验时,每一组实验均重复3次,每次均对样品进行质量称量并记录数据,并将3次实验的平均值作为本文的实验结果。同时,经过计算,每组实验数据的方差均小于0.0028,根据式(2)~式(4),可计算得称量误差对CO2吸收量、水合转化率、脱水转化率所造成的不确定性最大分别为0.0042g/g、1.3%、1.2%,这表明实验具有较好的可重复性。
1.3 CaO循环捕集CO2和循环储热相互影响实验
为了研究CaO循环捕集CO2过程和循环水合/脱水储热过程的相互影响,设计了以下实验,实验过程如下:首先将CaO送入碳酸化和煅烧反应器进行10 次循环碳酸化/煅烧捕集CO2过程,将进行了10次捕集CO2循环后的CaO送入水合和脱水反应器进行30 次循环水合/脱水储热过程,接着再将该样品送入碳酸化/煅烧反应器进行第11次碳酸化/煅烧捕集CO2循环,随后再将该样品送入水合/脱水反应器进行第31~40 次水合/脱水储热循环,将该样品送入碳酸化/煅烧反应器进行第12次碳酸化/煅烧捕集CO2循环,再将该样品送入水合/脱水反应器进行第41~50次水合/脱水储热循环。在整个实验过程中,CaO 共进行12 次碳酸化/煅烧捕集CO2循环和50 次水合/脱水储热循环。
1.4 微观结构分析方法
采用冷场发射扫描电子显微镜(SEM,JEOL JSM-7600F)观察经历不同循环捕集CO2和再储热循环后CaO的微观形貌特性;采用全自动氮吸附分析仪(Micromeritics ASAP-2020)测量了经历不同循环捕集CO2和再储热循环后CaO的比表面积、比孔容和孔分布特性;比表面积根据Brunauer-Emmet-Teller(BET)方法计算,比孔容和孔分布根据Barret-Joyner-Halenda(BJH)模型计算。
2 实验结果与讨论
2.1 CaO直接储热性能
本文对CaO 直接循环水合/脱水储热性能进行了研究,探讨了反应温度和反应时间对CaO循环储热性能的影响。
2.1.1 反应温度
在CaO/Ca(OH)2储热体系中,水合反应温度高于350℃才有实际应用价值[22]。水合温度对CaO 水合转化率的影响如图3所示。水合温度为400℃时,CaO 的X0,1比450℃和500℃时分别高11%和28%,经过10 次水合/脱水储热循环,400℃时的X0,10比450℃和500℃时分别高10%和22%。随水合温度提高,CaO水合转化率不断下降。CaO水合动力学与水合/脱水可逆反应的化学热平衡有关,水蒸气平衡分压对CaO水合反应温度有影响。Samms等[23]提出水蒸气压力为0~50bar(1bar=105Pa)范围内时,CaO 与水蒸气水合反应及Ca(OH)2脱水反应的平衡温度计算如式(5)所示。


图3 水合温度对CaO水合转化率的影响
式中,pH2O为水蒸气平衡分压,bar;T为平衡温度,K。本文中水蒸气平衡分压是0.95bar,根据式(5)计算,得到平衡温度是504℃。因此,CaO 水合温度应低于504℃。随水合温度从400℃增至500℃,逐渐接近平衡温度,所以CaO 水合转化率不断下降。考虑到储热的应用价值和实际性能,CaO水合温度为400℃时较为适宜。
脱水温度对CaO 脱水转化率的影响如图4 所示。可以发现,脱水温度为550℃时,CaO的Y0,1比450℃和500℃时分别高9%和4%,经过10 次水合/脱水储热循环,550℃时CaO的Y0,10比450℃和500℃时分别高14%和9%。这是因为升高脱水温度会促进Ca(OH)2的分解反应。相比于脱水温度为450℃和500℃时,脱水温度为550℃时,CaO脱水转化率最高。CaO/Ca(OH)2储热体系属于中低温储热,更高脱水温度意味着消耗更多能量,工业应用时经济性增加。因此,综合考虑脱水转化率与经济性,脱水温度为550℃时较为合适。
2.1.2 反应时间
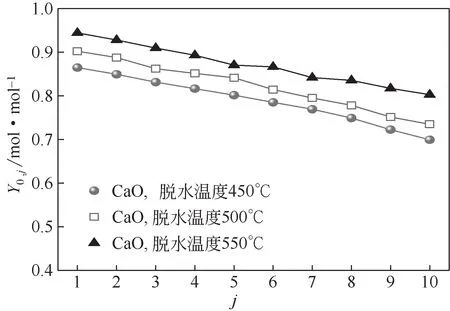
图4 脱水温度对CaO脱水转化率的影响
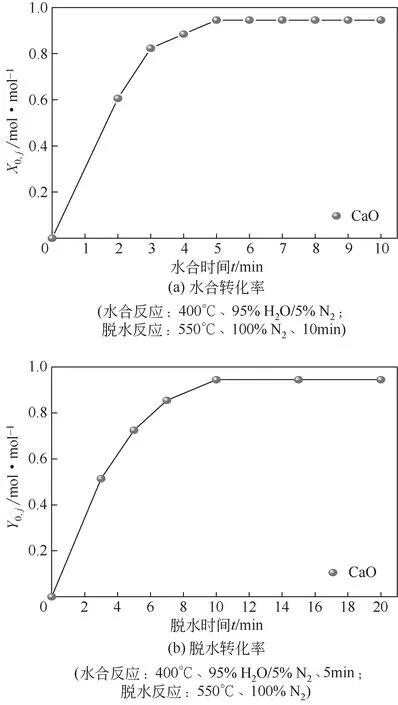
图5 反应时间对CaO水合转化率和脱水转化率的影响
水合反应时间和脱水反应时间对CaO储热性能的影响如图5 所示。如图5(a)所示,随水合时间的增加,CaO水合转化率不断增加,当水合时间超过5min 时,CaO 水合转化率随水合时间基本保持不变。因此,水合时间为5min 时,CaO 的水合反应基本完成。如图5(b)所示,在前10min,随脱水时间增加,CaO脱水转化率不断增加。当脱水时间是10min时,CaO的脱水转化率Y0,1是0.94mol/mol。脱水时间超过10min 以后,继续增加脱水时间,CaO脱水转化率基本不变,脱水反应基本完成。因此,CaO/Ca(OH)2储热循环的最佳水合和脱水时间分别是5min和10min。
2.2 循环捕集CO2后CaO的储热性能
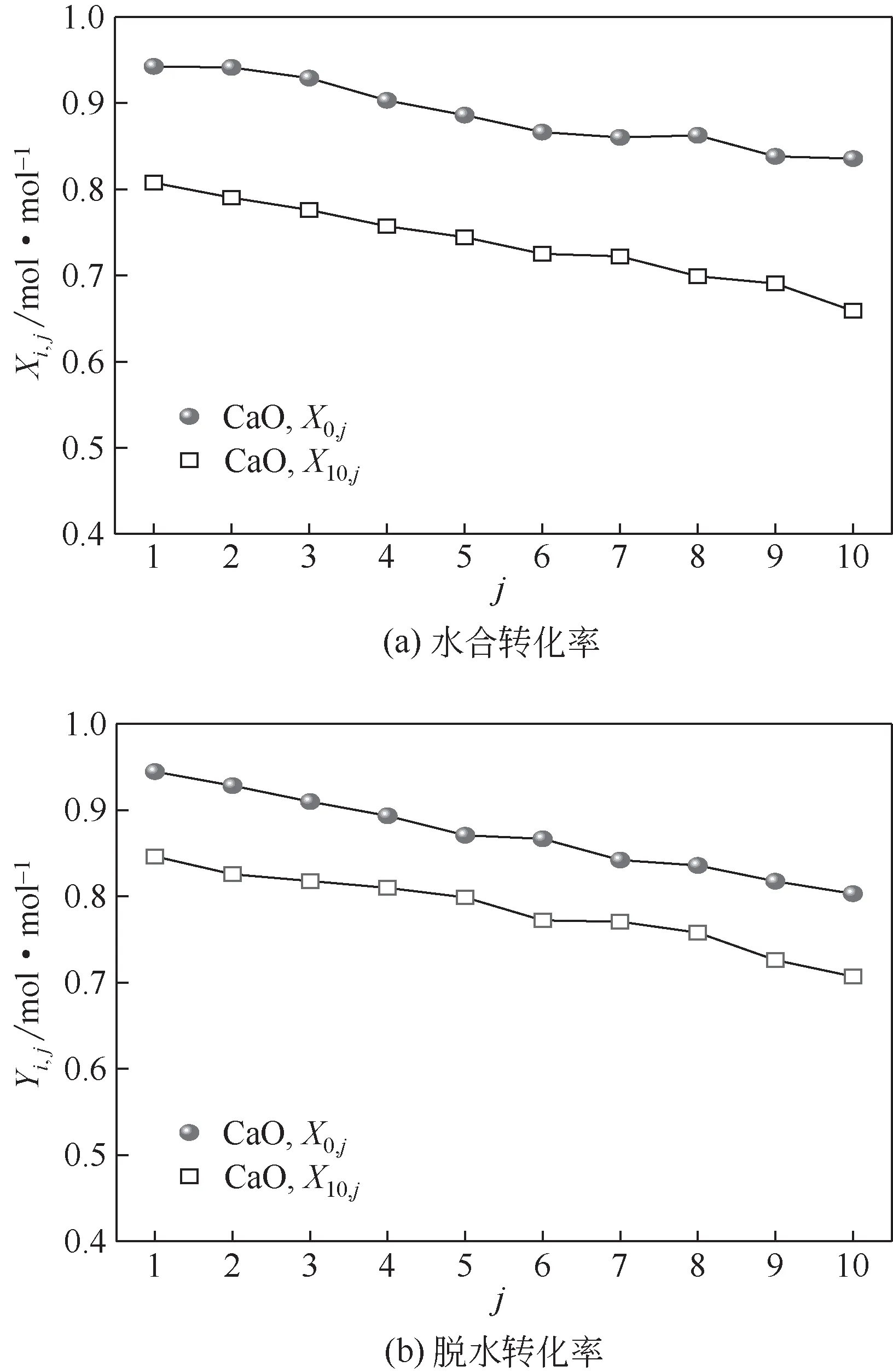
图6 原始CaO和经历10次循环捕集CO2后CaO的储热性能
图6为经历10次循环碳酸化/煅烧捕集CO2循环后CaO的储热性能。如图6(a)所示,当储热循环次数相同时,10次循环捕集CO2后CaO的水合转化率低于原始CaO。循环捕集CO2后CaO 的X10,1比原始CaO 的X0,1低14%;随储热循环增加,这种趋势更加明显,CaO的X10,10为0.66mol/mol,比原始CaO的X0,10低21%。此外,随储热循环增加,原始CaO 和10次循环捕集CO2后CaO的Xi,j不断降低。储热循环从1 次增加到10 次,原始CaO 和经历10 次循环捕集CO2后CaO 的水合转化率分别下降了11%和18%。因此,与原始CaO 相比,经历10 次循环捕集CO2后CaO的水合转化率循环稳定性稍低。经历10 次循环捕集CO2后CaO 的脱水转化率如图6(b)所示。当储热循环次数相同时,经历10 次循环捕集CO2后CaO的脱水转化率低于原始CaO。经过10次储热循环,原始CaO 和经历10 次循环捕集CO2后CaO的脱水转化率分别下降了15%和17%,差距不大。随储热循环次数增加,原始CaO的储热性能不断降低。这可能是两方面的原因造成的:一方面,随着储热循环次数的增加,CaO颗粒团聚,不利于储热的进行[13];另一方面,样品在冷却过程中,空气中CO2与样品中Ca(OH)2发生碳酸化反应生成了少量CaCO3,CaCO3在脱水温度下不能分解,这导致CaO储热性能随循环储热次数增加而降低。工业应用中采用空气从储罐中运送Ca(OH)2会出现类似情况。
2.3 循环捕集CO2条件对循环捕集CO2后CaO 储热性能的影响
2.3.1 煅烧条件
在循环碳酸化/煅烧捕集CO2过程中,经过多次高温煅烧CaO的微观孔隙结构发生变化,不同煅烧条件下会影响经历多次循环捕集CO2后CaO的储热性能。本文使用两种煅烧条件,分别是850℃、100% N2、 10min 和920℃、 30% N2/70% CO2、10min,分别作为温和煅烧条件和苛刻煅烧条件的代表,以研究煅烧条件下经历10次循环捕集CO2后CaO 的储热性能。煅烧条件对经历10 次循环捕集CO2后CaO 水合转化率的影响如图7(a)所示。当储热循环次数相同时,温和煅烧下CaO的水合转化率高于苛刻煅烧,前者的X10,1和X10,10比后者分别高7%和19%。随储热循环次数增加,两种煅烧条件下循环捕集CO2后CaO的水合转化率均下降。在温和和苛刻两种煅烧条件下,经历10次循环捕集CO2后CaO 的水合转化率经过10 次储热循环分别下降了18%和26%。因此与苛刻煅烧相比下,在温和煅烧下经历循环捕集CO2后CaO 的储热稳定性更好。煅烧条件对经历10次循环捕集CO2后CaO脱水转化率的影响如图7(b)所示。当储热循环次数相同时,苛刻煅烧时循环捕集CO2后CaO的脱水转化率始终低于温和煅烧时。因此,与温和煅烧相比,苛刻煅烧时经历10次循环捕集CO2后CaO的储热性能较低。这是因为在苛刻煅烧条件下,煅烧温度更高,使多次循环后CaO的烧结比在温和煅烧条件下更为严重,从而加剧了CaO在多次循环捕集CO2后孔隙堵塞和坍塌现象,这可能不利于水合储热。
2.3.2 碳酸化条件
研究了碳酸化气氛中水蒸气存在对经历10 次循环捕集CO2后CaO储热性能的影响,如图8所示。碳酸化气氛中有15%水蒸气时,对经历10 次循环捕集CO2后CaO的水合转化率和脱水转化率影响不大。因此,碳酸化气氛中水蒸气存在对循环捕集CO2后CaO的储热性能影响不大。
2.4 CaO 循环捕集CO2过程和循环储热过程的相互影响
2.4.1 循环储热过程对循环捕集CO2后CaO再捕集CO2性能的影响

图7 煅烧条件对经历10次循环捕集CO2后CaO储热性能的影响
图9 为水合/脱水储热循环对循环捕集CO2后CaO再捕集CO2性能的影响。由图可见,在前10次捕集CO2循环中,随捕集CO2循环次数增加,CaO的CO2吸收量迅速降低,10 次循环后下降了44.0%;再经30次循环水合/脱水储热,CaO的再捕集CO2性能显著提高,CaO 第11 次捕集CO2循环的吸收量为0.50g/g,与CaO 的C1几乎相等,是C10(0.24g/g)的2.1 倍。此后,循环脱碳的CaO 再经10 次储热循环(第31~41 次储热循环)后,其再捕集CO2性能提高了约6%。这表明在捕集CO2过程中,进行多次水合/脱水循环储热过程明显提高了CaO 再捕集CO2性能。这是因为经历循环捕集CO2后的CaO进入循环储热过程中,发生水合反应生成Ca(OH)2,脱水反应释放出水蒸气,会形成丰富孔隙,有利于CaO吸收CO2。
2.4.2 循环捕集CO2过程对储热循环后CaO再储热性能的影响
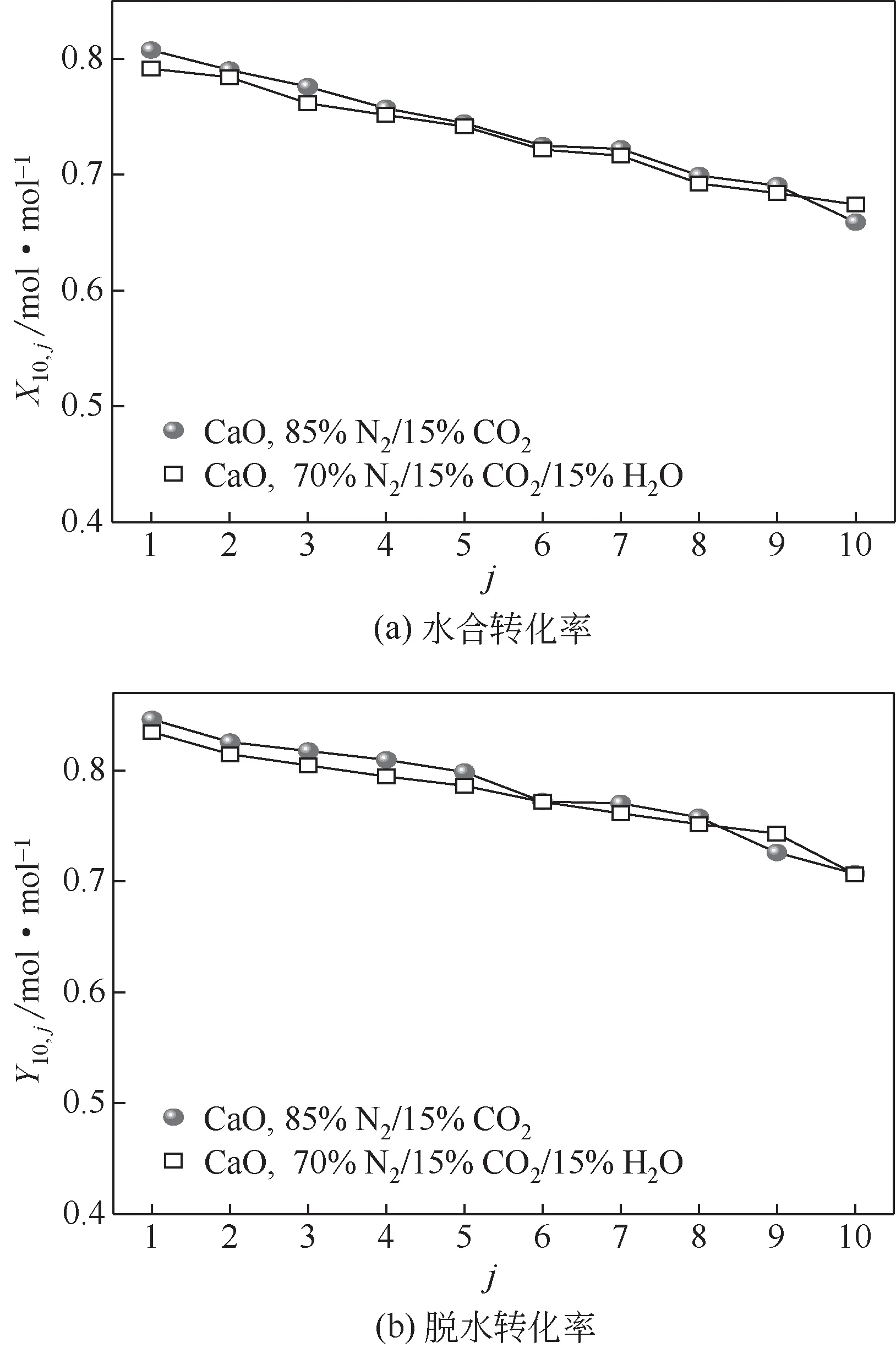
图8 碳酸化条件对经历10次循环捕集CO2后CaO储热性能的影响

图9 水合/脱水储热循环对经历捕集CO2循环后CaO再捕集CO2性能的影响
图10为循环捕集CO2对储热循环后CaO再储热性能的影响。如图10(a)所示,在前30 次储热循环中,随储热循环次数的增加,经历10 次循环捕集CO2后CaO的水合转化率不断降低,经过30次储热循环下降了52%。经过第11次碳酸化/煅烧循环后,循环CaO 的再水合性能得到提升,X10,31高达0.80mol/mol(与X10,1几乎相等),为X10,30的2.1 倍。随着储热循环的继续增加,水合转化率又呈现下降趋势。在第40次储热后,进行第12次碳酸化/煅烧循环,CaO 的X10,41高达0.79mol/mol(与X10,1几乎相等),为X10,40的1.2倍。因此,在循环储热过程中加入捕集CO2循环显著提高了储热循环后CaO的再水合性能。此外,对比图10(a)中本次实验数据与闫君等[24]的实验结果可以发现,经历10次捕集CO2循环后的CaO脱水转化率下降更慢,且在多次循环水合/脱水储热循环中,水合转化率明显更高。图10(b)为循环捕集CO2对储热循环后CaO再脱水性能的影响,与水合性能的结果类似,捕集CO2循环的引入同样可以提高CaO 的脱水性能。这表明,在水合/脱水储热循环中引入碳酸化/煅烧捕集CO2循环大幅度提高了CaO的再储热性能。这是因为储热循环中脱水阶段钙基材料中无法分解的CaCO3,经过循环捕集CO2的高温煅烧阶段完全分解成了CaO,这部分再生CaO 提高了钙基材料的储热性能。因此,综合以上研究,循环捕集CO2过程和循环储热过程能够相互促进。

图10 循环捕集CO2过程对经历捕集CO2循环和储热循环后CaO的再储热性能的影响
2.5 微观结构分析
图11为经历不同捕集CO2循环和再储热循环后CaO的微观形貌。如图11(a)所示,原始CaO孔隙丰富,孔隙之间连通性较好。10 次捕集CO2循环后CaO晶粒发生团聚和融合,孔隙被堵塞,孔隙之间连通性变差,如图11(b)所示,这是由于捕集CO2循环中煅烧阶段的高温烧结导致的,不利于CaO与水蒸气的水合放热,因此经历10 次捕集CO2循环后CaO的储热性能比原始CaO低。由图11(c)可知,经过10 次捕集CO2循环后再经10 次储热循环,CaO的烧结现象明显减轻,孔隙重新变得丰富,孔隙之间连通性相较储热循环之前明显变好。这表明,捕集CO2循环后烧结的CaO经过储热循环后孔隙得到优化,形成更多孔隙,这有利于CaO 再捕集CO2。因此,经历捕集CO2循环的CaO 经过储热循环后,其再捕集CO2性能得到了较大提高。
经历不同捕集CO2循环和再储热循环后CaO的比表面积和比孔容如表2所示。10次捕集CO2循环后,由于烧结,原始CaO的比表面积和比孔容分别下降了13%和17%。经历10次捕集CO2的CaO,再经10 次储热循环后其比表面积和比孔容分别提高了26%和80%。因此经历捕集CO2循环的CaO经过储热循环后,其再捕集CO2性能得到提高。

图11 经过多次捕集CO2循环和储热循环后CaO的SEM图
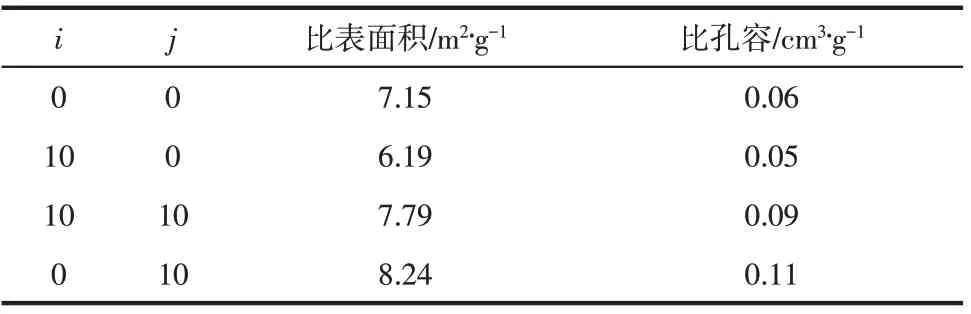
表2 经历多次捕集CO2循环和储热循环后CaO比表面积和比孔容
经历不同捕集CO2循环和再储热循环后CaO的孔分布特性如图12 所示。可以发现,原始CaO 的孔分布曲线呈现出明显双峰结构,分布在2~10nm与10~100nm的孔径范围内,原始CaO在孔径范围是1~30nm 的孔容低于经历10 次储热循环后CaO,但原始CaO在孔径范围是30~100nm的孔容高于经历10 次储热循环后CaO。这表明,随着储热循环增加,CaO在1~30nm的孔增多,在30~100nm的孔减少。考虑到随储热循环次数增加,CaO的储热性能不断下降,因此可以推断30~100nm的孔隙可能是CaO 进行水合反应的重要区域。此外,10 次捕集CO2循环后,高温烧结造成CaO 在10~100nm内的孔隙大幅度降低,因此CaO的捕集CO2性能不断降低。经历10 次捕集CO2循环再经10 次储热循环,经历10次捕集CO2循环后CaO在2~30nm孔径范围内的孔容增加,这部分孔隙的增加有利于进行捕集CO2,因此循环储热可以提高循环捕集CO2后CaO的再捕集CO2性能。
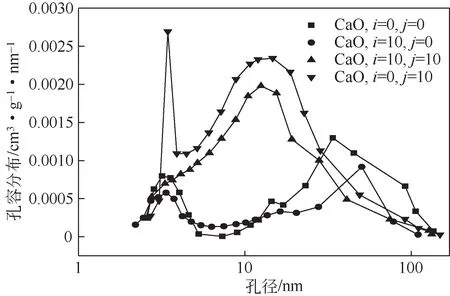
图12 经过多次捕集CO2循环和储热循环后CaO的孔分布特性
3 结论
本文提出了一个基于燃煤电站的钙循环捕集CO2过程与CaO/Ca(OH)2体系储热耦合的新工艺,使用经历多次碳酸化/煅烧反应后的CaO 作为储热材料,研究钙循环捕集CO2过程中反应条件对CaO储热性能的影响,探讨钙循环捕集CO2过程和循环水合/脱水储热过程的相互作用,主要结论如下。
(1)CaO的水合转化率随水合温度的升高而下降,CaO 的脱水转化率随脱水温度的升高而增加。综合考虑CaO的储热性能与系统经济性,适宜的水合温度和脱水温度分别为400℃和550℃。
(2)经历多次循环捕集CO2后CaO的储热性能比原始CaO低,是因为在循环捕集CO2过程中,高温煅烧导致CaO发生烧结,CaO晶粒发生团聚和融合,孔隙之间连通性变差,不利于CaO与水蒸气的水合放热。
(3)在循环捕集CO2的过程中,与苛刻煅烧条件相比,温和煅烧条件时经历多次循环捕集CO2后,CaO储热性能更高。碳酸化气氛中加入水蒸气对多次循环捕集CO2后CaO的储热性能影响不大。
(4)水合/脱水循环储热过程明显提高了CaO再捕集CO2性能,同时循环捕集CO2过程也能提高储热循环后CaO再储热性能,因此循环捕集CO2过程和循环储热过程相互促进。该工艺利用钙基材料有望同时实现CO2捕集和储热,节约了能源,具有一定的应用前景。

