局部脑缺血再灌注损伤对大鼠脑组织TLR4和NF-κB表达影响
徐翔 杨陈丽 赵宝华 陈晶
[摘要] 目的 研究Toll樣受体4(TLR4)和核转录因子-κB(NF-κB)在局部脑缺血再灌注模型脑组织中表达的变化。方法 选择36只SD大鼠随机分为3组,分别为假手术组(S组)、对照组(C组)和菊酯组(NF-κB抑制剂,CE组),每组12只。建立局部脑缺血再灌注的大鼠模型。采用双盲法对大鼠神经功能缺损评分进行记录,应用氯化三苯基四氮唑(TTC)染色法评估大脑梗死体积,TUNEL染色法标记凋亡细胞,蛋白质印迹分析检测TLR4和NF-κB的表达。结果 C组和CE组大鼠的神经功能缺损评分显著高于S组(F=16.7~189.7,P<0.01)。TTC染色结果表明,C组和CE组的脑缺血程度高于S组,CE组的脑梗死体积显著低于C组(F=271.5,P<0.01)。同时,CE组中TUNEL阳性细胞数显著低于C组(F=616.9,P<0.01)。S组大鼠NF-κB和TLR4表达水平均显著低于C组和CE组(F=279.7、884.8,P<0.01),而其在CE组大鼠表达水平显著低于C组(P<0.01)。结论NF-κB和TLR4的高表达可能与脑缺血再灌注损伤具有相关性。
[关键词] 脑缺血;再灌注损伤;Toll样受体4;NF-κB;大鼠,Sprague-Dawley
[中图分类号] R743.31;R619.9 [文献标志码] A [文章编号] 2096-5532(2020)02-0212-05
doi:10.11712/jms.2096-5532.2020.56.063 [开放科学(资源服务)标识码(OSID)]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200417.0914.006.html;2020-04-17 17:04
[ABSTRACT] Objective To study the changes in the expression of Toll-like receptor 4 (TLR4) and nuclear factor-κB (NF-κB) in the brain tissue of focal cerebral ischemia-reperfusion model. Methods A total of 36 Sprague-Dawley rats were randomly divided into sham operation group (group S), control group (group C), and chrysanthemum ester group (NF-κB inhibitor, group CE), with 12 rats in each group. A rat model of focal cerebral ischemia-reperfusion was established. The double-blind me-thod was used to record the neurological deficit score of rats. The 2,3,5-triphenyltetrazolium chloride (TTC) staining of the brain slices was performed to evaluate the cerebral infarct volume. TUNEL staining was carried out to label the apoptotic cells. Western blotting analysis was used to measure the expression of TLR4 and NF-κB. Results Groups C and CE had significantly higher neurological deficit scores than group S (F=16.7-189.7,P<0.01). The TTC staining results showed that groups C and CE had higher degrees of cerebral ischemia than group S, but the cerebral infarct volume in group CE was significantly lower than that in group C (F=271.5,P<0.01). In addition, group CE had a significantly lower number of TUNEL positive cells than group C (F=616.9,P<0.01). The Western blotting results showed that group S had significantly lower expression levels of NF-κB and TLR4 than groups C and CE (F=279.7,884.8;P<0.01), and group CE had significantly lower expression levels of NF-κB and TLR4 than group C (P<0.01). Conclusion The increased expression of NF-κB and TLR4 may be related to the cerebral ischemia-reperfusion injury.
[KEY WORDS] brain ischemia; reperfusion injury; Toll-like receptor 4; NF-kappa B; rats, Sprague-Dawley
脑卒中是人类致死的第二大病因,其严重影响病人的生活质量,并且对家庭和社会造成巨大的经济负担[1-3]。临床上,脑卒中分为缺血性卒中和出血性卒中,缺血性卒中占卒中发病率的80%左右[4-6]。各种原因引起的大脑供血、供氧减少可导致缺血性脑血管病的发生和组织的坏死,而脑缺血再灌注有时会进一步加重卒中损害和功能紊乱。业已证实,炎症与神经元细胞死亡和神经系统功能紊乱密切相关。核转录因子-κB(NF-κB)在炎症发生过程中具有关键作用[7]。Toll样受体(TLR)是一种跨膜受体,而TLR4作为其中一种亚型,主要识别不同的病原相关分子模式,进而导致炎症细胞分泌增加,引起全身炎症反应[8-9]。目前,对TLR4/NF-κB信号通路在局部脑缺血再灌注损伤中的作用还不够明确[10]。本文通过建立大鼠缺血再灌注模型,探讨缺血再灌注引起的神经系统损伤与TLR4/NF-κB表达的关系,旨在为明确缺血再灌注损伤机制提供依据。现将结果报告如下。
1 材料和方法
1.1 主要材料
菊酯(NF-κB抑制剂)、水合氯醛(上海阿拉丁生物技术公司),氯化三苯基四氮唑(TTC,美国Sigma公司),大鼠ELISA试剂盒(ELC)(美国Invitrogen公司,货号:ML-Elisa-0600),二甲基亚砜(DMSO,美国Sigma公司,货号:D2650),RIPA溶解产物、蛋白酶抑制剂、磷酸酶抑制剂(中国Service生物公司,货号:M00620-FKB),抗TLR4抗体(Solarbio公司,货号:K003881P),抗NF-κB抗体(美国Cayman Chemical,货号:17493-1)。
1.2 动物和处理
雄性SD大鼠42只,8周龄,体质量为220~280 g,购于江西省动物实验中心(许可证号:SCXK (Gan) 2015-0019)。实验前所有大鼠均在实验环境中适应1周,保证室温(21±2)℃、湿度(50±5)%、12 h/12 h昼夜光照循环,自由进食和饮水。动物实验严格按照青岛市中心医院伦理委员会规定进行(KY-Y20190661)。
随机取12只SD大鼠为假手术组(S组),其余30只参照Zea-Longa线栓法经左侧颈外-内动脉插线建立大脑中动脉闭塞(MCAO)模型[11]。缺血2 h后,轻轻拉出线栓,实现缺血再灌注。术后2 h采用Zea-Longa标准评分[11],>1分者视为模型成功,将不成功的6只剔除。将建模成功的24只大鼠随机分为对照组(C组)和菊酯组(CE组),每组12只。S组不插线,其余操作同C组和CE组。 CE组在手术前2 h腹腔内注射2 mL 菊酯溶液(5 mg/kg),S组和CE组注射同体积生理盐水。
1.3 检测指标和方法
1.3.1 神经行为功能评分 各组大鼠分别于脑缺血再灌注损伤后2、8、24 h采用Zea-Longa标准评分[11]。0分,没有神经功能缺损症状;1分,轻度局灶性神经功能缺损(不能完全性伸展前肢);2分,中度局灶神经功能缺损(行走时向健侧划圈);3分,重度神经功能缺损(行走时向健侧倾斜);4分,不能自主行走,意识水平下降。
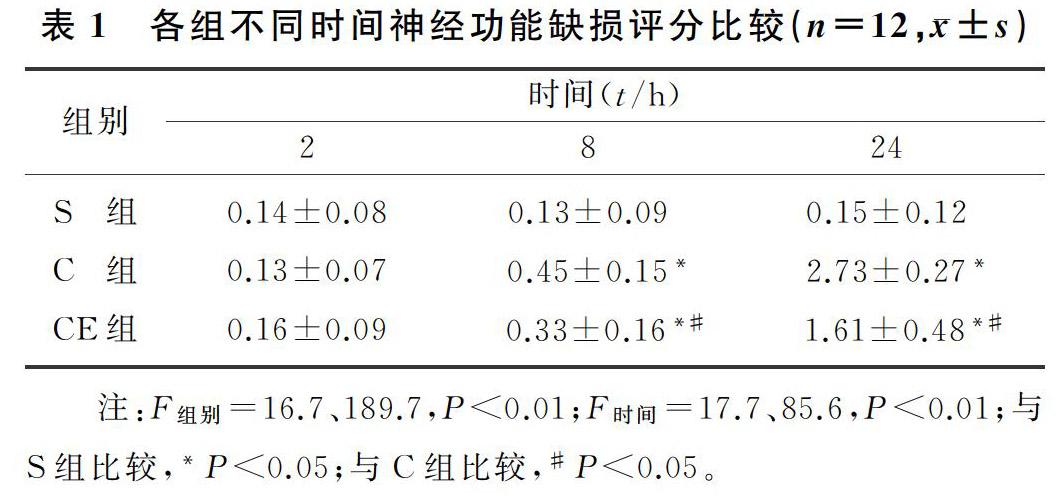
1.3.2 TTC染色 缺血再灌注24 h后,每组取4只大鼠麻醉,从左心室穿刺以生理盐水冲洗,完整取脑,放入切脑磨具中,冠状位切片,每片约2 mm厚。每只取3张,将脑片置于20 g/L的TTC溶液中,37 ℃隔水培养箱中避光浸浴5 min。染色后将脑组织片置于40 g/L甲醛溶液中固定。正常脑组织在TTC溶液中被染成亮红色,梗死区脑组织不被染色。固化24 h后照相,采用图像处理软件测量脑组织片各面缺血所占切片总面积的百分比。
1.3.3 细胞凋亡测定 每组取4只大鼠,取脑置于液氮、-80 ℃保存,连续冠状位切片,厚度10 μm,每隔5张抽取1张,每只取3张,贴片,晾干。按照TUNEL试剂盒说明进行操作,用PBS缓冲液冲洗5 min。用10 g/L的Triton X-100(聚乙二醇辛基苯基醚)漂洗脑组织15 min,用PBS缓冲液冲洗3次,每次5 min。在100 mmol/L氨基乙酸中孵育20 min,PBS缓冲液冲洗3次,每次5 min。加入TUNEL反应液,在暗湿盒中37 ℃孵育1 h,用PBS缓冲液冲洗3次,每次5 min。加入DAPI 孵育10 min,用超纯水冲洗3次,每次5 min。最后封片,于4 ℃暗室中在光学显微镜下进行拍照。具有黄绿色荧光的为阳性细胞,即凋亡细胞。
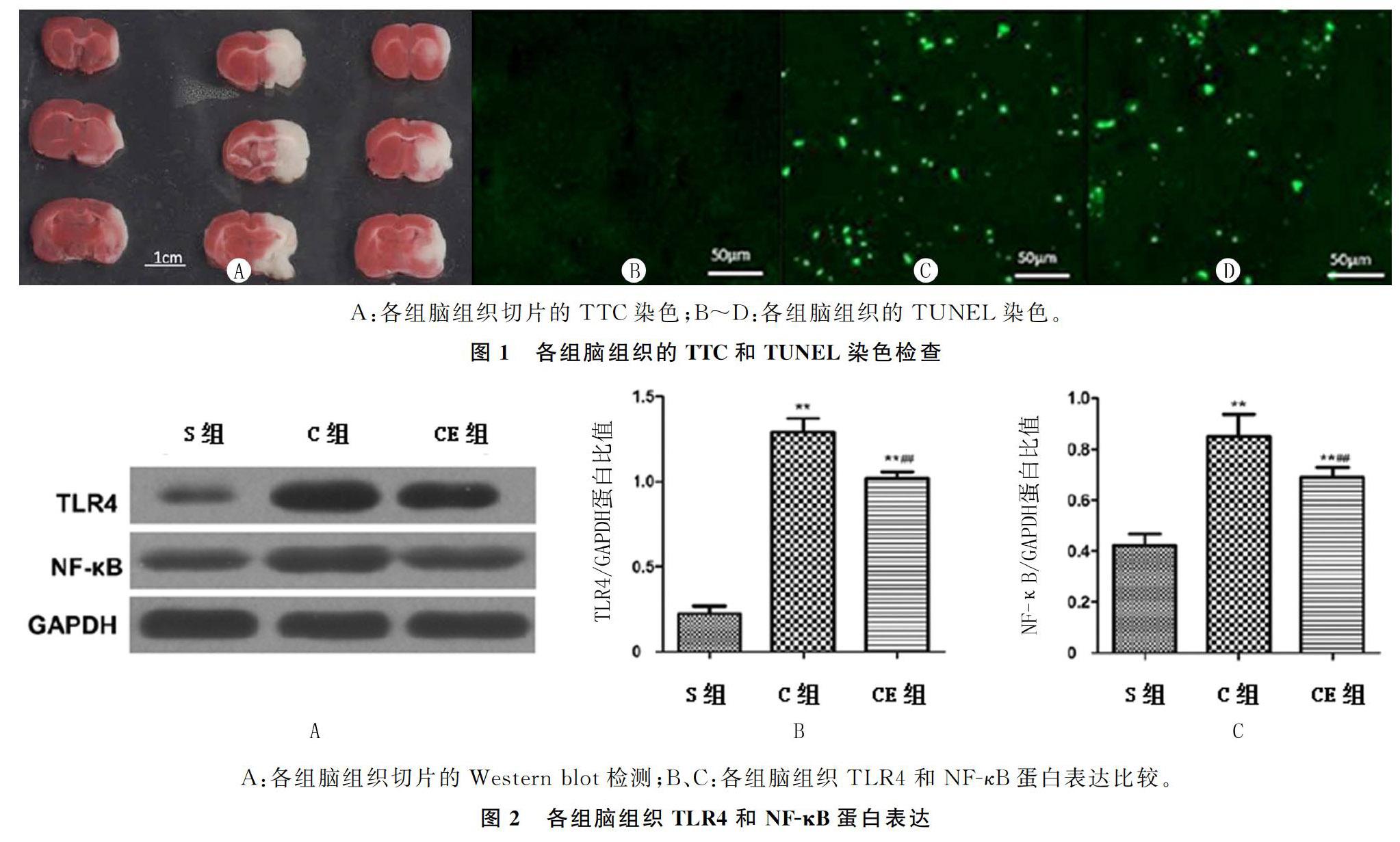
1.3.4 TLR4和NF-κB蛋白表达 采用蛋白质印迹法(Western blot)检测。每组取4只大鼠,每只取脑组织标本100 mg,按蛋白提取试剂盒说明提取蛋白,用BCA试剂盒测定蛋白濃度。于蛋白样本加入1/4体积5×SDS上样缓冲液,以50 μg蛋白样品用于SDS-PAGE凝胶电泳,200 mA恒电流转膜至PVDF膜。TBS/T洗膜后用50 g/L的BSA封闭2 h,再以TBS/T洗膜后加入相应浓度的抗体(抗TLR4抗体、抗NF-κB抗体),室温下以侧摇摆床缓慢摇动孵育2 h,并4 ℃孵育过夜,最后以TBS/T洗膜加入二抗(1∶5 000),室温孵育2 h。TBS/T洗膜后用ECL发光液显色成像。应用Image J软件比较目的条带相对灰度值。每只实验重复3次。
1.4 统计学分析
应用SPSS 19.0软件进行统计学处理。计量资料以±s表示,TTC染色结果、凋亡细胞水平及蛋白表达均数的比较采用单因素方差分析,多组间不同时间神经功能缺损评分均数的比较采用重复测量设计的方差分析,多组间均数的两两均数比较采用Bonferroni方法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组神经功能缺损评分比较
缺血再灌注8、24 h后C组和CE组的神经功能缺损评分均显著高于S组,而CE组的神经功能缺损评分又显著低于C组,差异均有显著意义(F=16.7~189.7,P<0.01)。说明给予菊酯抑制NF-κB后大鼠缺血再灌注损伤减小。见表1。
2.2 各组脑组织切片TTC染色比较
缺血再灌注24 h后,S组、C组和CE组的梗死区域分别为(6.32±2.76)%、(41.46±4.52)%和(29.51±3.78)%,S组的梗死区域明显小于C组和CE组,而CE组的坏死区域则显著小于C组,差异具有统计学意义(F=271.5,P<05)。说明给予菊酯抑制NF-κB后,大鼠局部脑组织梗死区域面积明显缩小。见图1A。
2.3 各组脑组织切片神经细胞凋亡水平比较
脑缺血再灌注24 h后,S组、C组和CE组的 TUNEL阳性细胞分别为23.21±5.82、385.42±26.42和204.02±35.73。S组少见TUNEL阳性细胞,C组和CE组TUNEL阳性细胞数显著多于S组(F=616.9,P<0.001)。与C组大鼠比较,CE组大鼠TUNEL阳性细胞数明显降低,差异有统计学意义(P<0.05)。结果提示给予菊酯抑制NF-κB后,局部脑缺血再灌注大鼠的神经细胞凋亡水平明显下降。见图1B~D。
2.4 各组TLR4和NF-κB蛋白表达比较
Western blot结果表明,缺血再灌注24 h后, C组和CE组大鼠的TLR4和NF-κB蛋白表达水平显著高于S组(F=279.7、884.4,P<0.01)。同时,TLR4和NF-κB蛋白表达在CE组明显低于C组(P<0.05)。提示菊酯可明显抑制NF-κB表达,通过控制NF-κB/TLR4信号通路降低脑组织的缺血再灌注损伤。见图2A~C。
3 讨 论
缺血性脑血管病的发病机制是脑血流中断,能量代谢紊乱,离子水平失衡,自由基和兴奋性神经毒性物质产生[12]。TLR4广泛分布于中枢神经系统,可以识别由于缺血再灌注损伤所释放的内源性配体,其可引起严重的炎症反应,进而影响神经系统功能[13-14]。活化的NF-κB可诱导黏附分子的表达,其相应的受体在炎症反应中发挥关键作用[15]。NF-κB/TLR4信号通路在脑缺血再灌注损伤中介导多种炎症递质和金属蛋白酶的产生和释放,因此,控制NF-κB/TLR4信号通路可降低脑组织的缺血再灌注损伤[16-21]。
本研究通过建立大鼠脑局部缺血再灌注损伤动物模型,观察TLR4和NF-κB在神经损伤中的变化。通过应用菊酯抑制NF-κB表达,从而明确NF-κB是否在脑缺血再灌注损伤中发挥作用。本文结果显示,C组大鼠的神经功能缺损评分明显高于S组,这就说明缺血再灌注可严重破坏大鼠的神经系统功能。另外,CE组的神经功能缺损评分显著低于C组,表明NF-κB抑制剂对大鼠神经功能具有保护作用。本文采用TTC和TUNEL染色从形态学和凋亡细胞水平评价缺血再灌注对脑组织的损害。结果显示,缺血再灌注能明显增加脑梗死面积,提高脑组织中凋亡细胞水平。而菊酯干预则能显著降低脑梗死面积和细胞凋亡水平,对抗缺血再灌注损伤,对大鼠脑组织起到保护作用。既往的研究结果显示,脑梗死病人TLR4/NF-κB信号通路表达较健康人明显升高,并且与脑血流量具有相关性[22-24]。我们通过Western blot技术检测各组大鼠脑组织NF-κB和TLR4蛋白表达的结果表明,C组NF-κB和TLR4蛋白表达显著高于S组,而两者在CE组的表达又明显低于C组。这说明缺血再灌注损害会提高脑组织NF-κB和TLR4的表达,而活化的NF-κB信号通路会导致脑组织损伤。这是因为脑局部缺血再灌注损伤中的内源性和外源性物质能提高NF-κB的表达,激活NF-κB信号通路,促使NF-κB从p50同源二聚体转化成具有转录活性的p60异二聚体。而活化的NF-κB从细胞质转移到细胞核中,发挥转录调节作用,产生一系列炎症因子,促进炎症发生。此外,NF-κB p65/p50水平增高也表明NF-κB信号通路的活化,进一步导致大量炎症因子的释放。上述原因导致的炎症反应引起脑组织中凋亡细胞水平升高,神经功能受损。脑损伤产生的内源性物质作为TLR4配体,可以增强炎症反应[25-29]。本文的研究结果还显示,与C组比较,CE组NF-κB水平明显下降,更进一步证明NF-κB在脑缺血再灌注损伤中的作用。
既往对TLR4/NF-κB信号通路在脑血管病中的作用研究多为对缺血性模型的研究,而对缺血再灌注模型研究较少。而缺血再灌注损伤也是影响病人治疗效果及预后的一项重要因素。本文通过脑缺血再灌注损伤的大鼠模型证实,脑缺血再灌注损伤能够提高TLR4和NF-κB的表达,激活TLR4/NF-κB信號通路,引起神经细胞凋亡,影响神经功能。通过抑制NF-κB可降低TLR4的表达,抑制TLR4/NF-κB信号通路激活,在局部脑缺血再灌注损伤中发挥保护作用。这为进一步研究缺血性脑梗死发生发展机制提供了一定理论基础,并且有可能为进一步研究缺血性脑血管病的治疗方法提供参考。本研究仍存在一些不足,今后的研究中将进一步增加缺血组和缺血再灌注组的比较,以进一步明确TLR4/NF-κB信号通路在脑缺血再灌注损伤中的作用机制。
[参考文献]
[1] PARK J S, HWANG N K, OH D H, et al. Effect of head lift exercise on kinematic motion of the hyolaryngeal complex and aspiration in patients with dysphagic stroke[J]. Journal of Oral Rehabilitation, 2017,44(5):385-391.
[2] KEPPEL HESSELINK J M. NS1209/SPD 502, a novel selective AMPA antagonist for stroke, neuropathic pain or epilepsy? drug development lessons learned[J]. Drug Development Research, 2017,78(2):75-80.
[3] SETO S W, CHANG D, JENKINS A, et al. Angiogenesis in ischemic stroke and angiogenic effects of Chinese herbal medicine[J]. Journal of Clinical Medicine, 2016,5(6):630-645.
[4] VASILEVA D, LUBENOVA D, MIHOVA M, et al. Orthostatic reactivity in patients with ischemic stroke in the chronic period[J]. Medical Science, 2015,3(3):397-402.
[5] BOISSERAND L S, KODAMA T, PAPASSIN J, et al. Biomaterial applications in Cell-Based therapy in experimental stroke[J]. Stem Cells International, 2016,2016:6810562. doi:10.1155/2016/6810562. PMID:27274738.
[6] LIANG Ying, HUANG Jian, TIAN Jingbin, et al. The prevalence and risk factors of stroke in patients with chronic schizophrenia[J]. Neuropsychiatric Disease and Treatment, 2016,12(9):1131-1134.
[7] QIN W Y, LUO Y, LING C, et al. Electroacupuncture could regulate the NF-κB signaling pathway to ameliorate theinflammatory injury in focal cerebral ischemia/reperfusion model rats[J]. Evidence-based Complementary and Alternative Medicine: ECAM, 2013,2013:924541. doi:10.1155/2013/924541. PMID:23970940.
[8] OSHIRO A H, OTSUKI D A, HAMAJI M W, et al. Diffe-rential Roles of TLR2 and TLR4 in acute focal cerebral ische-mia/reperfusion injury in mice[J]. Brain Res, 2009,25(1262):100-108.
[9] LIU Xin, CAO Yan, ZHANG Yan, et al. Teneligliptin inhi-bits lipopolysaccharide-induced cytotoxicity and inflammation in dental pulp cells[J]. International Immunopharmacology, 2019,8(73):57-63.
[10] 王娜,張雪梅,陈立杰. TLR4信号通路与炎症相关性疾病[J]. 中国实验诊断学, 2015,19(5):857-860.
[11] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Rever-sible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989,20(1):84-91.
[12] HINOHARA H, KADOI Y, TAKAHASHI K, et al. Time course of changes in cerebral blood flow velocity after tourniquet deflation in patients with diabetes mellitus or previous stroke under sevoflurane anesthesia[J]. Journal of Anesthesia, 2011,25(3):409-414.
[13] WANG Ying, GE Pengfei, ZHU Yuhong. TLR2 and TLR4 in the brain injury caused by cerebral ischemia and reperfusion[J]. Mediators of Inflammation, 2013,2013:124614.
[14] FERRONATO S, SCURO A, FOCHI S, et al. Expression of TLR4-PTGE2 signaling genes in atherosclerotic carotid plaques and peripheral blood[J]. Molecular Biology Reports, 2019,46(1):1317-1321.
[15] WANG Ying, GE Pengfei, YANG Li, et al. Protection of ischemic post conditioning against transient focal ischemia-induced brain damage is associated with inhibition of neuroinflammation via modulation of TLR2 and TLR4 pathways[J]. Journal of Neuroinflammation, 2014,11(24):15.
[16] TOMUSCHAT C, O DONNELL A M,COYLE D, et al.Neuroprotective effect of kaempferol flycosides against brain injury and neuroinflammation by inhibiting the activation of NF-κB and STAT3 in transient focal stroke[J]. Pediatr Res, 2013,8(2):1787-1799.
[17] ZHANG Man, YIN Huajing, WANG Weiping, et al. Over-expressed human TREK-1 inhibits CHO cell proliferation via inhibiting PKA and p38 MAPK pathways and subsequently inducing G1 arrest[J]. Acta Pharmacologica Sinica, 2016,37(9):1190-1198.
[18] LEVITZ J, ROYAL P, COMOGLIO Y, et al. Long non-coding RNA C2dat1 regulates CaMKIIδ expression to promote neuronal survival through the NF-κB signaling pathway follo-wing cerebral ischemia[J]. Proc Natl Acad Sci USA, 2016,31(7):266-271.
[19] XU Q, DENG F, XING Z, et al. Long non-coding RNA C2dat1 regulates CaMKIIδ expression to promote neuronal survival through the NF-κB signaling pathway following cerebral ischemia[J]. Cell Death & Disease, 2016,7:e2173.
[20] NA Xinyu, LIU Zongyuan, REN Pengpeng, et al. Long non-coding RNA UCA1 contributes to the progression of prostate cancer and regulates proliferation through KLF4-KRT6/13 signaling pathway[J]. International Journal of Clinical and Experimental Medicine, 2015,8(8):12609-12616.
[21] XU Weihua, ZHANG Jianbin, DANG Zheng, et al. Long non-coding RNA URHC regulates cell proliferation and apoptosis via ZAK through the ERK/MAPK signaling pathway in hepatocellular carcinoma[J]. International Journal of Biological Sciences, 2014,10(7):664-676.
[22] 顾红梅,邵阳. 急性脑梗死患者TLR4/NF-κB信号通路水平与脑血流量的相关性研究[J]. 卒中与神经疾病, 2017,24(3):197-199,213.
[23] 李扬,李旭,叶卫娜,等. 血管紧张素1-7通过TLR4/NF-κB信号通路拮抗大鼠脑缺血再灌注损伤[J]. 国际生物医学工程杂志, 2018,41(6):499-503.
[24] 蒋腾,高丽,陆杰,等. 血管紧张素-(1-7)對大鼠脑缺血再灌注损伤后核因子-κB及下游炎症因子的调控作用[J]. 中华神经医学杂志, 2013,12(1):19-23.
[25] ZHU H T, BIAN C, YUAN J C, et al. Curcumin attenuates acute inflammatory injury by inhibiting the TLR4/MyD88/NF-κB signaling pathway in experimental traumatic brain injury[J]. Journal of Neuroinflammation, 2014,27(11):97-110.
[26] LIU J, CHEN Q, JIAN Z, et al. Daphnetin protects against cerebral ischemia/reperfusion injury in mice via inhibition of TLR4/NF-κB signaling pathway[J]. Biomed Research International, 2016,2016:2816056. doi:10.1155/2016/2816056. PMID:28119924.
[27] QI Meng, ZHENG Lingli, QI Yan, et al. Dioscin attenuates renal ischemia/reperfusion injury by inhibiting the TLR4/MyD88 signaling pathway via up-regulation of HSP70[J]. Pharmacological Research, 2015,100:341-352.
[28] ZENG Huiqing, YANG Lijuan, ZHANG Xiaobin, et al. Dioscin prevents LPSinduced acute lung injury through inhibiting the TLR4/MyD88 signaling pathway via upregulation of HSP70[J]. Mol Med Rep, 2018,17(5):6752-6758.
[29] ZHANG Xiangsheng, LI Wei, WU Qi, et al. Resveratrol attenuates acute inflammatory injury in experimental subarachnoid hemorrhage in rats via inhibition of TLR4 pathway[J]. Int J Mol Sci, 2016,17(8):1331. PMCID: PMC5000728.
(本文编辑 于国艺)

