mTOR/PKM2和STAT3/c-Myc信号通路串话调节胃癌能量代谢和酸性微环境的机制研究*
高苏萌 王卓婷 徐 磊 沈永华 凌亭生 王 雷 邹晓平 陈 敏
南京大学医学院附属鼓楼医院消化科(210008)
背景:c-Myc和PKM2在多种肿瘤中高表达,但mTOR/PKM2和STAT3/c-Myc信号通路对胃癌调节作用的研究不多见。目的:探讨mTOR/PKM2和STAT3/c-Myc信号通路串话调节胃癌能量代谢和酸性微环境的机制。方法:PKM2和c-Myc慢病毒转染人胃癌AGS和HGC-27细胞,构建敲减PKM2、c-Myc的细胞模型。采用CCK-8法检测细胞增殖能力,Transwell小室法检测细胞迁移能力,流式细胞术检测细胞凋亡,实时定量PCR和蛋白质印迹法分别检测PKM2、c-Myc、LDHA、STAT3、p-STAT3、GLUT-1 mRNA和蛋白表达,比色法检测乳酸和葡萄糖水平。结果:PKM2和c-Myc表达在胃癌细胞中上调。敲减c-Myc可抑制胃癌细胞增殖能力,细胞迁移能力明显降低,LDHA、GLUT-1蛋白表达明显降低,葡萄糖和乳酸含量明显降低。共同敲减PKM2和c-Myc对胃癌细胞增殖能力和糖酵解代谢的抑制作用更明显。mTOR/PKM2与STAT3/c-Myc信号通路之间存在相关性。结论:PKM2联合c-Myc可能成为胃癌新的治疗靶点。
胃癌是消化系统常见的恶性肿瘤之一[1],在恶性肿瘤中的发病率和死亡率分别位居第四位和第二位。恶性肿瘤细胞的代谢变化为其重要的标志之一[2]。
Warburg效应是指恶性肿瘤细胞在氧充足的情况下,激活有氧糖酵解,导致葡萄糖代谢成为乳酸,随后被单羧酸转运蛋白分泌至细胞外,产生并维持肿瘤细胞生长的酸性微环境[3]。细胞外低pH值微环境亦可促进肿瘤的恶性生物学行为,包括侵袭转移、多药耐药、细胞增殖等[4]。
c-Myc是Myc基因家族的重要成员,在肿瘤能量代谢中发挥重要作用,可调节肿瘤细胞的糖酵解水平,从而促进肿瘤的Warburg效应[5-6]。丙酮酸激酶是糖酵解的关键酶,可将磷酸烯醇丙酮酸的磷酸基团转移至ADP,从而生成丙酮酸和ATP分子。M2型丙酮酸激酶(PKM2)在多种肿瘤细胞中高表达[7]。
信号转导和转录激活因子3(STAT3)信号通路及其下游靶基因参与调控肿瘤细胞凋亡,通过促进肿瘤细胞增殖和抑制凋亡来提高癌细胞对细胞毒性药物的耐受能力[8]。STAT3异常激活与肿瘤细胞增殖、凋亡、多药耐药、血管生成和侵袭转移等生物学相关特征密切相关[9]。c-Myc是STAT3下游调控的靶基因之一[10]。低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是由α亚基和β亚基组成的异源二聚体蛋白, HIF-1α会促进肿瘤细胞糖酵解, 调控PKM2、GLUT-1、LDHA等基因表达,并使肿瘤细胞在低氧微环境下得以存活并使肿瘤的恶性程度进一步增强。
本研究通过一系列体外实验来研究mTOR/PKM2和STAT3/c-Myc信号通路是否可调节胃癌能量代谢、能逆转其酸性肿瘤微环境,旨在改善肿瘤恶性生物学行为,并探讨两种信号通路之间是否存在内在的相互作用,阐明上游和下游分子之间的关系以便提供新的联合治疗靶点,从而为胃癌的治疗提供一个新的思路。
材料与方法
一、细胞株、主要试剂和仪器
AGS、GES、HGC-27、MKN45、N-87细胞株均来源于南京鼓楼医院消化病学实验室。
抗人PKM2(cst3198)、LDHA(cst3582)、STAT3(cst4904)、c-Myc(cst3987s)、GLUT-1抗体、p-STAT3单克隆抗体均购自Cell Signaling Technology, Inc.。抗人β-actin单克隆抗体购于美国Sigma公司。
BCA蛋白浓度定量试剂盒购自江苏凯基生物技术股份有限公司。TEMED有机溶剂、溴酚蓝、结晶紫粉末购自生工生物工程(上海)有限公司。反转录试剂盒PrimeScript®RT reagent Kit、实时PCR试剂盒 SYBR®Premix Ex TaqTMII购于Takara公司。Transwell小室购于BD公司。CCK-8细胞增殖检测试剂盒购于Dojindo公司。乳酸、葡萄糖检测试剂盒购自美国BioVision公司。细胞凋亡试剂盒购自BD Biosciences公司。蛋白质印迹法的实验仪器均购自美国Bio-Rad公司。慢病毒悬液均购自上海吉玛制药技术有限公司。雷帕霉素试剂购自Cell Signaling Technology, Inc.。
二、实验方法
1.慢病毒转染细胞:将106/孔AGS和HGC-27细胞接种于6孔板,加入RPMI-1640培养基培养24 h后,替换为含有5 μg/mL 聚凝胺的新鲜RPMI-1640培养基,并加入慢病毒悬液,37 ℃孵箱中温育24 h,更换为RPMI-1640培养基继续培养1~2 d。
2.CCK-8实验:取各组细胞,胰酶消化后调整细胞密度为4×104/mL,接种于96孔板,每孔为100 μL;对照组加入相同体积的PBS溶液;分别培养24 h、48 h、72 h和96 h后,每孔加入100 μL含有10% CCK-8溶液的RPMI-1640培养基,培养2 h;上酶标仪检测450 nm波长处的吸光度值。
3.Transwell细胞迁移实验:待各组细胞贴壁生长至80%融合状态时,胰酶消化,加入2 mL RPMI-1640培养基重悬,调整细胞密度为6×104/mL。取出Transwell小室,在12孔板的下室中加入含15% FBS的RPMI-1640培养基750 μL,在上室中加入500 μL细胞悬液,培养24 h;PBS清洗,甲醇固定;0.5%的结晶紫液体染色15 min,PBS清洗;光学显微镜下观察。
4.集落形成实验:以5 000/孔的细胞接种于6孔板,置于37 ℃、5% CO2的孵箱内培养5~7 d,以PBS溶液清洗,甲醇固定,0.5%的结晶紫溶液染色15 min,自然光下拍照。
5.细胞凋亡实验:取融合度为80%的各组细胞,胰酶消化,收集细胞,1 500 r/min离心5 min,弃上清液,PBS溶液重悬,1 500 r/min离心5 min,弃上清液,加入300 μL结合缓冲液和2.5 μL Annexin V-FITC,避光置于37 ℃ 孵箱20 min,再加入2.5 μL PI,上流式细胞仪检测细胞凋亡率。
6.实时荧光定量PCR法:收集各组细胞,加入TRIzol试剂提取细胞总RNA,按照反转录试剂盒,反转录合成cDNA。目的基因和内参β-actin基因的引物均由华大基因公司设计合成,序列见表1。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次;72 ℃终延伸7 min。采用2-ΔΔCt法计算各基因mRNA表达水平。
7.蛋白质印迹法:取各组细胞,加入蛋白裂解液提取细胞总蛋白,BCA法定量蛋白浓度。取15~20 μg蛋白行8% SDS-PAGE电泳,将分离的蛋白凝胶转移到NC膜,5%脱脂奶粉封闭120 min,4 ℃加入一抗(稀释浓度为1∶1 000)封闭过夜,TBST洗涤5 min×3次;加入稀释的二抗室温孵育1 h,TBST洗涤;曝光,显影,摄片。采用Image J图像分析软件测定条带灰度值,以各目的蛋白灰度值与β-actin灰度值的比值作为目的蛋白相对表达情况。
8.葡萄糖、乳酸检测:采用比色法检测葡萄糖、乳酸水平,具体步骤按说明书步骤操作。
9.雷帕霉素处理细胞:在胃癌AGS细胞中加入不同浓度(5、10、15 nmol/L)mTOR抑制剂雷帕霉素处理细胞。
10.siRNA 转染: 取对数生长期AGS细胞接种于6孔板,待细胞密度达80%左右时转染细胞。按LipofectamineTM2000转染试剂说明书,分别转染空载体pU6质粒(空载体组)和STAT3 siRNA干扰质粒(STAT3 siRNA组),以400 μg/mL G418培养液进行高转染效率细胞株筛选2周,收集细胞进行后续实验。
三、统计学分析
结 果
一、敲减c-Myc可抑制胃癌细胞的增殖能力和糖酵解水平
PKM2和c-Myc在AGS和HGC-27细胞中表达升高(P<0.05;图1A)。以c-Myc慢病毒处理AGS和HGC-27细胞后,c-Myc mRNA表达和蛋白均明显减少(P<0.05;图1B、1C);细胞增殖能力明显降低,且呈时间依赖性(P<0.05;图1D);细胞集落形成明显下降(P<0.05;图1E);细胞迁移能力明显下降(P<0.05;图1F);LDHA、GLUT-1蛋白表达明显降低(P<0.05;图1G);葡萄糖和乳酸含量明显降低(P<0.05;图1H)。
二、共同敲减PKM2和c-Myc可抑制胃癌细胞的增殖能力和糖酵解水平
AGS和HGC-27细胞共同敲减PKM2和c-Myc表达后,PKM2、c-Myc mRNA和蛋白表达均明显降低(P<0.05;图2A);细胞增殖能力明显下降(P<0.05;图2B);细胞集落形成明显下降(P<0.05;图2C);细胞迁移能力明显下降(P<0.05;图2D);细胞凋亡明显升高(P<0.05;图2E);LDHA、GLUT-1蛋白表达均明显下降(P<0.05;图2F);葡萄糖和乳酸水平明显降低(P<0.05;图2G)。共同敲减组对胃癌细胞增殖能力和糖酵解水平的抑制作用强于单独敲减PKM2或c-Myc。
三、mTOR/PKM2和STAT3/c-Myc共同调节胃癌细胞糖代谢
以不同浓度(5、10、15 nmol/L)mTOR抑制剂雷帕霉素处理胃癌AGS细胞后,STAT3、c-Myc、PKM2蛋白表达均明显降低(P<0.05),而LDHA、GLUT-1蛋白表达无明显差异(图3A)。以siRNA下调AGS细胞中STAT3表达后,c-Myc、LDHA蛋白表达受到明显抑制(P<0.05),而PKM2蛋白表达无明显差异(图3B)。在AGS和HGC-27细胞中,单独敲减PKM2后,c-Myc蛋白表达升高,STAT3蛋白表达下降;而单独敲减c-Myc后,PKM2蛋白表达下降(图3C、3D)。同时抑制STAT3后,PKM2蛋白表达无明显变化。而抑制PKM2后,STAT3蛋白表达下降,c-Myc蛋白表达升高,抑制c-Myc后,PKM2蛋白表达下降。通路中靶蛋白的mRNA表达变化与蛋白表达一致(图3E-3G)。

表1 各基因的引物序列
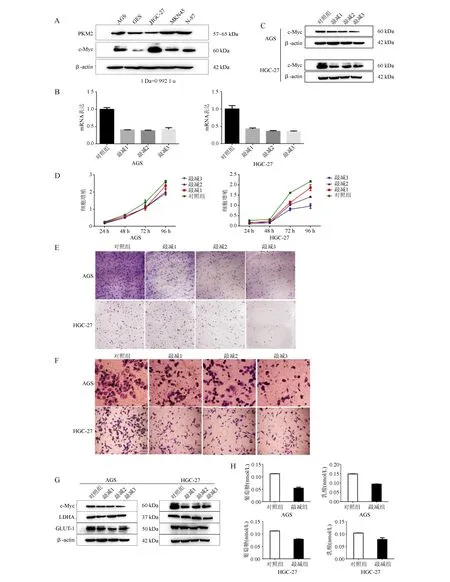
A:PKM2和c-Myc在不同细胞中的表达(蛋白质印迹法);B:c-Myc mRNA表达(实时荧光定量PCR法);C:c-Myc蛋白表达(蛋白质印迹法);D:细胞增殖(CCK-8法);E:集落形成;F:细胞迁移(Transwell小室法);G:LDHA、GLUT-1蛋白表达(蛋白质印迹法);H:葡萄糖和乳酸含量(比色法)
图1 敲减c-Myc可抑制胃癌细胞的增殖能力和糖酵解水平
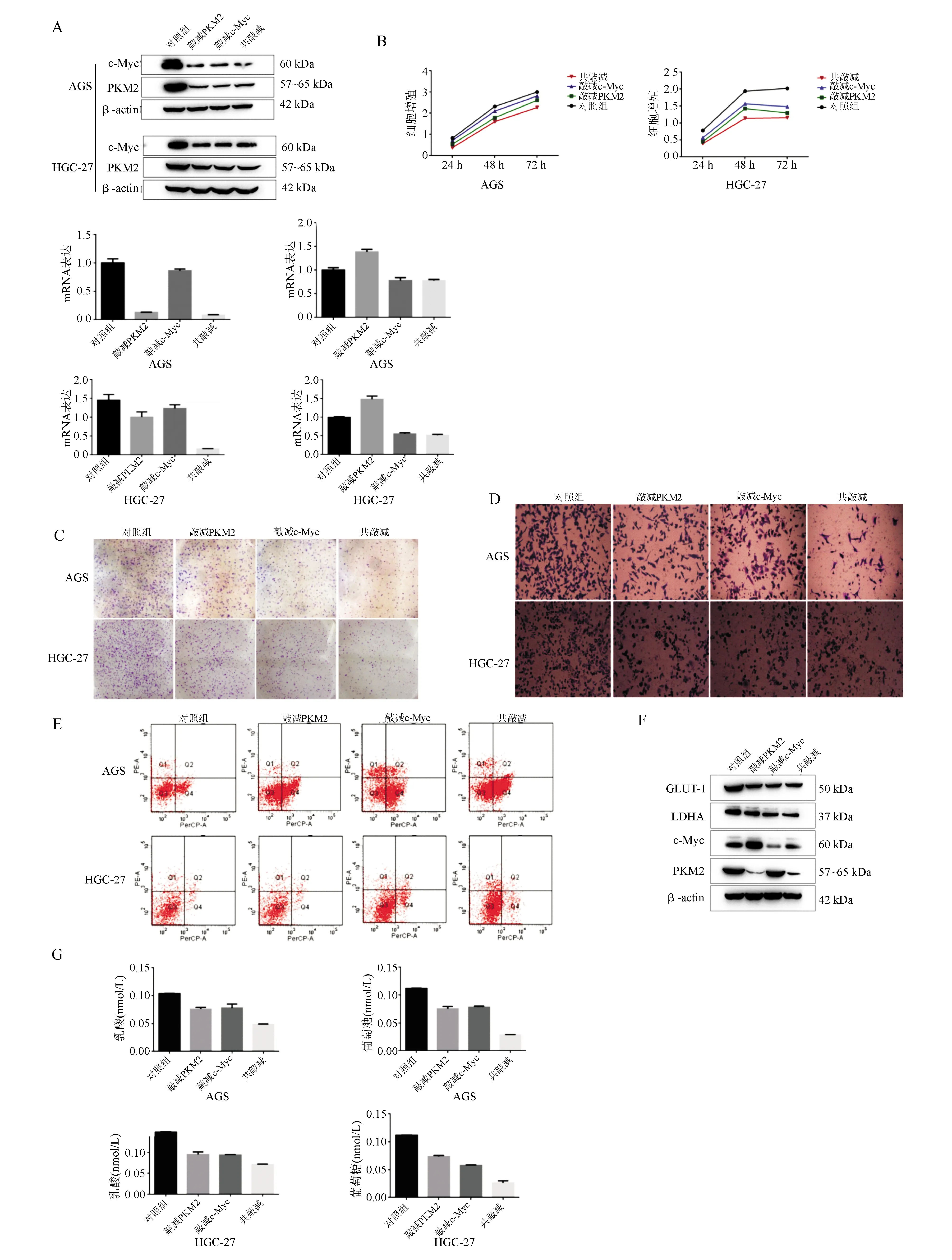
A:PKM2、c-Myc表达(蛋白质印迹法、实时荧光定量PCR法);B:细胞增殖(CCK-8法);C:集落形成;D:细胞迁移(Transwell小室法);E:细胞凋亡(流式细胞术);F:LDHA、GLUT-1蛋白表达(蛋白质印迹法);G:葡萄糖、乳酸含量(比色法)
图2 共同敲减PKM2和c-Myc可抑制胃癌细胞的增殖能力和糖酵解水平

A-D:不同处理后的蛋白表达(蛋白质印迹法);E-H:不同处理后的mRNA表达(实时荧光定量PCR法)
讨 论
肿瘤作为一个相互作用的细胞群体,通过构成复杂的信号通路转导网络进行胞内外信号转导来调控其能量代谢[11]。因此,通过对胃癌能量代谢通路的干预来改善其恶性生物学行为,是现今胃癌的主要研究方向之一。
PKM2和c-Myc作为两种重要靶基因在不同类型肿瘤中起有重要作用,在肝癌、结直肠癌、乳腺癌和肺癌中高表达[12-15]。有文献证实PKM2、HIF-1α和STAT3存在交互作用[16-17]。本研究发现PKM2和c-Myc在胃癌AGS和HGC-27细胞中高表达。
mTOR/PKM2信号通路可调控胃癌糖酵解,且与肿瘤酸性微环境密切相关。前期研究[18]发现,使用siRNA抑制胃癌SGC-7901细胞中PKM2 mRNA和蛋白表达后,胃癌细胞的增殖能力和糖酵解水平均受到明显抑制。本研究发现以不同浓度(5、10、15 nmol/L)mTOR抑制剂雷帕霉素处理胃癌AGS细胞后,STAT3、c-Myc、PKM2蛋白表达均明显降低;应用siRNA技术特异性下调胃癌AGS细胞中STAT3表达后发现,下游c-Myc表达明显下调。因此,推测mTOR/PKM2与STAT3/c-Myc信号通路共同构成了调控胃癌能量代谢的分子网络,两条信号通路之间可能存在相互作用。
本研究还发现,敲减c-Myc可抑制胃癌细胞增殖能力、迁移能力和集落形成能力,并抑制糖酵解相关蛋白的表达以及胞外葡萄糖和乳酸水平,从而抑制胃癌细胞的糖酵解。共同敲减PKM2和c-Myc可显著抑制胃癌细胞的增殖、迁移能力,促进细胞凋亡,且该作用较单独敲减PKM2或c-Myc更明显。说明PKM2和c-Myc的共同抑制可能是胃癌治疗的新靶点。
研究发现,激活mTOR信号通路后,多种恶性肿瘤细胞的凋亡过程受到抑制,促进细胞周期进展,提高细胞增殖能力[19]。雷帕霉素表达在胃癌的原发病灶和转移灶中均较高,且p-mTOR过表达可作为原发性胃癌根治术后预后良好的独立因素。此外,恶性肿瘤细胞淋巴结转移与p-mTOR表达及其在细胞内的定位相关。有研究显示,STAT3调控的许多下游靶基因与细胞增殖、凋亡过程密切相关,如Bcl-2、c-Myc、Fas等[20]。STAT3持续激活与细胞恶性转化程度有关,且能在裸鼠实验中形成肿瘤,故目前普遍认为STAT3为一种癌基因[21-22]。
本研究以不同浓度mTOR抑制剂雷帕霉素拮抗处理AGS细胞后发现,随着mTOR蛋白表达下降,PKM2表达随之下降。说明mTOR位于PKM2的上游,并可调控PKM2表达,这种调节作用可能与mTOR浓度相关,其机制仍需行进一步研究。抑制mTOR后,STAT3蛋白表达亦明显降低。以siRNA干扰STAT3表达后,AGS细胞中c-Myc蛋白表达亦明显下降,而其他靶基因蛋白表达无明显变化。故推测在mTOR信号通路中,mTOR位于STAT3的上游,STAT3位于c-Myc的上游,上游基因可调控下游基因的表达。
目前肝细胞癌中STAT3与c-Myc关系的研究较为多见,STAT3可能通过上调c-Myc来抑制肝癌细胞凋亡,促进细胞增殖[23-24]。本研究在AGS和HGC-27细胞中敲减PKM2,结果显示c-Myc蛋白表达增加,STAT3蛋白表达降低。由于PKM2蛋白表达在抑制STAT3表达后无明显变,推测PKM2可能位于STAT3的上游,但其机制仍需进一步的研究。敲减c-Myc后,PKM2蛋白表达降低。因此,PKM2和c-Myc可能存在更复杂的网络结构,通过更多的基因分子间彼此互相调控,从而影响彼此上、下游基因的表达,未来需行进一步的假设和实验进行验证。
本研究存在一定的局限之处。首先,上述体外实验并未行体内实验进一步验证研究结果。其次,本实验探讨了PKM2与STAT3的上、下游关系,PKM2与c-Myc之间存在相互关系,mTOR对PKM2的调节关系,但PKM2调控STAT3的具体机制,PKM2与c-Myc两条信号通路之间相互作用的具体机制以及mTOR对PKM2的调节作用及其与浓度的关系均尚未完全阐明。
总之,本研究证实共同敲减PKM2和c-Myc对胃癌细胞增殖能力和糖酵解代谢的抑制作用较单独敲减更为明显。mTOR/PKM2和STAT3/c-Myc信号通路之间存在相关性。PKM2联合c-Myc可能成为胃癌新的治疗靶点。但上述研究结论仍需行进一步研究证实。

