1,3-丙二胺改性纳米金刚石表面及其表征
李 明,陈君丽
(河南应用技术职业学院,河南 郑州 450042)
纳米金刚石以其优异的低模量、高硬度、高导热性、化学稳定性、生物相容性、可变表面化学性质和耐恶劣环境而闻名[1]。纳米金刚石的主要颗粒大致为球形,平均直径为4~6nm,粒径分布较窄[2]。纳米金刚石具有较大的比表面积(SSA)超过200m2/g,能被官能团覆盖。因此,与其他碳纳米颗粒相比,纳米金刚石提供了非常高的表面反应性[3]。但纳米金刚石由于分子间作用力大,以及分子间氢键等相关问题,往往不能均匀长期的分散,在聚合物基体中聚集体的形成,使纳米金刚石聚合物基质增强能力受到限制[4-5]。团聚使纳米金刚石在半导体硅片抛光领域等众多领域的应用受到了很大的影响。所以解决纳米金刚石的团聚问题是保证纳米金刚石独特优异性能能够被充分应用的关键。纳米金刚石的表面官能化不仅有助于解团聚,而且还改善了纳米金刚石和聚合物之间的界面结合[6]。利用化学分散方法对纳米金刚石表面进行官能化设计与改造,可以使接枝后的纳米金刚石表面的团聚力减小,并且在油性溶液或者水溶液中能够长期稳定的分散。进一步使纳米金刚石在抛光、润滑、生物医药领域得到较好的应用效果。本文主要研究通过对纳米金刚石进行多次表面基团反应,最后与1,3-丙二胺发生反应,得到能够稳定分散的纳米金刚石。
1 试验过程
1.1 试验药品
试验药品见表1。
1.2 纳米金刚石空气氧化及酸化的处理
纳米金刚石的优点很多,但是在生产过程中也会使得到的产物表面含有大量杂质,为了去除其表面杂质,同时在借鉴之前学者对纳米金刚石研究的前提下,我们需要对其进行加热,使其表面的金刚石变成石墨,氧化后的金刚石能够更加容易嫁接官能团。纳米金刚石的氧化是从596℃开始,大约在900℃完全氧化完成。

表1 试验药品
在天平上称取2g纳米金刚石,放入箱式炉子中设定温度为600℃,加热2h。称取加热后纳米金刚石1.032g,加入到500mL的三口烧瓶中,加入20mL蒸馏水,沿玻璃棒慢慢地将70mL浓硝酸引入到上述三口烧瓶中,最后沿着玻璃棒将100mL浓硫酸慢慢引入到浓硝酸与水的混合液中。将三口瓶放在超声波清洗仪中振荡5h,将恒温水浴锅的温度设置为70℃。在搅拌器的剧烈搅拌下回流24h。24h后关闭反应仪器,将三口烧瓶冷却至室温,然后将溶液放入离心沉淀器中离心沉淀,将离心后的上层溶液倒掉,然后加入蒸馏水混匀后继续离心,直到离心后的溶液显示中性为止。将离心至中性的上层溶液倒掉,把下面的金刚石放入电热鼓风干燥箱,设定温度为60℃干燥5h后得到0.664g灰色粉末,就是经过混酸修饰的纳米金刚石,记为NDCOOH。
1.3 氯化亚砜修饰酸化的纳米金刚石
取上一步酸化后经60℃干燥后的纳米金刚石0.600g,放入洗净并干燥的500mL的三口瓶中,然后用量筒量取30mL二氯亚砜,4mL N,N-二甲基甲酰胺,慢慢加入到三口烧瓶中,在超声清洗仪中超声振荡5h。然后在70℃的恒温水浴锅中,剧烈搅拌冷凝回流12h。将溶液冷却室温后经离心机离心,将离心管内的上面液体倒掉,之后放入烘箱中,设定温度为90℃,烘干5h,烘干后经研磨得到灰色粉末,就是经过二氯亚砜修饰之后的纳米金刚石,可用ND-COCl标记。
1.4 氯化亚砜修饰的纳米金刚石与1,3-丙二胺的反应
取上一步的氯亚砜修饰之后的纳米金刚石0.500g加入到洗净并干燥后的三口烧瓶中,然后依次往三口烧瓶中加入6mL 1, 3-丙二胺、50mL丙酮、60mL N,N-二甲基甲酰胺和5mL三乙胺,经超声分散5h后,放入70℃恒温水浴锅中,在剧烈搅拌的环境下回流24h。将溶液冷却室温后经离心机离心,将离心后的上层溶液倒掉,加入蒸馏水反复离心数次,以洗去反应过程中产生的铵盐。将液体倒掉之后放入烘箱中,设定温度为90℃,烘干5h,经研磨后并超声振荡得到纳米金刚石粉末,就是1,3-丙二胺修饰后的纳米金刚石,可标记为ND-NH2(图 1)。
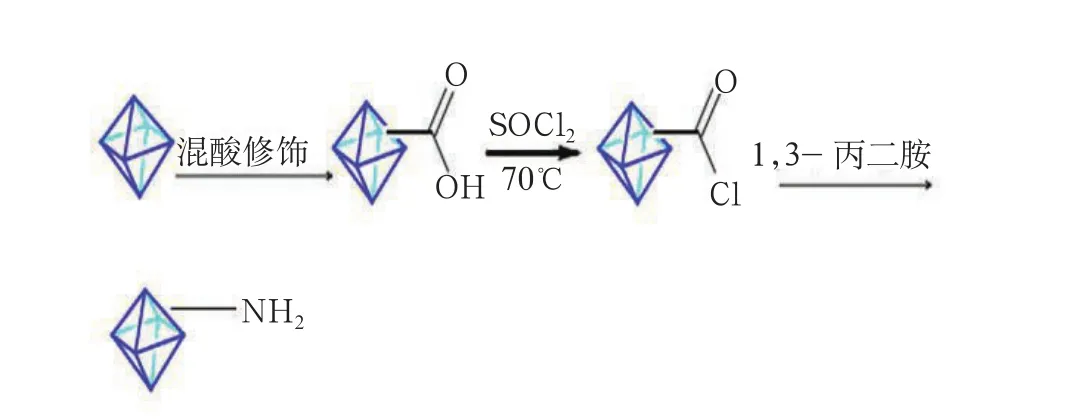
图1 纳米金刚石表面基团嫁接简易图
2 表征测试
2.1 红外光谱分析
制备红外光谱的试样,本次试验测试采用压片法。具体步骤为:把玛瑙研磨体用酒精擦拭干净,晾干;取金刚石0.8mg与少量溴化钾混合,充分均匀研磨;取少许粉末放入压膜中,在压力机中压成透光的薄片,把透光的薄片放入红外光谱一起中进行测试。用干净的溴化钾制造一个透光薄片进行对照试验,可以得到红外光谱图(图2)。
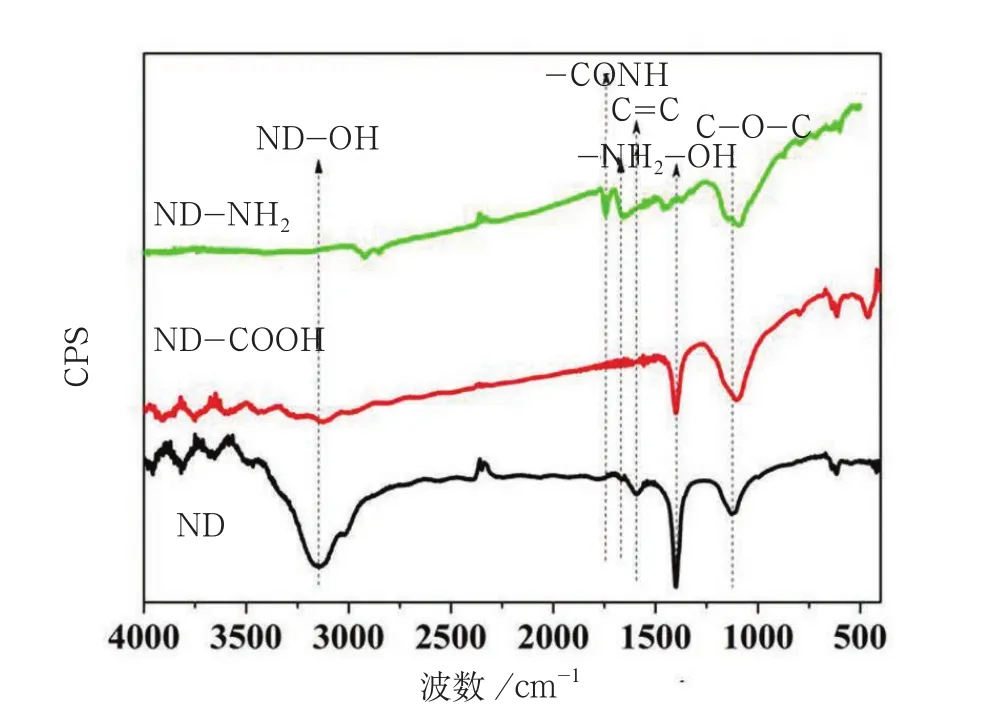
图2 嫁接1, 3-丙二胺后的纳米金刚石红外光谱图
在3 400~3 200cm-1的吸收频率一般为-OH缔合基团,振动形式为伸缩振动。ND-NH2和ND在稀硫酸溶液中的粒度分析见图3,图3中显示在ND的红外光谱图像中3 147cm-1有吸收频率,可以判定在ND表面含有-OH基团,经过混酸酸化后,该基团吸收强度明显下降,经过1,3-丙二胺修饰后的纳米金刚石该吸收峰消失。而1,3-丙二胺修饰后的纳米金刚石在1 737cm-1处出现吸收峰,可以认为该处的基团为-C=O。在1 650~1 560cm-1处的是-NH2,2 500~3 500cm-1也是NH2存在,而1,3-丙二胺修饰后的纳米金刚石只在1 656cm-1处出现吸收峰,可以认为是-NH2,振动形式为变形振动。一般在1 580cm-1处出现吸收峰的是-C=C,在ND中1 578cm-1处,出现吸收峰,表明在ND表面含有-C=C,经过混酸酸化后该处的吸收峰消失。在1 400cm-1处,ND和ND-COOH的谱图中共出现吸收峰,应该是存在羧基上的羟基,而在NDNH2上面没有吸收峰,表明ND-NH2表面的羟基被其他基团所取代,在1 126cm-1处都出现的吸收峰,一般在900~1 150cm-1处出现吸收峰表明是C-O-C,振动方式为伸缩振动。
图3 ND-NH2和ND 在稀硫酸溶液中的粒度分析
2.2 激光粒度分析
取蒸馏水9mL于烧杯中,再取98%的浓硫酸1mL,慢慢加入放有蒸馏水的烧杯中,充分混匀,配置浓度为10%的稀硫酸,在该溶液中加入0.010g改性过后的纳米金刚石;取蒸馏水9mL于烧杯中,再取98%的浓硫酸1mL,慢慢加入放有蒸馏水的烧杯中,充分混匀,配置浓度为10%的稀硫酸,在该溶液中加入0.010g未被改性的纳米金刚石。超声震荡后,用激光粒度分析仪进行粒度分析并制图,如图4和图5所示。
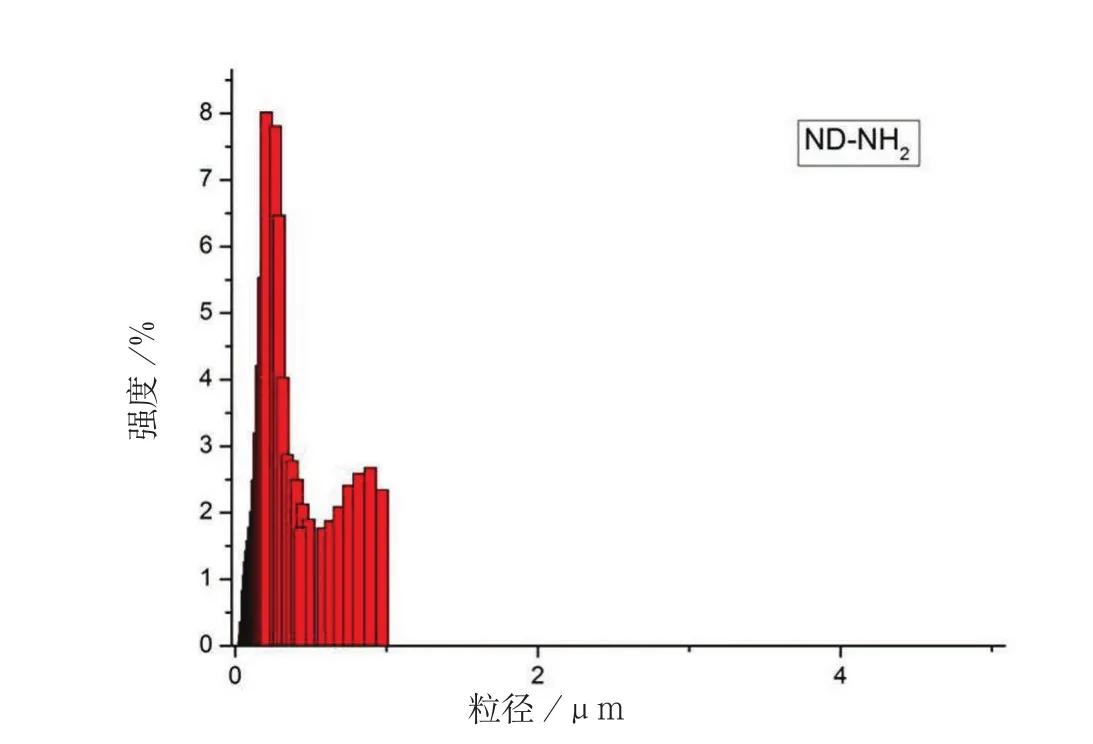
图4 ND-NH2在稀硫酸中的粒径分布柱状图
图4 所表示的是改性之后的纳米金刚石分布图,计算其平均粒径为0.329um,而图5所示的是未经过改性的纳米金刚石,计算其平均粒径为7.135um,改性前和改性后的纳米金刚石的平均粒径相差太大,可以说明改性后的纳米金刚石的在稀硫酸溶液中的分散性得到改善。
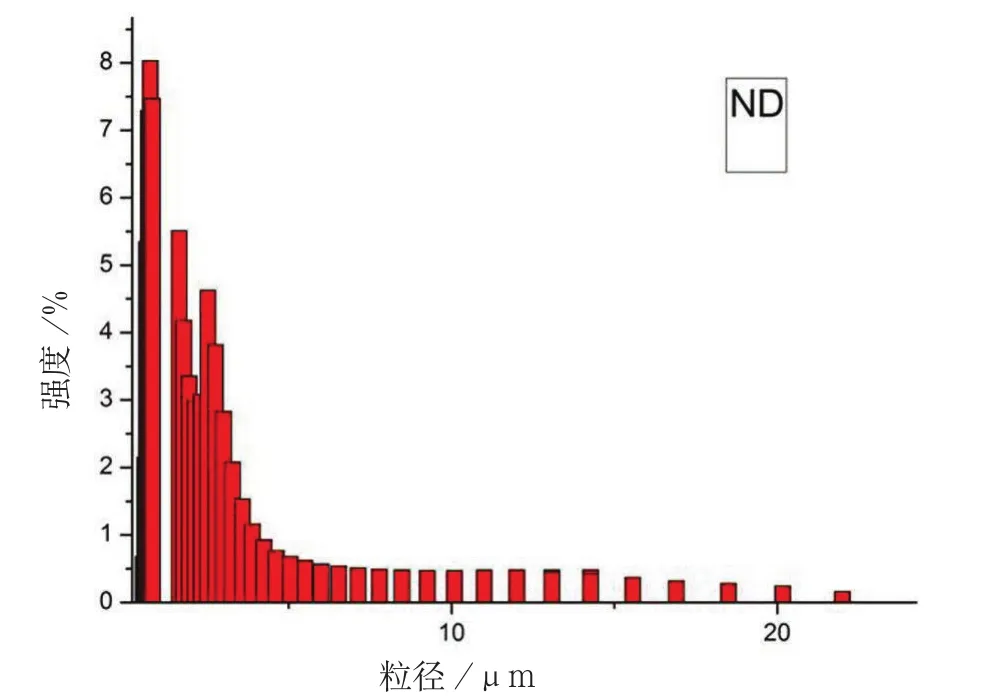
图5 ND在稀硫酸中粒径分布
2.3 分散性测试
分别取0.01g改性前后的纳米金刚石,放入小瓶中,在小瓶中加入9mL蒸馏水后慢慢加入1mL浓硫酸,观察改性前后的纳米金刚石在稀硫酸溶液中分散稳定性(图6)。离心5min后,通过观察发现,ND-NH2和ND在稀硫酸中的分散性有所差别,观察图6可以得知,左侧ND-NH2样品的分散液分布更加均匀,具有良好的分散性,而右侧ND样品的分散液已经开始出现轻微程度的沉降,说明NDNH2的分散性要明显优于ND。此外,将两种样品分散液静置1个月后,随着静置时间的延长,左侧ND-NH2样品的分散液呈半透明,ND虽然开始逐渐团聚,但样品分散液仍未完全沉降,而右侧ND样品分散液已完全沉降。通过该试验可以说明NDNH2在稀硫酸中的分散性要比ND在稀硫酸中的分散性好,同时具有较好的稳定性。

图6 ND-NH2和ND在稀硫酸中的分散性试验图
3 结论
通过对纳米金刚石嫁接1,3-丙二胺改性,并对改性前后的纳米金刚石进行红外谱图、粒度分布及分散性对比,可以得出1,3-丙二胺上的氨基可以与酸化和酰氯化之后的金刚石进行取代反应,使改性之后的纳米金刚石表面含有氨基。通过粒度分析及分散性测试,改性之后的纳米金刚石在稀硫酸溶液中的分散稳定性要比改性前的纳米金刚石的分散性好。改性纳米金刚石后合成出的1,3-丙二胺纳米金刚石衍生物ND-NH2,表面的团聚力明显减小,并且在稀硫酸溶液中能够形成长期的稳定的分散,此外,经1,3-丙二胺改性的纳米金刚石可溶于无机或有机酸水溶液,以及DMF、丙酮等有机溶剂,可以为纳米金刚石在抛光、润滑、生物医药领域进一步的应用研究提供一定的借鉴。

