儿童多发性大动脉炎10 例临床分析
邱灵芝 郭翼红 马慧慧 黄 娜 樊志丹 马 乐 俞海国
南京医科大学附属儿童医院风湿免疫科(江苏南京 210008)
多发性大动脉炎(Takayasu arteritis,TA)是一种病因不明的慢性进行性血管炎,主要累及大血管,尤其是主动脉及其主要分支,其特征是主动脉及其直接分支的跨壁肉芽肿性炎症。血管炎症导致血管壁增厚、纤维化、血栓形成,产生多种缺血性症状。多见于20~40 岁女性,发病率高,但儿童罕见,有显著的早期死亡风险。欧洲及美国的发病率为(0.4~2.6)/1000000,亚洲国家患病率>0.003%[1-2]。由于TA 症状非特异性,临床极易漏诊或误诊。本文回顾总结南京医科大学附属儿童医院收治的10例TA患儿的临床特点,探讨其临床特征和远期预后。
1 临床资料
回顾分析2014年1月至2019年6月,在南京医科大学附属儿童医院住院并确诊为TA的10例患儿的临床资料,包括病史、临床症状、体格检查、白细胞计数(WBC)、C反应蛋白(CRP)、红细胞沉降率(ESR)、血液生化、胸片、心脏彩超、核磁血管成像、血管B 超、治疗及预后等。
按照2010 年EULAR/PRINTO/PRES 关于TA 分类诊断标准[3],血管造影异常为必要条件。血管造影、CT 或磁共振成像(MRI)显示主动脉及其主要分支、肺动脉动脉瘤,动脉壁扩张、狭窄、闭塞或增厚,且非由动脉硬化、纤维肌发育不良或类似原因引起,同时符合以下5 项标准中的1 项即可诊断:①脉搏短绌或跛行,周围动脉搏动消失、减弱、不等或跛行,由身体活动引起的局部肌肉疼痛;②血压差,四肢收缩压压差>10 mmHg;③杂音,大动脉听诊杂音或可触摸到震颤;④高血压,收缩压/舒张压>P95;⑤急性炎症反应物,血沉>20 mm/h或CRP升高。
按照1996年血管造影新的分类表现,根据血管病变部位,TA可分为5型[4]:①Ⅰ型,累及主动脉弓分支。②Ⅱa型,累及升主动脉、主动脉弓及其分支;Ⅱb型,累及升主动脉、主动脉弓及其分支、胸主动脉、降主动脉。③Ⅲ型,累及胸主动脉、降主动脉、腹主动脉和/或肾动脉。④Ⅳ型,累及腹主动脉和/或肾动脉。⑤Ⅴ型,广泛型,包括IIb及Ⅳ型。采用National Institutes of Health 标准[5],至少2 项新近出现的症状或症状加重提示疾病活动:①全身症状,如发热或骨骼肌症状(未发现其他原因);②血沉增快;③血管缺血或炎症,如跛行、脉弱或无脉、血管杂音、四肢血压差;④典型血管造影异常。
10 例患儿中,男性5 例、女性5 例;发病年龄为3月龄~14.9岁,其中<1岁1例,~3岁2例,>3岁7例。所有患儿均无血管炎家族史。确诊时病程<1个月2例,~6 个月4 例,~12 个月3 例,>12 个月1 例。首次入院至确诊时间<1个月7例,6~12个月2例,>12个月1例。
4例患儿因反复发热、下肢疼痛、虹膜睫状体炎等收住风湿免疫科;2 例因高血压、四肢浮肿伴心力衰竭收住心内科;3例因头痛和/或腹胀伴高血压、呕吐、精神差收住重症监护室;1例因反复腹痛收住消化科。
本组常见临床症状为高血压8例、脉压差7例、血管杂音6例、发热6例、脉弱或无脉5例、跛行4例、头痛3例、腹痛3例。实验室检查中红细胞沉降率增快9例,C反应蛋白升高8例,白细胞计数升高7例(表1)。3例胸部X线摄片有心影饱满、心影增大;1例胸部CT可见纵膈及右肺门淋巴结伴钙化。10例患儿均行心脏彩超检查,发现瓣膜反流4例、心脏扩大3 例、瓣膜脱垂1例、肺动脉高压1例、主动脉壁毛糙1例。5例患儿行颈部血管B超,均提示血管壁粗糙、增厚、狭窄。
10 例患儿均行血管造影检查,均有主动脉受累,以腹主动脉最多见;5 例肾动脉管壁增厚、狭窄,1 例双侧冠状动脉扩张及肺动脉增粗,1 例主动脉及其分支扩张,1例腹主动脉远端扩张。根据血管造影,10例患儿的临床分型以Ⅴ型最为常见(6 例),其次为Ⅲ型3例,Ⅰ型1例。CT及MRI显示,病变分布广泛,累及多个部位,可存在多种影像学表现,如动脉扩张、管腔狭窄、管壁增厚等;升主动脉及主动脉弓明显增宽(图1),肾动脉水平以下腹主动脉及其分支明显变细狭窄(图2),腹主动脉上段明显变细(图3),主动脉血管壁增厚(图4)。

图1 例1 患儿心脏大血管增强CT 表现

表1 10例TA患儿实验室检查结果

图2 例2 胸腹部血管增强CT 表现
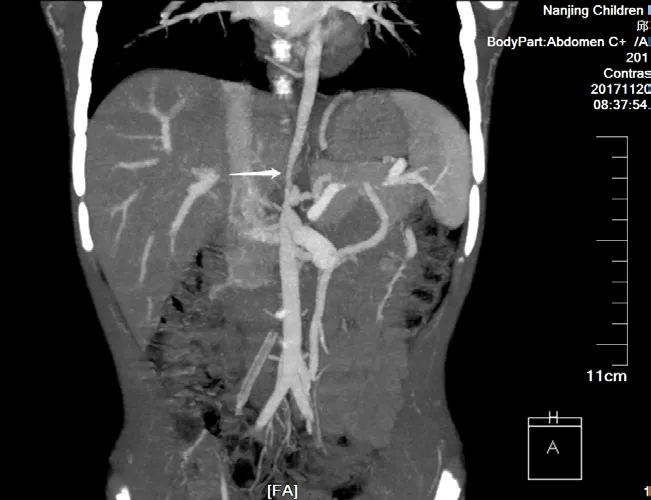
图3 例3 腹部血管增强CT 表现
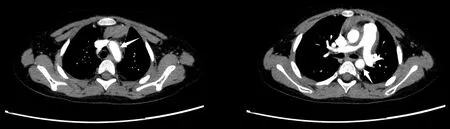
图4 例9 心脏大血管增强CT 表现
患儿确诊后,除1例自动出院未接受治疗外,其余9例均接受糖皮质激素或糖皮质激素联合免疫抑制剂治疗。3例单独口服足量糖皮质激素,4例以环磷酰胺作为首选免疫抑制剂,2 例以甲氨蝶呤作为首选免疫抑制剂。其中1 例对环磷酰胺、霉酚酸酯及甲氨蝶呤等效果均不佳,使用托珠单抗治疗。2例PPD强阳性及T-SPOT 阳性,诊断为潜伏结核感染,予异烟肼、利福平抗结核治疗3个月,复查T-SPOT转阴。
10例患儿中,1例首次确诊住院期间死亡,1例随访8个月死亡;2例失访;6例随访5个月~2年余,4例好转,2例病情无明显改善。
2 讨论
TA 由日本学者Takayasu 于1908 年首次报道,是一种主要累及主动脉及其主要分支的慢性肉芽肿性全层动脉炎,也可累及肺动脉和冠状动脉,造成主动脉弓管壁纤维性增厚及其分支远端管腔的狭窄或闭塞,最终导致血管重构,多数患者表现为管腔狭窄,少数为动脉扩张甚至瘤样形成[5]。虽然目前世界各地均有TA报道,但以亚洲及中东国家多见。
TA与感染(如结核分枝杆菌、链球菌、病毒等)后动脉血管壁上的变态反应有关。国外报道TA 患者的PPD 阳性率为20%~82%[6],国内报道PPD 阳性率为21.4%[7]。本组患儿中2例PPD及T-SPOT强阳性。
TA发病与遗传因素有关。HLA-B52是日本、韩国、印度、泰国和土耳其人群发病相关性最强的易感基因,该等位基因与左心室壁异常及主动脉反流高发病率和早期发病有关,而HLA-B39等位基因与肾动脉狭窄有关,HLA-B52:01与TA及溃疡性结肠炎相关[8],本组10例未行基因检测。
TA 可表现为全身非特异性症状和血管缺血性症状,如发热、头痛、高血压、肌肉疼痛、关节痛和晕厥、肢体跛行、无脉、血管杂音。脉博减弱和血管杂音在疾病晚期常见。本组中5 例脉搏减弱、6 例血管杂音,提示确诊时血管受累处于不可逆阶段。由于TA 症状不典型,漏诊率和误诊率很高。女性发病率和平均发病年龄均高于男性,性别差异可能与雌激素或遗传学的作用有关。既往报道最小发病年龄为1.5 月龄[9]。本组患儿男、女各5例,可能与样本量较小有关。最小发病年龄3月龄。3例婴幼儿TA中1例表现为发热、球结膜充血、皮疹、颈部淋巴结肿大及杨梅舌,抗感染治疗无效,CRP升高,ESR增快,诊断为川崎病,先后经丙种球蛋白、英夫利昔单抗及环孢素治疗,炎症指标持续升高,最终行血管造影确诊为TA,提示临床对于炎症标志物持续升高者,尤其婴幼儿,需警惕TA。
在TA 急性早期阶段诊断困难,部分原因是患者表现出非特异性症状,且缺乏特异性的免疫指标(如自身抗体或抗中性粒细胞浆抗体)或炎症标志物。本组患儿诊断TA的平均时间为2.5个月,这比之前土耳其报道的诊断时间提前10 个月[10],可能与近年来对疾病认识的加强及影像学检查多样化有关。
儿童TA 多数出现严重并发症,预后不良,病死率高低可能与地理位置、病变的严重程度和扩展程度、治疗策略、随访时间等有关。2000 年以前文献报道TA在儿童中病死率高达35%~40%[11]。近十年来,TA 患儿的病死率已下降到15%以下,如美国为3%、印度11%[12]。但2015年报道11例TA患儿的病死率为27%,其高病死率与发病年龄早相关[13];南非的研究则显示死亡与无法控制的全身高血压及手术并发症有关[14]。本组10例患儿中,病死2例(20%)。
高血压是TA 最常见的临床症状,通常继发于肾动脉狭窄,约70%~100%的患儿合并高血压。因此,对于不明原因的高血压,尤其是伴有急性期反应物水平升高者,应监测血压差或血管杂音。TA的其他临床症状包括头痛(31%)、发热(29%)、呼吸困难(23%)、体质量下降(22%)、呕吐(20%)和关节痛(14%~65%)等[12];不常见的表现有视网膜病变和皮肤病变,如结节、皮疹和淋巴结病;皮肤溃疡在儿童未见报道。本组患儿中高血压8 例,发生率也最高;其次为血压差7例、血管杂音6例、发热6例、脉弱或无脉5例、跛行4例、头痛3例、腹痛3例、关节痛2例、呕吐2例、呼吸困难1 例,1 例眼科检查有虹膜睫状体炎。文献报道TA患儿充血性心力衰竭发病率为37%~62%,本组患儿中1例发生心力衰竭。文献报道TA患儿肺动脉受累15%~70%、冠状动脉受累10%,本组血管造影显示肺动脉受累1例、双侧冠状动脉扩张1例。
TA的疾病活动度评估主要依据临床症状、体征、炎症指标及血管造影等进行,临床多以ESR、CRP等炎症指标判断治疗效果及预后,但已有研究发现ESR、CRP水平与病理获得的血管炎症并不平行。ESR比CRP敏感,但两者的敏感性和特异性均较差。有报道高血压联合ESR增快对诊断儿童TA敏感性较高[15]。本组患儿ESR、CRP 均明显升高(分别为9 例、8 例)。新型生物标志物pentraxin-3 是一种炎症反应时迅速产生的蛋白(尤其是内皮细胞炎症反应)。研究显示pentraxin-3水平>0.3 ng/mL,比CRP或ESR用来区分活动性和非活动性疾病更准确,但其有效性仍待进一步验证[16]。
糖皮质激素为TA的一线治疗。大部分TA患者需免疫抑制剂和生物制剂联合治疗。免疫抑制剂如甲氨蝶呤、环磷酰胺、硫唑嘌呤和霉酚酸酯等,对疾病持续缓解、减少糖皮质激素用量安全有效。回顾性研究显示,糖皮质激素联合环磷酰胺诱导缓解,甲氨蝶呤维持是一种有效和安全的治疗方案[3]。也有报道霉酚酸酯同样疗效显著[17]。本组9例接受治疗的TA患儿,糖皮质激素和环磷酰胺的使用率(分别为100%和56%)比之前报道的病例(分别为76%~100%和0%~52.9%)明显升高[11]。近年来研究显示,靶向生物制剂肿瘤坏死因子拮抗剂和抗IL-6 受体抗体对难治性TA 疗效显著。超过半数的患者需使用生物制剂治疗[18],其原因可能是疾病未能有效控制,或糖皮质激素相关性不良反应,或防止糖皮质激素减量及停用后疾病复发。IL-6是TA 免疫和炎症激活的关键因子,抗IL-6受体抗体托珠单抗可抑制IL-6 生物学效应,有效控制大动脉炎,降低复发率。本组中1 例患儿糖皮质激素联合免疫抑制剂效果不理想,经4 次输注托珠单抗后,CRP、ESR等炎症指标正常,血压控制尚满意,临床症状缓解。此外,有明确结核感染者需抗结核治疗。本组2例患儿PPD强阳性及T-SPOT阳性,予异烟肼、利福平抗结核治疗。主动脉或分支血管狭窄超过70%、缺血性脑血管病、主动脉瘤及夹层、严重的主动脉瓣反流及难治性高血压患者,则建议手术治疗[12]。本组病例均无手术指征。
综上,早诊断、早治疗是减少TA患儿并发症及改善预后的关键。对于急性炎症反应指标包括ESR 及CRP持续升高的患儿,尤其是婴幼儿,需高度警惕TA可能,应作全面细致体格检查,并及时行血管造影以明确诊断。

