豆酱白点物质组成及模拟发酵条件优化
闵世豪,单万祥,钮成拓,赵佳迪,郑飞云,刘春凤,王金晶,李崎*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(江南大学,酿酒科学与工程研究室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)
我国传统酿造调味食品普遍采用多菌种参与的开放式固态发酵或半固态发酵工艺,发酵周期较长,参与的微生物种类繁多,微生物群落在发酵过程中不断演替变化,从而完成大分子原料的降解、转化、代谢等过程[1]。豆酱发酵过程中豆类原料(如黄豆、蚕豆)中的蛋白质被微生物利用转化为多肽、氨基酸及其他营养物质,逐渐形成风味独特、营养丰富[2]且具有较高生物活性的发酵豆类产品[3]。在豆酱发酵过程中,特别是在发酵的中后期及储存期,会逐渐出现白色结晶状物质,被称为白点。这种白点物质在东、西方发酵食品中均被发现,在东方发酵食品中,主要出现在火腿[4]、泰式豆酱[5]、豆豉[6]、腐乳[7]和蚕豆酱[8]中,而在西方发酵食品中,主要出现在奶酪[9-11]中。
从20世纪初开始,研究者对豆酱中的白点物质组成就有了研究,最初有人推测其是草酸钙结晶[12],随着研究的深入,人们发现白点物质的主要成分是酪氨酸[4-11]。之前的研究[13]表明,在蚕豆酱中白点物质是由米曲霉(Aspergillusoryzae)产生的大量蛋白酶非定向切割蛋白原料产生过量酪氨酸形成的,可以通过筛选蛋白水解酶活性低的米曲霉来进行白点物质的防治。KRÖCKEL等[14]利用共聚焦拉曼显微镜定性分析证明,盐焗牛肉肠中白点物质主要成分是酪氨酸和苯丙氨酸,他认为是牛肉内自身的蛋白酶水解蛋白产生过量的酪氨酸,从而产生白点物质。孙军勇等[15]将有白点腐乳和无白点腐乳进行对比,证明腐乳白点的产生跟大豆蛋白质的过度水解有关。结合文献推测白点形成是由于蛋白酶过度水解产生过量酪氨酸[13-16],酪氨酸再进一步结晶形成白点。虽然对于白点有着众多研究,但是有针对性的解决方案却不多,主要因为酪氨酸是蛋白质分解的产物,控制酪氨酸的生成就会导致蛋白质分解不彻底,从而影响发酵产品的风味。
目前我国豆类发酵食品最常用的发酵菌株为米曲霉,其中米曲霉3.042具有丰富的酶系,产蛋白酶酶活力较高,是酱油、豆酱等发酵食品的主要生产菌株[17-18]。基于该菌株发酵生产豆酱的前期研究[19],本研究对豆酱中的白点物质进行氨基酸分析。在此基础上,以大豆分离蛋白(soy protein isolate, SPI)培养基模拟酱醅环境,并接种米曲霉3.042菌株进行模拟发酵,测定其发酵液中酪氨酸浓度及蛋白质分解程度,并通过改变发酵条件来控制酪氨酸的生成和蛋白质的降解情况,从而获得控制豆酱发酵过程中酪氨酸浓度的发酵条件。
1 材料与方法
1.1 材料与试剂
SPI、麸皮,市售;可溶性淀粉、甲醛、NaOH、三氯乙酸、甲醇(色谱级),国药试剂;无水乙酸钠(色谱级),上海阿拉丁生化科技股份有限公司;酪氨酸(色谱级),北京索莱宝科技有限公司。
1.2 仪器与设备
氨基酸专用高效液相色谱仪、高效液相色谱仪,安捷伦科技有限公司;分析天平,无锡凯派克斯科技有限公司;电子天平,梅特勒-托多仪器有限公司;BSP-250生化培养箱,上海博讯公司。
1.3 培养基与菌株
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,121 ℃灭菌15 min。
活化培养基:麸皮50 g,蒸馏水500 mL, 115 ℃灭菌15 min。
SPI培养基:SPI 5 g/L,可溶性淀粉1 g/L,115 ℃灭菌15 min。
Aspergillusoryzae3.042为我国传统发酵食品常用菌株,保存于本实验室。
1.4 试验方法
1.4.1 白点物质的提取及氨基酸测定
将产白点黄豆酱在25目标准筛上摊开,用镊子将白点物质取出,用无菌水冲洗后置于干净的烧杯中,80 ℃烘干。
游离氨基酸及水解氨基酸的前处理步骤参照卫阳飞等[20]方法,具体步骤如下:
游离氨基酸测定:取精确称量1 g样品,并用50 g/L 三氯乙酸溶解于25 mL容量瓶中。常温超声20 min,静置2 h后,将上清液双层滤纸过滤,取1 mL过滤液于1.5 mL离心管中,12 000 r/min离心10 min,用0.22 μm水膜再过滤1次,取400 μL过滤液于液相样品瓶。
水解氨基酸测定:称取100.0 mg充分干燥的白点物质于水解管,加入8 mL 6 mol/L HCl。向水解管中充入氮气约3 min,调节流速,使溶液呈微沸状态,拧紧水解管盖子.将水解管放入120 ℃烘箱中,水解22 h后,将水解管样品全部转移至25 mL容量瓶,加入4.8 mL浓度为10 mol/L的NaOH溶液,定容,使用双层滤纸过滤容量瓶中的溶液,取1 mL澄清滤液于1.5 mL离心管中,12 000 r/min离心10 min,取上清液约500 μL(可通过0.22 μm水膜再次过滤)于液相取样瓶。
分析条件:氨基酸组成分析在Agilent 1100系列HPLC系统上进行,注射体积为5 μL。色谱分离在C18柱(4.0 mm×125 mm)中进行,流速为1 mL/min,温度为40 ℃。洗脱系统为20 mmol/L乙酸钠(A)和V(20 mmol/L乙酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2混合溶液,监测器波长为338 nm和263 nm。
1.4.2 菌株培养
用无菌水从PDA培养基斜面上收集米曲霉孢子,获得浓度为107孢子/mL的孢子悬液。取5 mL孢子悬液接种于50 g的麸皮培养基中,于30 ℃下培养48 h。取200 mL无菌水加入活化完成的培养基中于30 ℃水浴、180 r/min条件下振荡30 min;用8层纱布过滤得到活化后的孢子悬液,将此孢子悬液以1∶3(V∶V)的比例加入含80、100、120 g/L(盐的质量浓度)的SPI培养基中,于不同温度(25、30、35、40 ℃)下培养70 h。
1.4.3 发酵液中酪氨酸的测定
取1 mL发酵液与1 mL 100 g/L三氯乙酸溶液混合,静置1 h,12 000 r/min离心10 min,取1 mL上清液,使用0.22 μm水膜再次过滤后置于液相瓶,采用HPLC进行酪氨酸分析。
分析条件根据纪传侠的方法[21]并进行优化,色谱分离在C18柱(250 mm×4.6 mm,5 μm)中进行,流动相为0.1 mol/L的醋酸钠溶液,流速为1 mL/min,温度为30 ℃,紫外检测波长为280 nm。
1.4.4 发酵液中氨基酸态氮的测定
根据GB5009.235—2016中氨基酸态氮测定方法进行调整。取5 mL上述发酵液于50 mL烧杯中,加入15 mL无菌水,用0.05 mol/L的NaOH标准溶液滴定至pH为8.2,加入2.5 mL甲醛,继续滴定至pH为9.2。根据公式(1)计算氨基酸态氮的含量。
(1)
式中:X,试样中氨基酸态氮的含量,g/100 g;V3,加入甲醛后消耗NaOH标准滴定液的体积,mL;V4,试剂空白试验中加入甲醛后消耗NaOH标准滴定液的体积,mL;V,试样稀释液的取用量,mL;c,NaOH标准滴定液的浓度,mol/L。
为表征发酵液中酪氨酸与蛋白分解程度之间的线性关系,定义k值,其计算公式如下:
(2)
k值越大表明酪氨酸在发酵液总氨基酸中占比越小,k值越小表明酪氨酸在发酵液总氨基酸中占比越大。
2 结果与分析
2.1 豆酱中白点物质的氨基酸分析
根据表1数据计算发现,豆酱来源白点物质游离氨基酸所占比例为40.96%,其中酪氨酸和苯丙氨酸为主要的游离氨基酸,两者占总游离氨基酸的比例分别为87.61%和1.74%。白点物质中水解氨基酸占78.90%,其中酪氨酸和苯丙氨酸为主要的水解氨基酸,两者占总水解氨基酸的比例分别为94.83%和2.33%。由此可见,白点物质主要成分为酪氨酸和苯丙氨酸,以游离态或者短肽、蛋白的形式存在,其余21.10%的组分可能是一些豆皮、辣椒籽等杂质。进一步计算发现,短肽中酪氨酸和苯丙氨酸所占比例分别为94.89%和2.75%。上述结果说明白点物质主要由游离酪氨酸、游离苯丙氨酸和富含酪氨酸和苯丙氨酸的短肽组成。前期研究证实,豆酱白点主要为游离酪氨酸和苯丙氨酸,而本文首次提出白点物质除了游离酪氨酸和苯丙氨酸之外,还存在大量富含酪氨酸和苯丙氨酸的短肽。

表1 豆酱中白点物质的游离氨基酸和水解氨基酸分析Table 1 Analysis of free amino acids and hydrolyzed aminoacids in white spots isolated from soybean paste
2.2 模拟发酵中酪氨酸的变化
在豆酱发酵过程中,蛋白质降解程度是衡量豆类原料发酵程度的重要指标,通常采用氨基酸态氮来表征,氨基酸态氮含量越高,豆酱的风味和品质越佳。然而,当蛋白质降解程度过高时,酪氨酸(酪氨酸在大豆中占比约为1.2%[22])会显著累积,其含量会超过其溶解度(25℃,0.45 g/L),最终形成白点。控制适当的蛋白质降解程度有助于在保证豆酱品质的同时减少白点物质产生的几率,因此,将模拟体系中盐的最终质量浓度分别调整为80、100、120 g/L,并分别在25、30、35和40 ℃条件下发酵,同时对模拟发酵体系发酵过程中的氨基酸态氮含量和酪氨酸含量进行检测。
2.2.1 发酵过程中酪氨酸含量及氨基酸态氮变化分析
对模拟体系发酵过程中的酪氨酸含量进行分析,发现酪氨酸的含量呈迅速增加到缓慢增加的变化趋势,且在发酵50 h后趋于稳定(图1)。当模拟发酵体系的盐度发生变化时,酪氨酸含量并没有明显的变化;但是当发酵温度发生变化时,不同盐度条件下的模拟体系中酪氨酸含量均随温度升高而逐渐提高。这可能是由于在活化培养基中米曲霉所产生的特异性或非特异性切割酪氨酸的蛋白酶的最适温度为40 ℃,在该温度下,酶活力高于25、30和35 ℃的酶活力,从而导致蛋白质降解程度提高,酪氨酸含量显著高于其他温度。
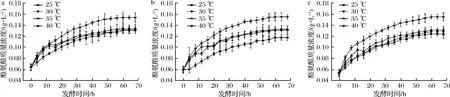
a-80 g/L盐度;b-100 g/L盐度;c-120 g/L盐度图1 模拟酱醅发酵过程中酪氨酸质量浓度的变化Fig.1 The change of tyrosine during the fermentation of simulated soy sauce mash
氨基酸态氮是判断酱醅发酵是否合格的重要指标之一,本研究用氨基酸态氮来表征发酵液中蛋白质分解程度。由图2所示,氨基酸态氮含量受盐度影响较小,而受温度影响较大。氨基酸态氮含量增长趋势与酪氨酸含量变化趋势相似,这同样可能是因为活化米曲霉所产生的蛋白酶在发酵时期开始作用,其酶活力随温度增加而增大,研究发现,在25~40 ℃米曲霉蛋白酶活力逐渐增加[23],这也使得氨基酸态氮含量增加,也就是发酵液中蛋白分解程度增加。此前研究表明盐度对于氨基酸态氮的影响也并不大,而温度是影响氨基酸态氮及风味物质的主要原因[24]。综上,温度对于豆类发酵中蛋白分解程度存在着较大影响。

a-80 g/L盐度;b-100 g/L盐度;c-120 g/L盐度图2 模拟酱醅发酵过程中氨基酸态氮质量浓度的变化Fig.2 The change of amino acid nitrogen during the fermentation of simulated soy sauce mash
2.2.2 发酵过程中酪氨酸与氨基酸态氮相关性分析
根据上述研究结果,发现豆酱模拟发酵体系中酪氨酸的累积与蛋白分解程度的增长密切相关,但是两者之间的关系尚未明确。将不同盐度和不同温度下模拟发酵液中酪氨酸含量及氨基酸态氮含量进行线性拟合。从图3及表2可以看出,盐度对于k值几乎没有影响,而温度对k值有重要影响。当温度为40 ℃时,3个盐度下的k值显著低于其他温度下的k值,说明在相同蛋白分解度下40 ℃下发酵会产生更多的酪氨酸。在其他温度下拟合得到曲线的k值差异较小。

a-80 g/L盐度;b-100 g/L盐度;c-120 g/L盐度图3 模拟酱醅发酵过程中酪氨酸与氨基酸态氮质量浓度的相关性分析Fig.3 Correlation analysis of tyrosine and amino acid nitrogen

表2 模拟酱醅发酵过程中酪氨酸与氨基酸态氮线性拟合方程Table 2 Linear fitting equation of tyrosine and aminoacid nitrogen in simulated soy sauce fermentation
根据表3所示,对比不同发酵条件下拟合曲线得到的k值,发现在30 ℃、100 g/L盐度的条件下,k值较大,这说明在同一蛋白分解程度下,酪氨酸含量相对较少。因此,在此条件下进行豆酱发酵,即能保证氨基酸风味又能对酪氨酸含量进行有效的控制。
3 结论
豆酱是我国传统发酵调味品之一,而其白点问题由来已久,以前的大部分研究都认为白点物质是由酪氨酸形成的,本研究认为,它的主要成分并不是完全由游离酪氨酸组成,而是由游离酪氨酸和富含酪氨酸的短肽形成的。与此同时,通过改变模拟发酵条件,发现温度是影响酪氨酸含量及蛋白分解程度最主要的因素,在30 ℃、100 g/L盐度下进行发酵,可以在保证较高蛋白质分解程度的前提下尽量减少发酵产品中酪氨酸的含量。本研究对豆酱行业白点问题的控制及解决具有一定的指导意义。

