豆瓣酱工业发酵过程中生物胺的生成规律
李东蕊,刘红霞,吴剑荣,夏小乐*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡, 214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
豆瓣酱是一种中国传统调味品,发酵过程经历多个阶段,期间多种微生物参与发酵反应[1-2]。豆瓣酱中含有丰富的营养物质,具有补中益气,开胃健脾等功效。然而,目前工业规模豆瓣酱生产依旧是相对开放的发酵体系,环境因素容易对豆瓣酱产品质量稳定性产生一定影响,其中微生物代谢会造成有害物质的积累[3],如产生生物胺、黄曲霉毒素等。
生物胺是一类具有生物活性且含氮的低分子量的有机化合物,主要通过微生物氨基酸脱羧作用产生[4-5]。生物胺具有促进DNA、RNA和蛋白质的合成,加速生物体的生长发育等作用,然而过量摄入可能会引发头痛、中毒等健康问题,严重的甚至危及生命[6-7]。生物胺广泛存在于几乎所有的发酵食品中[8],如发酵豆制品[9-10]、酒精饮料[11]、乳制品[12]等。它的生成受多种因素影响,如含水量、温度、pH等,主要是通过影响产胺微生物或者氨基酸脱羧酶的活性来实现[13-14]。曾雪晴等[15]对不同种类豆瓣酱中生物胺含量与理化指标之间进行了分析,然而目前仍缺乏对豆瓣酱工业发酵过程中生物胺生成规律及其与品质指标之间关系的研究。
本研究主要探究豆瓣酱工业发酵过程中生物胺的生成规律,同时对生物胺与理化指标(含水量、pH、总酸、氨基态氮及盐度)及氨基酸之间的相互作用和关系进行了研究和分析,在此基础上,对控制豆瓣酱中生物胺含量及提高豆瓣酱品质进行初步探讨。
1 材料与方法
1.1 材料与仪器
发酵中的豆瓣酱样品,四川某豆瓣酱厂。豆瓣酱生产及取样点如图1所示,每个批次取8个样品,分别对应于0、2、5、8、14、20、26、32 d。
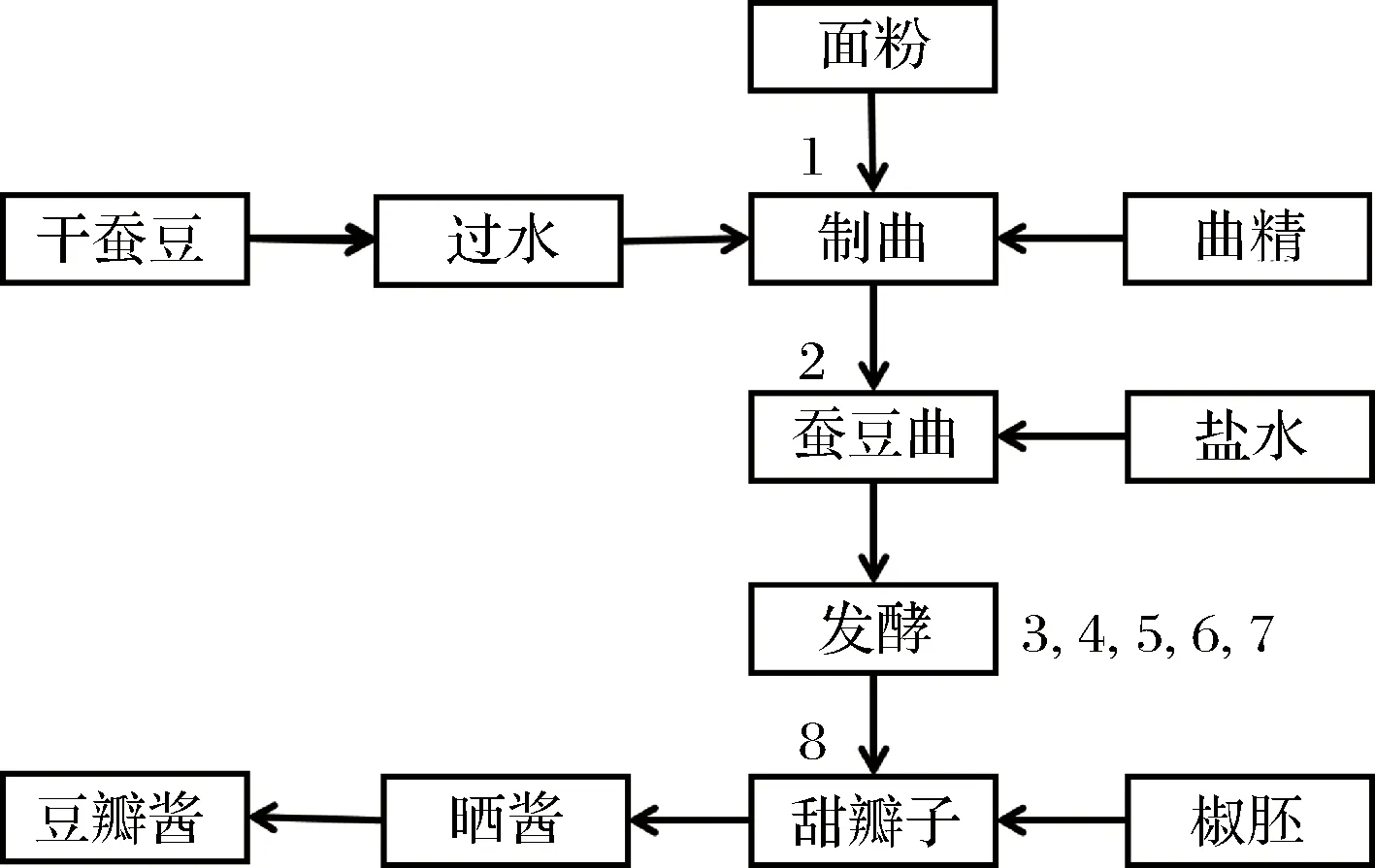
1-0 d;2-2 d;3-5 d;4-8 d;5-14 d;6-20 d;7-26 d;8-32 d图1 豆瓣酱发酵过程和取样点Fig.1 Fermentation and sampling processes of broadbean paste
标准品: 组胺、色胺、β-苯乙胺、腐胺、尸胺、酪胺、精胺、亚精胺、1,7-二氨基庚烷,美国Sigma-Aldrich公司;丹磺酰氯,梯希爱(上海)化成工业发展有限公司;乙腈(HPLC级)、丙酮、HCl、 NaOH、甲醛、AgNO3、铬酸钾等,中国医药集团化学试剂有限公司。
HITACHI chromaster高效液相色谱仪,日本日立公司;超声波清洗仪(SB-4200DT),宁波新芝生物科技股份有限公司;电热恒温水槽(DK-8D),上海精宏实验设备有限公司;电子天平(AS220.R2),波兰RADWAG Wagi Elektroniczne公司;pH计(FE28),梅特勒-托利多仪器(上海)有限公司;台式高速离心机(TG 1850-WS),上海卢湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 生物胺标准溶液的配制
参照GB 5009.208—2016[16],将样品稀释成不同质量浓度的标准品工作液,分别为1、2.5、5、10、15、25、50 mg/L。
1.2.2 样品的前处理及生物胺检测方法
样品的前处理方法参照文献[17]。标品及处理后的样品按以下色谱条件进行进样分析:
色谱柱为Diamonsil plus C18柱(250 mm×4.6 mm, 5 μm),柱温30 ℃,流速0.80 mL/min,进样量10 μL,检测波长254 nm。流动相A为乙腈, B为超纯水,洗脱程序见表1。
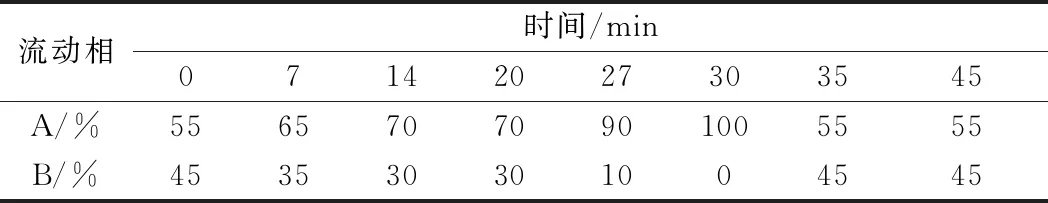
表1 梯度洗脱程序Table 1 Gradient elution program
1.2.3 豆瓣酱中理化指标及氨基酸的检测
含水量的检测参照GB 5009.3—2016[18],pH的检测参照文献[19],氨基酸态氮、总酸的测定参照GB 5009.235—2016[20],食盐的检测参照GB/T 5009.40—2003[21],氨基酸含量的检测参照文献[22]。
1.3 数据分析
每个实验重复3次,数据表示为平均值±标准误差。使用Origin 2016 软件进行绘图;使用SPSS 19.0 软件对生物胺与理化指标(含水量、pH、总酸、氨基酸态氮和盐度)和氨基酸进行相关性分析。
2 结果与分析
2.1 豆瓣酱发酵过程中生物胺含量变化
2.1.1 生物胺检测的标准曲线
取生物胺标准品使用溶液,根据上述实验方法进样分析,以峰面积比为纵坐标,生物胺质量浓度为横坐标,得到8种生物胺的线性回归方程和相关系数R2,见表2。由实验结果可知,8种生物胺的出峰时间表明此方法具有较好的分离效果。标准溶液质量浓度在1~50 mg/L线性范围内,相关系数R2均大于0.999,表明8种生物胺质量浓度与峰面积之间均存在良好的线性关系。

表2 生物胺的出峰时间、线性方程及相关系数Table 2 Retention time, regression equations andcorrelation coefficients of biogenic amines
2.1.2 豆瓣酱发酵过程中生物胺含量的变化规律
豆瓣酱工业发酵主要有制曲、甜瓣子发酵及混合椒胚晒酱3个阶段。本实验前期对椒胚、晒酱中及晒酱结束阶段的生物胺含量进行检测,结果发现,生物胺含量在晒酱过程基本没有变化,所以研究重点集中在豆瓣酱发酵过程中的制曲阶段和甜瓣子发酵阶段。
从图2可以看出,在豆瓣酱工业发酵过程中,主要的生物胺是腐胺、亚精胺与精胺。总生物胺含量在制曲阶段上升后,随着加盐溶液发酵的进行逐渐降低。色胺只在豆瓣酱发酵第8天被检测到,且含量较低。腐胺在第0天为50.67 mg/kg;制曲结束后,迅速升至最大值134.96 mg/kg;在第5天骤降,这是由于添加了盐溶液起到了一定的稀释作用,同时部分腐胺可能转化为亚精胺,随着发酵的进行腐胺逐渐降低至26.42 mg/kg。而亚精胺与精胺则在第0天存在,制曲结束后降低至5 mg/kg以内,可能由于在制曲阶段转为腐胺的原因。在加盐溶液进行发酵后,亚精胺与精胺逐渐增加至20 mg/kg左右,含量变化不明显,可能由于腐胺在一定条件下作为前体物质转化为亚精胺和精胺,这与上述所说腐胺含量随着发酵的进行而逐渐降低结果相符合。

图2 豆瓣酱发酵过程中生物胺的含量变化Fig.2 Changes of biogenic amine content during the fermentation of broad bean paste
2.2 豆瓣酱发酵过程中理化指标的变化及其与生物胺相关性分析
对豆瓣酱工业发酵过程中理化指标进行检测,结果如图3所示。豆瓣酱工业发酵过程中含水量在17.7%~ 43.97%之间变化,在制曲结束时,含水量急剧下降至17.7%,而在加盐水进行发酵后,含水量又上升至40%以上。氨基态氮含量在整个发酵阶段基本上呈逐渐上升趋势,发酵结束达0.631 g/100 g。总酸在发酵过程中也呈逐渐上升趋势,但在发酵结束时略微下降。而盐度在发酵过程中变化不大,在9.2~9.52 g/100 g之间。pH在发酵过程由5.45逐渐下降至4.98,说明豆瓣酱工业发酵过程整体呈轻微酸性,符合微生物生成生物胺的pH条件[23]。
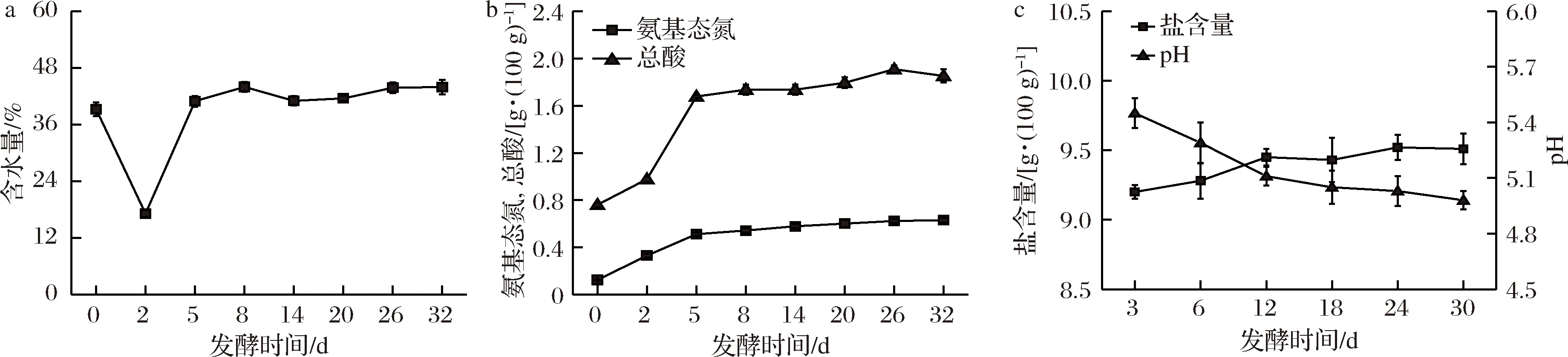
a-含水量;b-氨基态氮、总酸;c-盐含量、pH图3 豆瓣酱发酵过程中理化指标的变化Fig.3 Changes of physicochemical indexes during the fermentation of broad bean paste
对豆瓣酱工业发酵过程生物胺含量和理化指标进行相关性分析(person),如表3所示。双变量分析结果表明,腐胺则与含水量、pH、盐度具有很大的相关性。而亚精胺与含水量、氨基态氮、总酸及盐度均显著相关。总生物胺含量与含水量、pH、氨基态氮、总酸及盐度显著相关。在低pH条件下,微生物为了抵抗酸胁迫,易于形成生物胺[24],而豆瓣酱发酵过程总生物胺和腐胺与pH均呈现正相关,可能是由于豆瓣酱属于开放式混菌发酵体系,反应较为复杂。

表3 豆瓣酱发酵过程中环境变量与生物胺的相关性Table 3 Correlations between environmental variablesand biogenic amines during the fermentation of thebroad bean paste
注:r为皮尔逊相关系数,P<0.05为显著相关
2.3 豆瓣酱发酵过程中氨基酸含量的变化及其与生物胺相关性分析
生物胺的积累依赖于有丰富的氨基酸前体的存在,为了探究生物胺与其前体氨基酸的关系,对发酵过程中游离氨基酸含量进行检测。从图4可以看出,豆瓣酱工业发酵过程中主要游离氨基酸有谷氨酸、精氨酸、赖氨酸、亮氨酸、天冬氨酸等。总游离氨基酸含量在制曲阶段略有下降后,但随着发酵的进行又逐渐上升。而精氨酸和鸟氨酸作为腐胺的前体氨基酸,在制曲阶段急剧下降,这与之前得到的腐胺在制曲阶段急速上升的结果一致。同时精氨酸在加盐水发酵后上升至0.351 g/100 g,然后随着发酵的进行逐渐降低,可能由于加盐水发酵,腐胺的生成受到抑制导致精氨酸的积累,随着发酵的进行又经AgDI途径生成腐胺,并进一步在亚精胺合成酶的作用下生成亚精胺以及精胺。
对豆瓣酱工业发酵过程中生物胺与其前体物质进行相关性分析(表4)。结果表明,精氨酸作为腐胺的前体,与腐胺有一定的负相关性,与亚精胺显著正相关;而腐胺作为亚精胺的前体与亚精胺也呈现一定的相关性;其他生物胺与其前体之间没有显著相关性。所以,在一定程度上,游离氨基酸作为生物胺的前体物质与生物胺之间有较强的联系,控制豆瓣酱发酵过程中游离氨基酸的含量可能成为一种控制生物胺的手段。
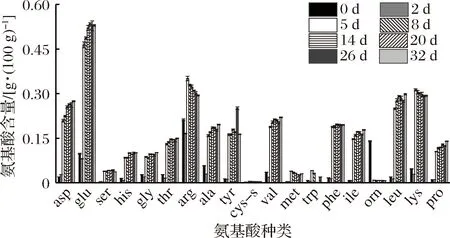
图4 豆瓣酱发酵过程中游离氨基酸含量Fig.4 Contents of free amino acids during the fermentation of broad bean paste
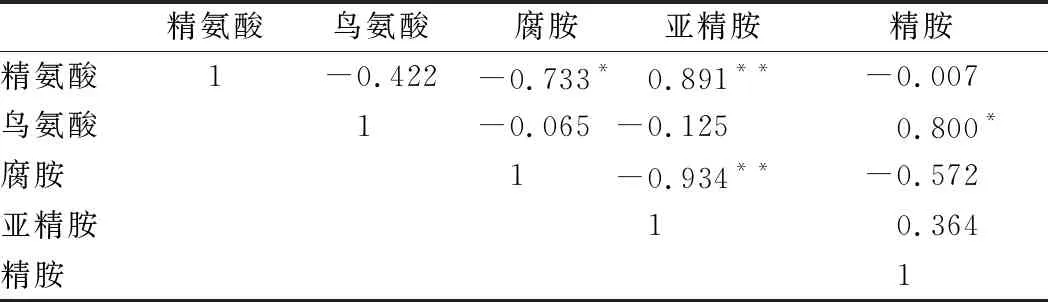
表4 豆瓣酱发酵过程中氨基酸与生物胺的相关性研究Table 4 Correlations between amino acids and biogenicamines during the fermentation of the broad bean paste
注:*表示在 0.05 水平(双侧)上显著相关;**表示在0.01 水平(双侧)上显著相关。
3 结论
为了探究豆瓣酱工业发酵过程中生物胺的生成规律,本研究采用高效液相色谱对豆瓣酱发酵过程中生物胺含量进行检测,结果表明,豆瓣酱发酵过程中主要生物胺为腐胺、亚精胺与精胺;腐胺在第0天为50.67 mg/kg,制曲结束后,迅速升至最大值134.96 mg/kg,随着发酵的进行腐胺逐渐降低至26.42 mg/kg。而亚精胺与精胺则在第0天存在,制曲结束后降低至5 mg/kg以内,随后逐渐增加至20 mg/kg左右,变化不明显。
本研究通过对理化参数和各种生物胺含量的相关分析,探究环境因素对各种生物胺的影响。在豆瓣酱发酵过程中,腐胺与含水量、pH、盐含量具有很大的相关性;而亚精胺与含水量、氨基态氮、总酸及盐含量均显著相关。总生物胺含量与含水量、pH、氨基态氮、总酸及盐含量显著相关。而豆瓣酱在发酵过程中,精氨酸与腐胺有一定的相关性,与亚精胺显著相关;而腐胺与亚精胺呈显著相关,其他生物胺与其前体之间并没有显著相关性。然而豆瓣酱发酵是一个复杂开放的混菌发酵体系,因此想要清晰生物胺形成规律的具体原因,未来需进一步研究微生物对发酵豆瓣酱中生物胺生成的具体影响,以期从微生物角度去调控生物胺的含量。

