新生儿膈疝胸腔镜治疗后存活率的影响因素分析
于斯淼 马立霜 王 莹 李景娜 刘 超 魏延栋 曲 东 张 辉 潘守东
先天性膈疝(congenital diaphragmatic hernia,CDH)是指先天性膈肌结构缺损,腹腔内容物疝入胸腔压迫肺和心脏,可导致肺发育不良和肺动脉高压,缺损通常位于左后外侧(即Bochdalek疝),新生儿CDH死亡率高。既往研究报告中,最高存活率为80%,大多数在40%~60%之间,基于人口学统计的研究中CDH死亡率约50%[1]。膈肌修补手术是治疗CDH的根本手段。随着胸腔镜手术技术和新生儿危重症CDH围术期管理水平的提高,目前在国际先进诊疗中心,对于有丰富腔镜操作经验的术者来说,首选腔镜治疗的观点逐渐得到认可[2]。本文将针对新生儿膈疝胸腔镜治疗后存活率的影响因素进行分析。
材料与方法
回顾性分析首都儿科研究所附属儿童医院2014年4月至2019年12月期间,在普通(新生儿)外科诊疗的58例新生儿先天性膈疝患者资料。
产前诊断为CDH的患儿,均于产前到新生儿外科门诊咨询,新生儿外科医生与家属充分沟通,使家属了解CDH诊疗流程及预后情况,获得家属对产前、生后治疗过程的配合和理解;新生儿外科医生产房待产;生后产房即刻气管插管,胃肠减压;温和通气,尽量保持峰压低于25 cm H2O,经绿色通道转运至我中心SNICU。入院后完善术前检查,如胸腹X线片、超声心动图等,明确诊断并了解疝入胸腔脏器情况,了解有无合并心脏畸形及肺动脉高压。
手术是唯一能够根治CDH的手段。生后24 h评估患儿是否符合手术指征,即平均动脉压40~45 mmHg;FiO2<50%时,导管前O2饱和度>85%;pH>7.25;导管后PaO2>30mmHg,PaCO245~65 mmHg;乳酸<3 mmol/L;每小时尿量>1 mL/kg。首选胸腔镜手术;如手术过程中患儿心肺功能不稳定难以控制,PaCO2持续高于65~75 mmHg时,则考虑适时中转开放手术;如患儿麻醉过程中侧卧体位致心肺功能难以稳定,则选择直接开放手术[3]。
以左侧Bochdalek疝为例,手术方法如下:取右侧卧位,3孔法放置trocar,于肩胛下角第6肋间置入视镜,第6~7肋间肩胛下角线与脊柱连线中点和第6~7肋间与左腋前线交点分别置入2个3 mm trocar。建立CO2人工气胸,胸腔压力4~6 mmHg,轻柔还纳脏器。采用3-0 proline线从膈肌缺损中部起始缝合第一针,以阻止腹腔脏器复还至胸腔,打结应松紧适度,不宜过紧以免勒断肌纤维,造成术后复发。间断缝合膈肌缺损,针距约0.7 cm,缘距0.5 cm。如膈肌发育差、缺损大,使用弯钳测量膈肌缺损长径和横径后,于体外裁剪好生物补片,经套筒置入胸腔,于胸腔镜下以4-0 PDS线间断缝合补片与膈肌固定。于靠近脊柱侧戳孔置入胸腔引流管。
术后予以呼吸机辅助通气,严格限制液量,镇痛镇静,应用血管活性药,维持血糖及循环稳定等措施。新生儿期膈疝患儿住院时间较长,多合并呼吸系统感染,及时行抗感染治疗,避免呼吸功能恶化。
患儿于术后1周、2周、1个月、3个月、6个月、12个月门诊复查,之后酌情每1~2年复查1次。观察患儿一般情况,复查胸部X线片、肺功能、胸部CT,门诊查体观察患儿呼吸频率、运动能力、智力发育水平,指导患儿家长呼吸功能锻炼方法和程度。对发现的问题及时进行纠正。

结 果
58例CDH患儿中,男34例,女24例;左侧47例,右侧11例。产前超声筛查诊断出胎儿CDH共50例,占总经治量的86.2%;8例因生后6 h内呼吸窘迫,经胸片确诊。
58例中,42例行胸腔镜手术修补膈肌,35例存活,7例死亡,死亡率占总经治量的12%,其中6例为胸腔镜手术中转开放手术,4例存活,2例死亡,死亡率占总经治量的3%;13例患儿行开放手术修补膈肌,5例存活,8例死亡,死亡率占总经治量的13%。另有3例产前诊断发现CDH,于术前死亡,占总经治量的5%。胸腔镜手术患儿中位产前诊断孕周为28.0(23.0,32.0)周,中位出生孕周为37.1(36.8,38.0)周,平均出生体重为(2.9±0.6)kg,8例肝脏疝入胸腔。按照术前情况将患儿分为3组(胸腔镜手术组,开放手术组,术前死亡组),三组间腔镜手术、开放手术、术前死亡患儿产前诊断孕周、出生孕周、出生体重、CDH发生部位、有无肝脏疝入差异统计学意义(P>0.05)(见表1、表2)。
直至2018年,本中心手术术式选择开放手术或腔镜手术受术者偏好影响较大。对产前及生后病情严重程度指标进行统计学分析,发现开放手术和首选腔镜手术患儿的病情严重程度无统计学差异,2018年至今,我院CDH术式首选腔镜手术。
本研究58例中40例存活,18例死亡。总经治患儿死亡率31%,手术死亡率27%;存活患儿中位产前诊断孕周为28.5(24.3,32.0)周,死亡患儿周龄为23.0(22.0,26.5)周,存活和死亡患儿产前诊断时间差异有统计学意义。产前诊断孕周<25周患儿死亡率明显增加;存活患儿中位手术时机为生后26.5(24.3,51.8)h,死亡患儿中位手术时机为生后23.0(8.0,30.0)h,存活和死亡患儿手术时间有统计学差异。生后24 h内手术患儿死亡率明显增加(表2)。
胸腔镜手术治疗患儿术后存活35例,死亡7例。其中5例死于术后呼吸循环功能衰竭,2例死于肾功能衰竭,平均死亡时间为术后(19±22)h。直接开放手术患儿存活5例,8例均因术后呼吸循环功能衰竭死亡, 平均死亡时间为术后(54±71)h。术后复发1例,为巨大缺损、补片修补后复发,经二次胸腔镜手术后痊愈。3例并发胸腔积液患儿经保守治疗后痊愈。开放手术治疗存活的5例患儿中,1例术后并发气胸,经保守治疗后痊愈。经规范肺功能锻炼后1~5个月复查,2例肺功能检查显示轻度限制性通气障碍,其中1例家长依从性差,早期未按要求康复锻炼,术后5个月胸部CT显示患侧肺体积为正常肺的3/5,全部患儿无气促及呼吸困难,其余检查结果均正常。出院患儿经门诊或电话随访,随访时间1个月至5年,经肺功能锻炼后呼吸功能恢复良好,无肺部相关症状,生长发育、活动量均与正常同龄儿水平接近。

表1 患儿基本情况Table1 BasicinformationofCDHchildren分组胸腔镜(含中转开放手术)手术开放手术术前死亡F/H/χ2值P值出生孕周<37周2.0850.338 是1011 否32122出生体重<2.0kg3.1640.193 是321 否39112出生体重<2.5kg0.4711.000 是1131 否31102产前诊断孕周<25周1.1470.694 是1352 否2271肝疝入4.0690.095 是861 否3472膈肌缺损部位0.5470.847 左34103 右830产前诊断孕周(周)28.0(23.0,32.0)25.5(23.0,29.5)22.0(22.0,27.0)2.8530.240出生体重(kg)2.932±0.6302.928±0.6442.563±1.3430.4620.632出生孕周(周)37.1(36.8,38.0)38.0(37.0,39.3)37.5(29.0,38.0)2.2360.327
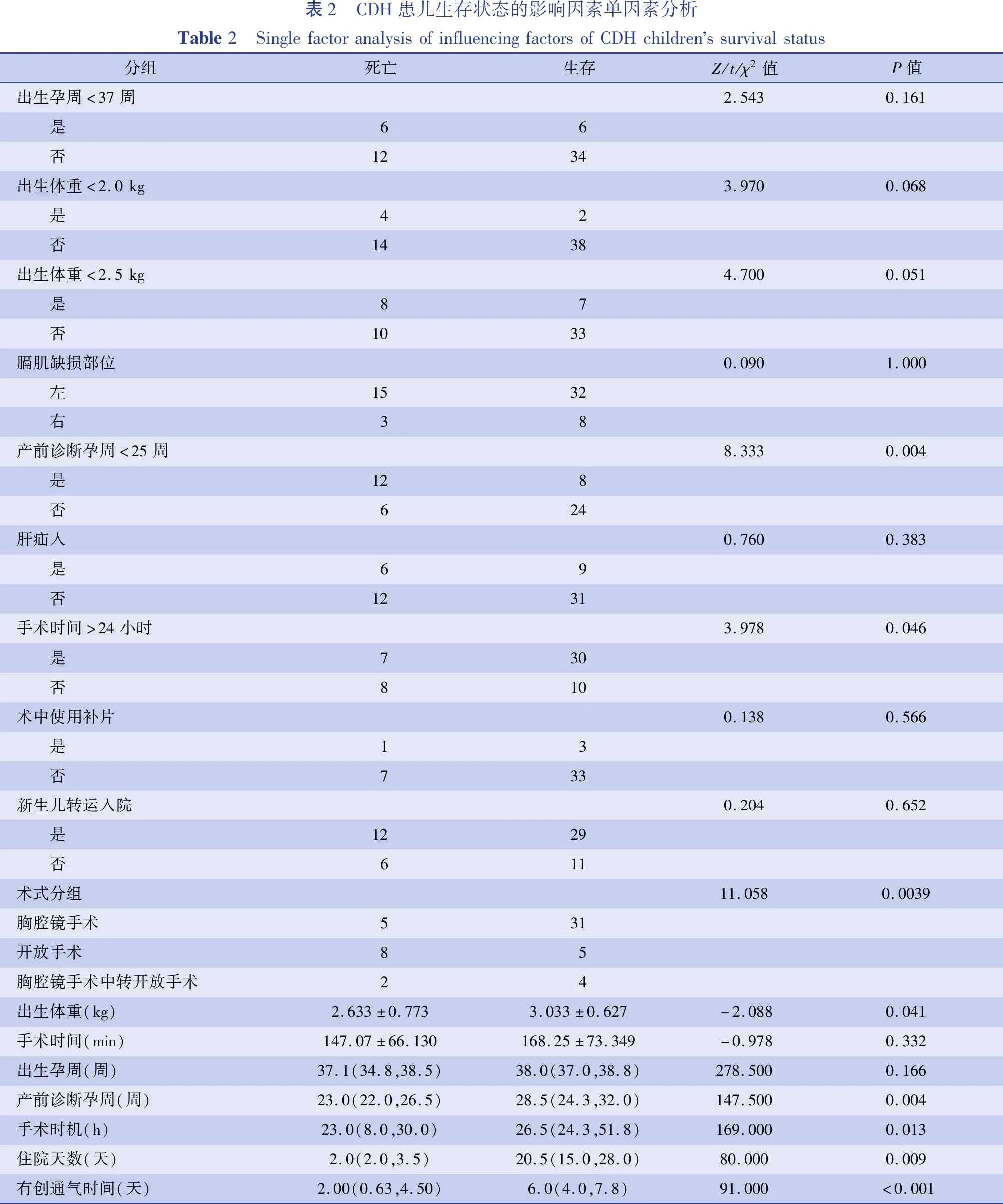
表2 CDH患儿生存状态的影响因素单因素分析Table2 SinglefactoranalysisofinfluencingfactorsofCDHchildrenssurvivalstatus分组死亡生存Z/t/χ2值P值出生孕周<37周2.5430.161 是66 否1234出生体重<2.0kg3.9700.068 是42 否1438出生体重<2.5kg4.7000.051 是87 否1033膈肌缺损部位0.0901.000 左1532 右38产前诊断孕周<25周8.3330.004 是128 否624肝疝入0.7600.383 是69 否1231手术时间>24小时3.9780.046 是730 否810术中使用补片0.1380.566 是13 否733新生儿转运入院0.2040.652 是1229 否611术式分组11.0580.0039胸腔镜手术531开放手术85胸腔镜手术中转开放手术24出生体重(kg)2.633±0.7733.033±0.627-2.0880.041手术时间(min)147.07±66.130168.25±73.349-0.9780.332出生孕周(周)37.1(34.8,38.5)38.0(37.0,38.8)278.5000.166产前诊断孕周(周)23.0(22.0,26.5)28.5(24.3,32.0)147.5000.004手术时机(h)23.0(8.0,30.0)26.5(24.3,51.8)169.0000.013住院天数(天)2.0(2.0,3.5)20.5(15.0,28.0)80.0000.009有创通气时间(天)2.00(0.63,4.50)6.0(4.0,7.8)91.000<0.001
讨 论
危重新生儿膈疝治疗水平提升有赖于外科技术和围术期管理水平的提升。从过去发现新生儿CDH意味着死亡,到急诊手术,再到延迟修复手术、高频通气、允许性高碳酸血症、体外膜肺及一氧化氮的使用,新生儿CDH患儿预后有了明显改善[1]。
本研究CDH存活患儿产前诊断时间明显晚于死亡患儿,同时孕25周前产前诊断发现CDH的患儿死亡率明显升高。产前诊断时间是产前诊断中重要的预后预测指标。产前诊断时间早,反映存在更大的膈肌缺损,易于被产前影像检查识别。膈肌缺损较大的CDH患儿腹腔脏器疝入胸腔的体积更大,挤压肺脏时间更长,胎肺发育水平也可能更差。膈肌缺损大小与CDH患儿死亡率相关[4]。相对于其他评估膈肌缺损大小和肺发育水平的产前评估指标(如肺头比、预测肺头比百分比和肝脏疝入胸腔百分比等),本研究也说明了产前诊断时间有更强的可操作性和更准确预测存活率的作用。一些研究提出,产前诊断时间可作为预测CDH死亡率的独立因子[5]。本研究也进一步验证了孕25周可以作为评估产前诊断时间的分界点,在孕25周之前诊断为CDH患者死亡率较高[6]。而肝脏是否疝入胸腔以及疝入部位、侧别在本研究中对CDH患儿存活情况预测不够准确。基层助产机构产前筛查一经发现CDH表现,产妇应转入具有产前诊断资格的三级助产机构确诊,进行进一步的产前检查和管理。以新生儿外科为主导的协同妇产科、影像科、遗传学的多学科联合会诊对患儿预后产前评估,产前诊断孕周作为一项重要的产前评估指标,可为下一步治疗提供参考。此外,CDH患儿治疗住院时间长、经济负担重也是影响家属救治意愿的重要因素,CDH死亡患儿住院时间短,需重症监护的有创通气时间短[7]。
胸腔镜手术在治疗新生儿CDH中较开放手术具有优越性,手术治疗是CDH的唯一根治手段。腔镜下操作空间充分、视野清晰且术后瘢痕较小,深受医患双方欢迎[2,8]。本研究中,开放手术组与腔镜手术组术前基本情况无明显差异,但开放手术死亡率较腔镜手术高,证明了腔镜手术治疗CDH的优势。术者应具备熟练的手术操作技巧,并在手术中全程关注患儿血氧饱和度和PaCO2变化情况,与麻醉医师沟通配合良好,一旦术中患儿心肺功能难以维持,应尽快考虑中转开放手术。建立CO2气胸在手术初期利于脏器还纳,脏器还纳后应停止或仅在低CO2压力下(3~4 mmHg)即可顺利完成手术。对此Anne[6]在其研究中也证实了这一观点。重症患儿血氧不易维持稳定,可术中依据监测情况适时暂停手术操作,待患儿情况稳定后继续手术。新生儿组织娇嫩,还纳脏器时一定要缓慢轻柔,避免不必要的损伤。疝入胸腔脏器较多时,顺序还纳小肠、结肠、胃等空腔脏器后,再还纳脾脏,将胸腔疝入脏器还纳回腹腔时切忌暴力直接还纳以免脾脏及血管撕裂出血,可间接推挤或以胃结肠等空腔脏器辅助推挤还纳,还纳腹腔脏器前应仔细观察患儿是否有其他合并结构畸形,争取一期手术修补同时合并的其他结构畸形;对膈肌缺损较大的情况,可在半荷包缝合闭合后,于缺损处肋间缝合,将缺损膈肌两侧加固至胸壁肋间肌处,可有效预防CDH复发;缺损过大时可选择胸腔镜下补片修补,膈疝复发时,如术者有丰富熟练的操作经验,二次修复依然可以选择胸腔镜手术;术后常规留置胸腔引流管,以便肺复张及预防张力性气胸。
CDH手术修复的最佳时机尚存在争议,但手术时机小于生后24 h患儿死亡率明显增高,2018年加拿大膈疝诊治指南中规定手术指征为:每小时尿量>1 mL/kg,当FiO2<0.5时导管前氧饱和度85%~95%,达到胎龄正常平均动脉压,乳酸值<3 mmol/L,肺动脉压力估计值<体循环压力[3];2015年欧洲先天性膈疝联盟共识中手术适应证为达到胎龄正常平均动脉压,FiO2<0.5时导管前氧饱和度85%~95%,乳酸值<3 mmol/L,每小时尿量>2 mL/kg,上述指南均认为手术指征为达到相对的生理稳定状态[9,10]。在没有ECMO等设备作为后盾的情况下,延期24 h,患儿情况适当稳定后早期手术,可避免部分严重膈疝患儿在等候过程中出现危险[11]。 本中心研究结果显示,生后24 h如患儿达到手术指征,可考虑手术,既可以使新生儿病情稳定,又避免了等候时间过长导致部分病情严重的患儿失去治疗机会。因此本研究中虽然手术时间<24 h,患儿死亡率显著提高,仍应考虑24 h以内早期手术对于挽救无法等到延期手术时间患儿的意义。在患儿病情严重程度允许的情况下,应尽量于出生24 h之后再手术。
产前诊断时间、手术时机、手术方式是预测新生儿期CDH患儿生存率的危险因素,产前诊断时间小于25周、手术时机小于24小时、行开放手术的患儿死亡率高,死亡患儿住院时间短、有创机械通气时间短。胸腔镜手术治疗新生儿CDH安全可行,在术者具备丰富腔镜操作经验前提下可优先考虑。

