Fe3O4@SiO2@COOH@NTA-Ni的制备及其对生物分子荧光检测的研究*
冯治棋,左显维,刘一丹,韩根亮,李工农
(1. 甘肃省科学院传感技术研究所,兰州 730000; 2. 甘肃省传感器与传感技术重点实验室, 兰州 730000)
0 引 言
功能化的磁性纳米团簇不仅具有大比表面积、高磁响应和超顺磁性的优点[1-3],还具备了和各种靶向抗体、多肽等生物分子偶联的特点[4-6]。在生物分离、共振成像、靶向载药、磁热疗、疾病的分子诊断、酶检测、药物筛选[7-10]等领域有巨大的应用前景。因为它同时具备了富集和放大检测信号的作用,因此可以有效捕获待检测生物分子,从而实现对生物分子的超灵敏识别,正成为特征生物信息高通量获取的一种重要工具。目前通过配体鳌合金属离子偶联在磁性纳米颗粒表面的方法主要应用于蛋白的分离与纯化领域[11-14],在生物分子检测领域少有涉及。因此制备高性能的磁性纳米功能组装体并将荧光信号富集在磁性纳米功能组装体的表面,通过荧光信号测量实现复杂样本中目标物的检测具有重要意义。
本文以Fe3O4为磁核,表面进行SiO2包覆,通过羧基硅烷化试剂完成羧基化修饰,利用表面联接的配体NTA鳌合金属Ni2+,制备了一种高性能磁性纳米功能组装体(Fe3O4@SiO2@COOH@NTA-Ni)。将该组装体与标记荧光素的His标签蛋白进行特异性反应,实现了富集与检测,通过加入洗脱液,检测上清液,解决了磁性纳米功能组装体自身荧光对生物分子检测的干扰问题,提供了一个对生物分子灵敏检测的新平台。
1 实 验
1.1 主要试剂和仪器
1.1.1 试剂
水合三氯化铁,国药集团化学试剂有限公司,分析纯;水合醋酸钠,国药集团化学试剂有限公司,分析纯;乙二醇,国药集团化学试剂有限公司,分析纯;浓氨水,天津市大茂化学试剂厂,分析纯;正硅酸乙酯(TEOS),上海中泰化学试剂有限公司,分析纯;氯化镍,国药集团化学试剂有限公司,分析纯;N-(三甲氧基硅基丙基)乙二胺三乙酸钠,45%的水溶液,Sigma-Aldrich;NA,NA-二(羧甲基)-L-赖氨酸水合物(NTA),Sigma-Aldrich,分析纯;N-羟基丁二酰亚胺(NHS),Sigma-Aldrich,分析纯;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),Sigma-Aldrich,分析纯;无水乙醇,天津市富宇精细化工有限公司,分析纯;实验用水均为去离子水。
1.1.2 仪器
SCIENTZ-IID型超声波细胞破碎机(宁波新芝生物科技股份有限公司);SCIENTZ-12N型冷冻干燥机(宁波新芝生物科技股份有限公司);BEXUS670型傅里叶变换红外光谱(美国尼高力(Nicolet)公司);IRIS-ER/S型电感耦合等离子体发射光谱仪(美国TJA公司);FS5型瞬态、稳态荧光光谱仪(英国爱丁堡公司);NanoZSE型纳米粒度及Zeta电位仪(英国马尔文公司);JEM-2010型透射电子显微镜(日本电子公司);Inc8604型振动样品磁强计(美国LakeShore公司);ZDJ-5B-D型自动滴定仪(上海雷磁)。
1.2 磁性纳米功能组装体制备
图1为Fe3O4@SiO2@COOH@NTA-Ni磁性纳米功能组装体的制备示意图,具体步骤如下。

图1 Fe3O4@SiO2@COOH@NTA-Ni的制备Fig 1 The Formation of Fe3O4@SiO2@COOH@NTA-Ni
1.2.1 Fe3O4纳米团簇的制备
称取0.34gFeCl3·6H2O,0.9gNaAc·3H2O溶于60 mL的乙二醇中,室温搅拌,使固体完全溶解,得到混合溶液;将混合液加入100 mL聚四氟乙烯内嵌的不锈钢高温反应釜中,于180 ℃下反应8h,冷却后使用乙醇和去离子水各洗涤3次,外部磁场分离,冷冻干燥,得到Fe3O4纳米团簇。
1.2.2 Fe3O4@SiO2纳米颗粒的制备
称取0.025 gFe3O4纳米团簇(1.2.1),加入12mL去离子水,20 mL乙醇,超声10 min,在冰水浴的条件下,加入2 mL浓氨水,0.05 mL正硅酸乙酯,超声40 min;外部磁分离,用去离子水洗涤3次,冷冻干燥,得到Fe3O4@SiO2。
1.2.3 Fe3O4@SiO2@COOH磁性纳米颗粒分散液的制备
称取0.05g Fe3O4@SiO2(1.2.2),置于100 mL三颈瓶中,加入40 mL乙醇,室温机械搅拌,加入N-(三甲氧基硅基丙基)乙二胺三乙酸钠1 mL,通氮气的条件下,于80℃下反应8h;外部磁分离,去离子水清洗三次,得到Fe3O4@SiO2@COOH磁性纳米颗粒的分散液。
1.2.4 Fe3O4@SiO2@COOH@NTA磁性纳米颗粒分散液的制备
取含0.03 g Fe3O4@SiO2@COOH磁性纳米颗粒的分散液(1.2.3),加入4 mL去离子水,加入40 mg EDC和40 mg NHS,混匀搅拌2 h,加入4 mg NA,NA-二(羧甲基)-L-赖氨酸水合物,室温下反应36 h;外部磁分离,加入4 mL去离子水,清洗3次,得到Fe3O4@SiO2@COOH@NTA磁性纳米颗粒的分散液。
1.2.5 Fe3O4@SiO2@COOH@NTA-Ni磁性纳米功能组装体分散液的制备
取Fe3O4@SiO2@COOH@NTA磁性纳米颗粒的分散液(1.2.4),外部磁分离后,分别加入4mL(0.1、0.5、1M)NiCl2水溶液,混合反应2h;外部磁分离,加入去离子水,清洗3次,最后分散于0.3 mL去离子水中。
1.3 蛋白检测
图2为磁性纳米功能组装体提取与检测的原理图,取制备Fe3O4@SiO2@ COOH@NTA-Ni磁性纳米功能组装体的分散液8.65 μL。加入一定量5 μM荧光标记的具有His标签的蛋白,再加入PBS缓冲溶液,使总体积为600 μL,体系His标签的蛋白的浓度分别为(200、500、800 nM、1、2、3、4 μM),反应1h,反应结束后,PBS缓冲溶液清洗3次,加入600 μL咪唑洗脱液(PBS,250mM咪唑,PH8.0),反应1 h,外部磁分离后,留上清液在激发波长490 nm、狭缝1 nm;发射波长520 nm、狭缝0.5 nm下进行荧光检测。
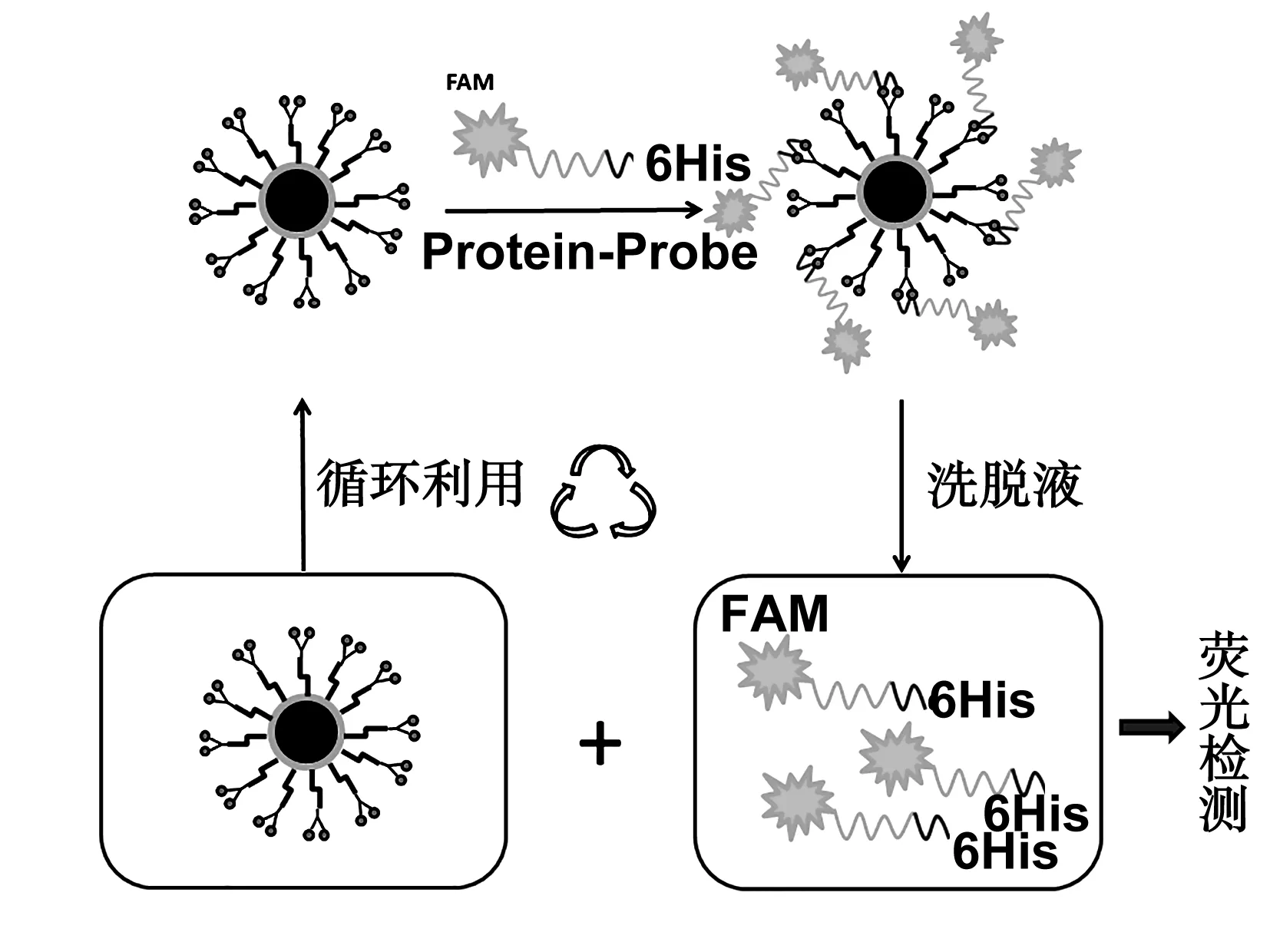
图2 磁性纳米功能组装体检测原理图Fig 2 Detection schematic of magnetic nano-assembly structure
2 结果与讨论
2.1 TEM分析
图3为(a)Fe3O4、(b)Fe3O4@SiO2、(c) Fe3O4@SiO2@COOH@NTA-Ni@蛋白的TEM照片。从图1可得,(a) Fe3O4形貌是由极小的纳米晶组成球形团簇,粒径约为200 nm且分散性良好;(b)是在图(a) Fe3O4的基础上包覆了一层SiO2,可以看到有明显的包覆层,粒径约为220nm且分散性良好;(c)是在(b)的基础上经过层层化学修饰,最终形成Fe3O4@SiO2@COOH@NTA-Ni的磁性纳米功能组装体,并利用该组装体与His标签蛋白进行特异性结合得到的TEM图。由图可得,通过层层修饰后,粒径增大到300 nm,且表面有凸起,表现出一定的粗糙度,初步证明其修饰成功,并且分散性良好。

图3 (a)Fe3O4(b)Fe3O4@SiO2(c)Fe3O4@SiO2@COOH@NTA-Ni@蛋白的TEM照片Fig 3 TEM image of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2@COOH@NTA-Ni@Protein
2.2 红外分析
图4是Fe3O4@SiO2@COOH@NTA-Ni制备过程中,各中间体的傅里叶变换红外(FT-IR)光谱图,其中d曲线是最终得到的磁性纳米功能组装体。可以看到590cm-1出现的峰是Fe-O键的伸缩振动峰[15],是Fe3O4的特征峰,1084 cm-1处出现Si-O的反伸缩振动峰,795 cm-1处出现Si-O的对称伸缩振动峰,955 cm-1处出现了Si-OH的弯曲振动峰,说明具有明显SiO2的包覆层;3 378 cm-1附近出现的峰是O-H键的伸缩振动峰[16]。1 385 cm-1出现的峰对应是C-N键的伸缩振动峰,这是由于NTA结构中存在C-N键,1 624 cm-1处出现-COO-中C=O的伸缩振动峰且图2(d)比图2(c)的强度更强[17],这是因为NTA中带有3个羧基,从而使其增强。以上数据从结构上均表明磁性纳米组装体的成功制备。

图4 (a)Fe3O4(b)Fe3O4@SiO2(c)Fe3O4@SiO2@COOH(d)Fe3O4@SiO2@COOH@NTA-Ni的傅里叶变换红外(FT-IR)光图谱Fig 4 FT-IR spectra of Fe3O4, Fe3O4@SiO2, Fe3O4@SiO2@COOH and Fe3O4@SiO2@COOH@NTA-Ni
2.3 Zeta电位分析
图5是Fe3O4@SiO2@COOH@NTA-Ni制备过程中,各中间体的Zeta电位图,从中可以看到(1)Fe3O4的Zeta电位是38mv,这是由于Fe3O4的制备过程中醋酸钠不仅起到了反应助剂的作用,同时NaAc中的羧酸基团与颗粒表面优先结合,而使在颗粒的外表面为带正电荷的钠离子[18];(2)Fe3O4@SiO2的Zeta电位-31 mV,二氧化硅的零电荷点为pH=2.5,若pH<2.5则带正电,反之,pH>2.5就带负电;其依据在于SiO2在水中水解得到H2SiO3,然后硅酸电离,H+进入到溶液中,剩下的HSiO3负离子附着在SiO2的表面,使得SiO2在水中显负电性;(3)Fe3O4@SiO2@COOH的Zeta电位为-39 mV,羧基本身带负电,SiO2表面羧基修饰后,负电性明显增强;(4)Fe3O4@SiO2@COOH@NTA的Zeta电位为-29 mV,相对于Fe3O4@SiO2@COOH的Zeta电位偏正,这是由于NTA结构中N存在孤对电子所引起;(5)Fe3O4@SiO2@COOH@NTA-Ni的Zeta电位是-25 mV,由于引入了Ni2+,使其电位向正方向移动。

图5 (1)Fe3O4(2)Fe3O4@SiO2(3)Fe3O4@SiO2@COOH(4)Fe3O4@SiO2@COOH@NTA (5)Fe3O4@SiO2@COOH@NTA-Ni的Zeta电位图Fig 5 Zeta potential of Fe3O4, Fe3O4@SiO2, Fe3O4@SiO2@COOH, Fe3O4@ SiO2@COOH@NTA and Fe3O4@SiO2@COOH@NTA-Ni in water
2.4 羧基密度测定
此外,我们也对羧基的含量进行了计算:分别做出电导率下降和上升阶段斜率a和b,再做一条平行于横坐标,经过电导率最低点的直线c。它们相交所形成的AB线段在横坐标上对应的体积就是NaOH消耗的体积V。

图6 Fe3O4@SiO2@COOH电导滴定图Fig 6 Conductometric titration curves of Fe3O4@SiO2@COOH
根据公式:-COOH=NV/m[19],N表示滴定液NaOH的浓度,V表示消耗的体积,m表示所测试的羧基化磁性颗粒的质量,计算得到Fe3O4@SiO2@COOH的羧基含量可达到0.5 μmol/mg。
2.5 氯化镍浓度对Ni2+含量的影响
表1为不同氯化镍浓度下,离子浓度对于NTA鳌合Ni2+含量的影响,采用电感耦合等离子体发射光谱(ICP)测定Ni2+含量。由表1可知,NTA对于Ni2+的鳌合量与加入氯化镍溶液的浓度有极大的关系,1 g组装体中Ni2+的最高鳌合量可达8.693×10-5mol。
表1不同NiCl2浓度下Fe3O4@SiO2@COOH@NTA-Ni中Ni2+的含量
Table1Ni2+ContentinFe3O4@SiO2@COOH@NTA-NiatdifferentconcentrationsofNiCl2

序号氯化镍浓度1 g组装体Ni2+含量1 g组装体Ni2+含量10.1M1.294×10-3g2.19×10-5mol20.5M3.461×10-3g5.86×10-5mol31M5.129×10-3g8.693×10-5mol
2.6 磁性能测试
图7是Fe3O4@SiO2@COOH@NTA-Ni磁性纳米功能组装体及各中间体的磁滞回线,从图中可知,Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@COOH和Fe3O4@SiO2@COOH@NTA-Ni的饱和磁化强度分别为:65、45、43和40 A·m2/kg。随着非磁性物质包覆的增加,饱和磁化强度逐渐降低,但由于团簇的存在,通过层层包覆后磁化强度降低幅度并不明显,依然具有较好的磁性。此外,不存在明显的滞后环,几乎无剩磁现象,表现出良好的超顺磁性。这就保证了磁性纳米功能组装体在溶液中的快速磁分离。

图7 (a)Fe3O4(b)Fe3O4@SiO2(c)Fe3O4@SiO2@COOH (d)Fe3O4@SiO2@COOH@NTA-Ni的磁滞回线图Fig 7 Hysteresis loops of Fe3O4, Fe3O4@SiO2, Fe3O4@SiO2@COOH and Fe3O4@SiO2@COOH@NTA-Ni
2.7 Fe3O4@SiO2@COOH@NTA-Ni磁性纳米功能组装体荧光检测蛋白
图8是磁性纳米功能组装体(前驱体)与His标签蛋白反应后清洗2次,分别测量得到的荧光光谱图。从图中可以看到,清洗一次(b)和清洗两次(c)荧光强度几乎不变,说明经过两次清洗后,前驱体表面已经没有非特异性吸附的His标签蛋白。同时,前驱体(a)和清洗一次(b)、清洗两次(c)的荧光强度虽然有所变化,但是出峰位置都在516和600 nm,而我们设计的荧光素会在530 nm附近出现,所以猜测516和600 nm出现的是前驱体的峰,为了验证,我们做了对比实验,图9是磁性纳米功能组装体(前驱体)与非His标签蛋白反应后清洗2次,分别测量得到的荧光光谱图,与图8相比,图9出峰位置和荧光强度都没有变化。因此,我们认为前躯体本身激发后所产生的荧光掩蔽了蛋白上荧光素激发产生的荧光,直接利用前驱体检测荧光时会对检测物产生干扰。鉴于此,我们利用洗脱液对目标物进行清洗,然后对清洗后的上清液进行测量。
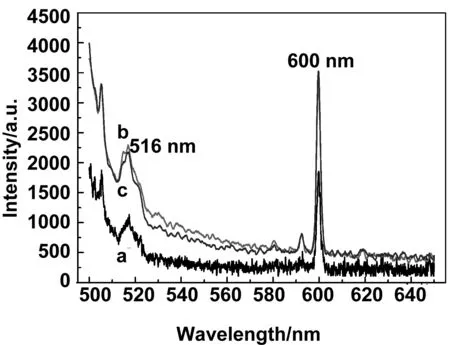
图8 (a)前驱体,(b)前驱体与His标签蛋白反应后清洗1次,(c)前驱体与His标签蛋白反应后清洗2次的荧光光谱图Fig 8 Fluorescence spectra picture of precursor, precursor reacted with histidine-tagged proteins after washed once and precursor reacted with histidine-tagged proteins after washed twice
图10是前驱体与His标签蛋白反应后清洗所得上清液:(a)清洗1次,(b)清洗2次,(c)加入洗脱液。清洗一次后上清具有一定的荧光强度,且出峰位置在530 nm附近,经过第二次清洗,上清液的荧光强度为零,加入洗脱液后上清液在530 nm出现一个较强的荧光峰。这是由于清洗多次以后,前驱体表面的非特异性吸附逐渐被清洗,使得上清液的荧光强度逐渐降低并最终将为零。而加入洗脱液后,上清液具有一定的荧光强度,是由于表面特异性吸附的蛋白被剥离进入上清液。图11是前驱体与非His标签蛋白反应后清洗所得上清液:(a)清洗1次,(b)清洗2次,(c)加入洗脱液。通过对比图10发现清洗二次后上清液荧光强度均为零,而加入洗脱液后两者有明显的区别,图10中c曲线在530 nm附近出现一个较强的荧光峰,而同时图11中c曲线的荧光强度依然为零。这就说明我们制备的磁性纳米功能组装体实现了特异性连接His标签蛋白。
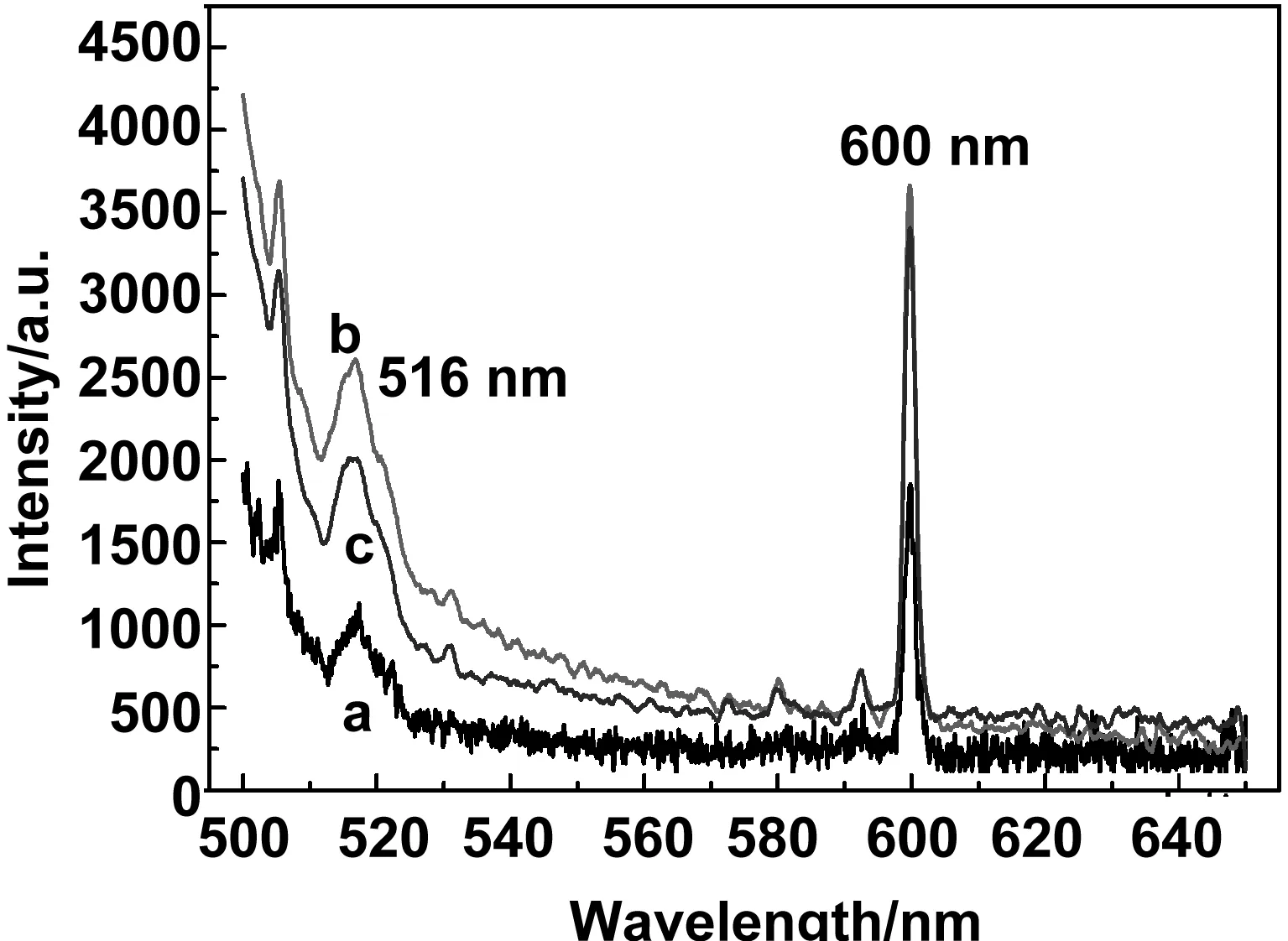
图9 (a)前驱体,(b)前驱体与非His标签蛋白反应后清洗1次,(c)前驱体与非His标签蛋白反应后清洗2次的荧光光谱图Fig 9 Fluorescence spectra picture of precursor, precursor reacted with no histidine-tagged proteins after washed once and precursor reacted with no histidine-tagged proteins after washed twice
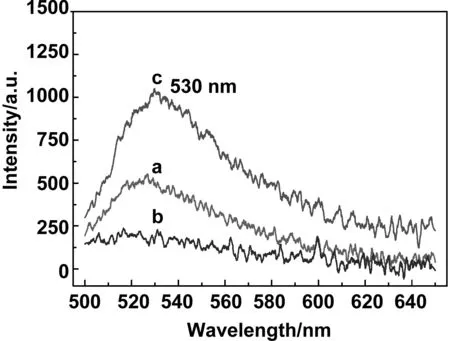
图10 前驱体与His标签蛋白反应后清洗所得上清液:(a)清洗1次,(b)清洗2次,(c)加入洗脱液的荧光光谱图Fig 10 Fluorescence spectra picture of the supernatant obtained after precursor reacting with histidine-tagged proteins: (a) washed once, (b) washed twice, (c) add the eluent
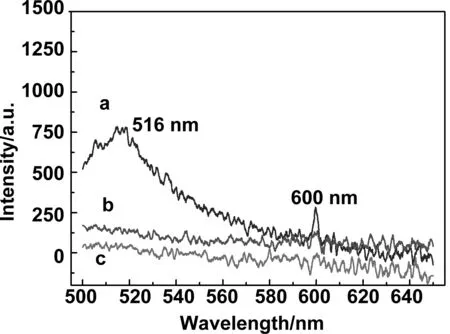
图11 前驱体与非His标签蛋白反应后清洗所得上清液:(a)清洗1次,(b)清洗2次,(c)加入洗脱液的荧光光谱图Fig 11 Fluorescence spectra picture of the supernatant obtained after precursor reacting with no histidine-tagged proteins: (a) washed once, (b) washed twice, (c) add the eluent

图12 不同His标签蛋白浓度时上清液的荧光光谱图Fig 12 Fluorescence spectra of supernate in the presence of different concentrations of histidine-tagged proteins
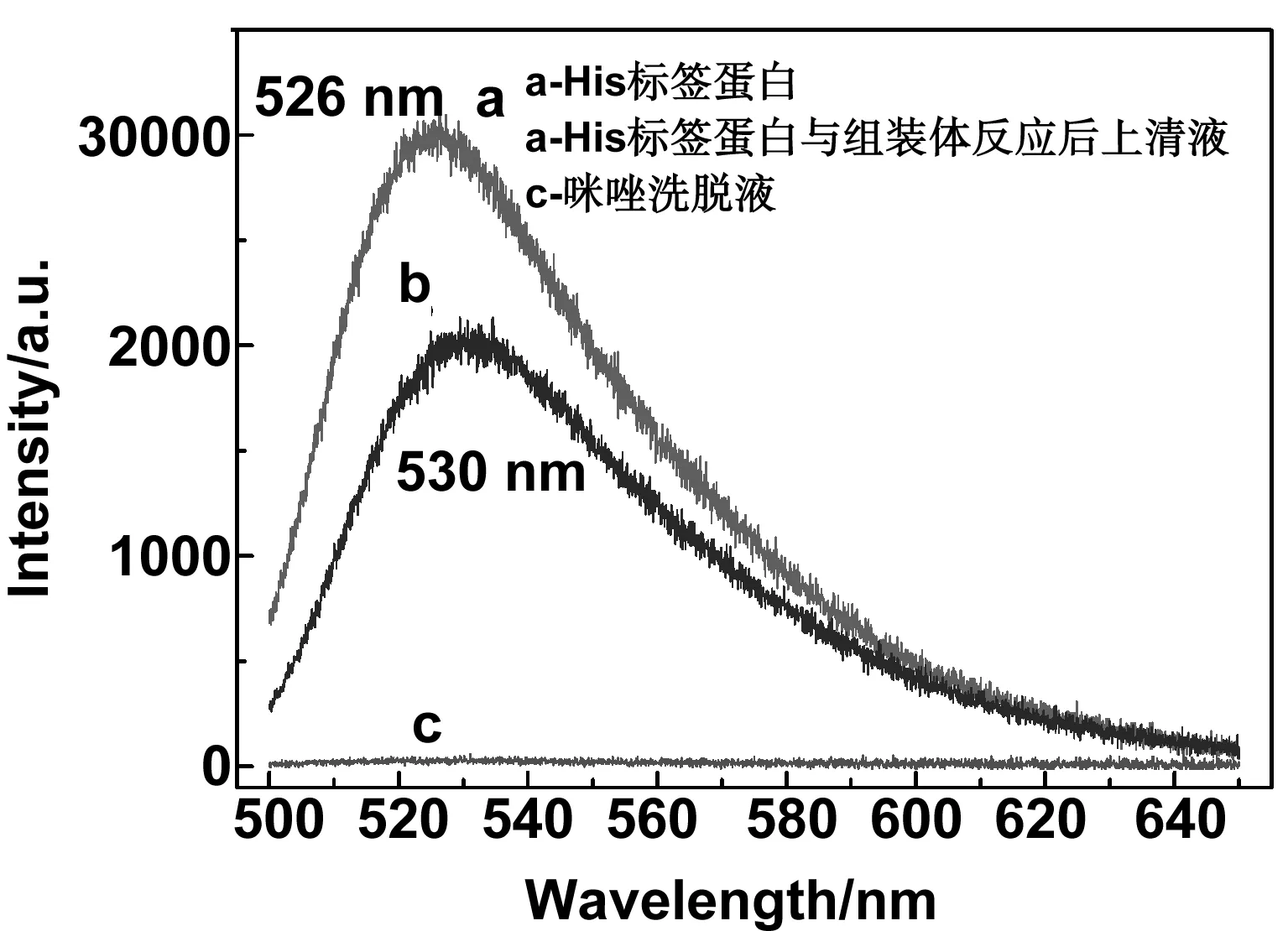
图13 (a)2μMHis标签蛋白;(b)2μM His标签蛋白与组装体反应后上清液(c)咪唑脱液的荧光光谱图Fig 13 Fluorescence spectra of 2μM histidine-tagged proteins, supernate obtained after precursor reacting with 2 μM histidine-tagged proteins and eluent containing imidazole
接着我们又研究了磁性纳米功能组装体与不同体系浓度His标签蛋白的反应,经过清洗,外部磁分离,加入洗脱液后取上清液测量。图12为不同体系浓度下,上清液的荧光光谱图,从图中我们可以看到,随着体系浓度的增加,上清液荧光强度逐渐增加,当达到2 μM时,荧光强度达到最强,继续增加浓度,发现荧光强度反而下降。说明当体系浓度为2 μM时,该磁性纳米功能组装体的结合量最高,浓度过大即超过2 μM,会抑制该磁性功能组装体与His标签蛋白的结合。
此外,我们还做了一组对照实验来进一步说明这种检测新方法的可靠性。图13是在2μM体系浓度下,纯His标签蛋白、反应后上清液及咪唑洗脱液的荧光光谱图。首先咪唑洗脱液的荧光强度为零,对于荧光检测没有任何影响,反应后的上清液荧光强度较纯His标签蛋白有所降低,同时根据荧光强度,得到其反应效率可达66.7%。
3 结 论
(1)利用改进的溶剂热法制备Fe3O4纳米团簇,以该团簇为核,层层包覆制备得到Fe3O4@SiO2@COOH@NTA-Ni磁性纳米功能组装体。实验结果表明:该功能组装体拥有高的饱和磁化强度且保持超顺磁性,在水相中具有良好的分散稳定性,与His标签蛋白有很强的特异性结合能力。
(2)研究设计了一种新的检测方法避免了磁性纳米功能组装体本身荧光对检测结果的影响。通过各种实验证明利用洗脱后的上清液检测目标物的方法可靠性,并且咪唑洗脱液不影响荧光检测,同时可以替换结合的His标签蛋白,保证了该磁性功能组装体的多次重复利用。此外,类似的组装体主要应用于蛋白的分离与提取,而本研究提供了一种可以用于生物分子检测的方法,拓展了其在生物医学检测领域的应用。

