APMP废液中半纤维素的羧甲基化及生物活性研究*
陈 婷,刘海棠,2,3,刘 婧,李 洁,安永贞,张晓晨
(1. 中国轻工业造纸与生物质精炼重点实验室,天津市制浆造纸重点实验室,天津科技大学,天津 300457;2. 江苏省生物质能源与材料重点实验室, 南京 210042;3. 天津市海洋资源与化学重点实验室,天津科技大学,天津 300457)
0 引 言
近年来随着绿色生态观念不断深入人心,生态工业也逐渐符合当今21世纪的绿色发展理念,随着生物质精炼的提出,越来越多的研究者开始重视生物质原料和造纸废液的综合利用与开发,不仅可以替代化石基材料,而且可以改善传统利用方式的低效率、高污染的缺点[1-2]。
在造纸工业中最为瞩目的APMP法制浆工艺,即碱性过氧化氢化学机械法[3],具有高得率、纸浆强度好、低污染、低能耗等突出优点,但大量半纤维素在各个工艺阶段被逐步带入废液中[4]。因此对APMP废液中的半纤维素等生物质资源进行回收利用,不仅能提高企业的效益,还符合现代生态工业的发展理念。
半纤维素是由几种不同类型的单糖构成的异质多聚体。近年来,研究者在半纤维素转化为糖[5],化学品,燃料[6]等方面,展现了广阔的应用前景。半纤维素沿骨架和侧链上分布的大量游离的羟基与低分子醇类的化学性质相似,可与酸反应生成酯类,与烷基化试剂反应生成醚类,酯化[7]与醚化[8]是最为重要的半纤维素衍生反应。宋飞宇等采用醚化法制备了具有较高羧基含量、较高分子量的羧甲基半纤维素[9],并将其与聚酰胺多胺-表氯醇树脂类湿强剂联用以提高纸张的湿抗张强度。曾月[10]等制备了对Cu2+有良好吸附性能的羧甲基半纤维素/壳聚糖复合材料。有研究表明,多糖在羧甲基化之后具备良好的生物活性。别蒙[11]等以一氯乙酸为羧甲基化试剂合成的羧甲基茯苓多糖具有良好的抑菌活性。冯燕茹[12]等对羧甲基茯苓多糖进行体外抗氧化性实验,结果表明,改性后的茯苓多糖具有Fe3+的还原能力和对羟自由基的清除能力。这些研究成果结合半纤维素自身具有的生物相容性和生物可降解性,为羧甲基半纤维素的生物活性探究以及在生物医药和化妆品领域的应用提供了理论基础。
本文主要是从桉木APMP废液中提取半纤维素,将其进行羧甲基化改性,并对改性前后的半纤维素进行生物活性探究,主要是抗氧化性,吸湿、保湿性和抑菌性。
1 实 验
1.1 仪器与材料
桉木APMP制浆废液(山东造纸厂),无水乙醇,氯乙酸,氢氧化钠,硫酸亚铁,过氧化氢,水杨酸,浓硫酸,硫酸铵,碳酸钠,溴化钾,枯草芽孢杆菌,沙门氏杆菌,酵母浸粉,牛肉膏,蛋白胨。
傅里叶红外光谱仪(FT-IR 650,天津港东科技发展股份有限公司),高效液相色谱仪(1200,美国Agilent),紫外分光光度计(T6,北京普析仪器有限责任公司),超净工作台。
1.2 半纤维素的提取
APMP废液中提取半纤维素主要分为两部分:(1)木素的分离:取一定量浓缩后的废液于烧杯中,缓慢滴加浓硫酸(w%=72%),调pH为1.7;再将其置于恒温水浴锅中加热(45 ℃,30 min),有沉淀生成;待废液冷却至室温后将底部褐色沉淀(主要成分为木素)除去,留滤液备用。

图1 APMP废液中提取半纤维素的流程图Fig 1 A flow chart for extracting hemicellulose from APMP waste liquor
(2)醇沉法提半纤维素:向滤液中缓慢滴加6 mol/L的氢氧化钠溶液,调 pH至4;再加入无水乙醇(V滤液∶V无水乙醇=1∶4),有淡黄色絮状物质出现,静置24 h;24 h后悬浮液明显分层,底部为淡黄色固体,除去上层溶液后对底部沉淀进行2~3次洗涤(85%乙醇),并放于真空干燥箱中干燥(40 ℃,24 h);干燥后的粉末即半纤维素(HC)。
1.3 羧甲基半纤维素的合成
称一定量的半纤维素(HC)加入到50 mL的三颈烧瓶中,在30 ℃下加水溶解,在加入50%的NaOH,搅拌20 min后加入无水乙醇(V无水乙醇∶V水=4∶1);继续加入一定量的ClCH2COOH,温度升至75 ℃,再加入剩余的NaOH,反应2 h;结束后将上清液除去,残渣用85%乙醇进行多次洗涤,真空干燥12 h,所得物质为羧甲基半纤维素(CMHC)。
取代度的测定:0.2 g的CMHC充分溶解于50 mL的蒸馏水中,用酸或碱溶液调节pH至8.0,再用0.05 mol/L的硫酸标准溶液进行滴定,至溶液pH为3.74为止,记录所用硫酸标准溶液的体积V。
按照公式(1)计算CMHC的取代度(DS)
DS=0.132B/(1-0.08B)
B=2MV/m
式中,m为CMHC的质量,g;M为硫酸标准溶液的摩尔浓度,mol/L;V是滴定所用的硫酸标准溶液的体积,mL。
1.4 性能与表征
1.4.1 红外光谱(FT-IR)测定
将HC,CMHC和溴化钾(KBr)在105 ℃进行烘干4 h。少量待测样(HC,CMHC)分别和KBr以m(待测样)/m(KBr)=1∶100的比例进行充分研磨,压片制样,压力为10 MPa,时间60 s,扫描范围400~4 000 cm-1,分辨率4 cm-1。
1.4.2 抗氧化性测定
采用测定羟基自由基清除率的方法对HC和CMHC进行抗氧化性评价。
称取50 mg样品充分溶于8 mL蒸馏水中,配成母液,待用。取两组试管,编号为A-(1~6)和B-(1~6),设置一个空白样。分别往A-1和B-1号试管中加入2 mL母液,再逐级稀释,加完两组试管;向A组试管中依次加入2 mL的2 mmol/L的硫酸亚铁溶液和2 mmol/L水杨酸溶液,充分摇匀,静置10 min;再加入2 mL 的6 mmol/L过氧化氢溶液,混匀后置于37 ℃的恒温水浴锅中加热30 min;使用紫外可见分光光度计测出A组在510 nm处的吸光度A1;同样方法,用2 mL蒸馏水代替样液,其他步骤不变,测定空白样在510 nm处吸光度A0;B组试管中加入的过氧化氢溶液使用等体积蒸馏水代替,其他操作不变,测定吸光度A2。
根据公式(2)计算羟基自由基清除率:

1.4.3 吸湿、保湿性测定
在室温下,精确称取0.5 g样品各两份,放入称量瓶中。准备两个干燥器,一个放有饱和的硫酸铵溶液(RH=81%),另一个放有饱和的碳酸钠溶液(RH=43%),将样品分别放置其中,12、24、48、72 h时分别称其质量。记录样品放置前的质量(记作X)样品放置后的质量(记作Y)。
根据公式(3)计算吸湿率:

在室温下,精确称取0.5 g样品各两份,将称量好的样品分别放入称量瓶中,用滴管向其滴加去离子水(样品质量10%左右),质量记为Y。将其分别放在两个干燥器中,一个放有饱和的碳酸钠溶液(RH=43%),另一个放置干硅胶,在12、24、48、72 h时分别称其质量X。
根据公式(4)计算保湿率:

1.4.4 抑菌性测定
采用牛津杯法分别测定HC和CMHC的体外抑菌活性。实验所用菌种是沙门氏菌和枯草芽孢杆菌,实验室自培。待测样品用蒸馏水将其分别配制成浓度为20 mg/mL的溶液;按实验标准方法依次进行灭菌、倒板、涂抹菌液、倒入样液和培养等步骤,并拍照、记录抑菌圈直径。
2 结果与讨论
2.1 半纤维素组分含量分析
表1为APMP废液中提取的半纤维素通过两步酸水解后用HPLC测定的单糖组分含量,结果显示该半纤维素水解产物由木糖、阿拉伯糖、葡萄糖组成,其中木糖含量最高为 68.52%,其次为葡萄糖28.84%,阿拉伯糖含量较低为2.64%可以得出,APMP废液中提取的半纤维素的主要成分是木聚糖。
表1APMP废液中半纤维素的单糖组分含量
Table1ThemonosaccharidecontentofhemicelluloseextractedfromeucalyptusAPMPwasteliquor

2.2 羧甲基半纤维素的合成
2.2.1 羧甲基半纤维素的反应机理:
(1)碱化反应
半纤维素在碱性环境中,糖单元的羟基被碱化成氧负离子,提高了亲核性,另外,半纤维素在碱性条件下充分润胀甚至溶解,有助于醚化剂的渗透,一定程度上提高了后续醚化反应的效率和均一性。
(2)醚化反应
在碱性环境中,氯乙酸的α-C从背面进攻半纤维素链上的氧负离子,发生了SN2双分子亲核取代反应,并生成羧甲基半纤维素钠[9]。

图2 羧甲基半纤维素(CMHC)的反应机理Fig 2 Reaction mechanism of carboxymethyl hemicellulose (CMHC)
2.2.2 羧甲基半纤维素(CMHC)的取代度
图3-a中表示温度在75 ℃时,是合成CMHC的最佳温度,此温度下DS最大,为1.48;图3-b是在75 ℃时,NaOH的用量对DS的影响,在NaOH/HC(mol/mol)为1时,DS最大,为1.47,NaOH的量过少时,半纤维素的亲核性过低,NaOH用量过多时,副反应被促进,都不利于反应进行;图3-c是在最佳温度和NaOH用量时,醚化剂(ClCH2COOH)的用量对DS的影响,图中可以看出,随着ClCH2COOH用量的增加,醚化反应更加充分,DS也逐渐提高,但是,当ClCH2COOH/HC(mol/mol)为3时,会中和碱化过程中全部的碱,使后续的醚化反应体系呈弱酸性,破坏醚化反应所需的弱碱性条件,因而不利于CMHC的合成。以下表征是选用CMHC-12和HC进行对比分析。
2.3 性能与表征
2.3.1 红外光谱分析
从图4-a HC的FT-IR图中可以看出,1 129cm-1,619 cm-1是糖单元上醚键(C-O-C)的吸收峰,是木聚糖的特征峰,2 918 cm-1是 -CH2- 的吸收峰,说明APMP废液的乙醇沉淀物是以木聚糖为主要成分的半纤维素。从图4-b CMHC的FT-IR图中可以看出,1597 cm-1附近是羧基(-COOH)的(C=O)非对称振动吸收,1420cm-1附近是与羧基相连的甲基(-CH3)的(C-H)振动吸收、1 320 cm-1附近的(C=O)对称伸缩吸收增强,表明样品中羧甲基(-OCH2-COOH)的存在,即半纤维素成功被羧甲基化。
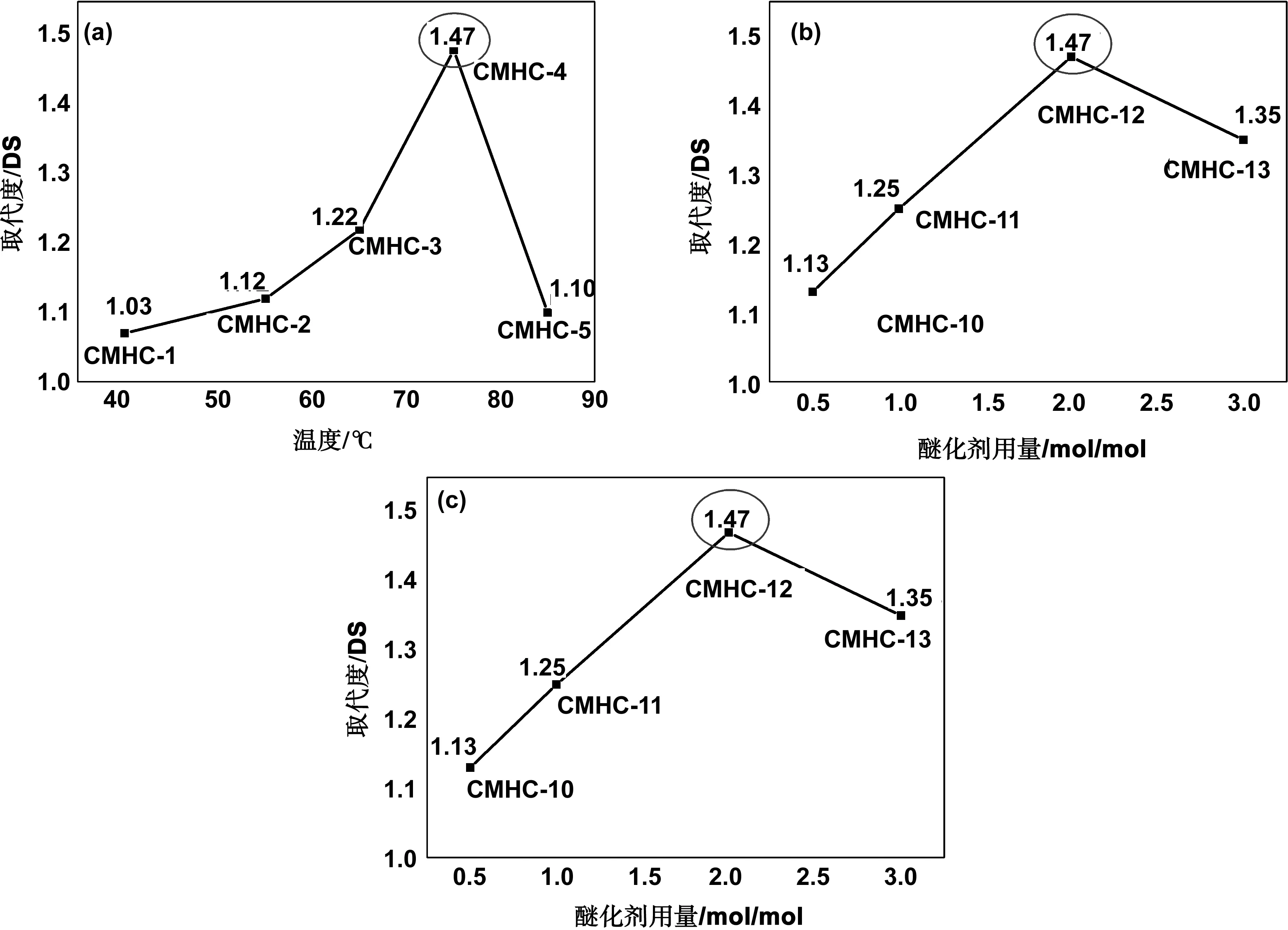
图3 温度、碱用量和醚化剂用量对羧甲基半纤维素(CMHC)取代度(DS)的影响Fig 3 Effect of different temperature, amount of alkali and amount of etherifying agent on the degree of substitution of carboxymethyl hemicellulose (CMHC)

图4 半纤维素(HC)和羧甲基半纤维素(CMHC)的红外光谱图Fig 4 FT-IR spectra of hemicellulose (HC) and carboxymethyl hemicellulose (CMHC)
2.3.2 抗氧化性
从图中可以看出,HC和CMHC的羟基清除率都是随着溶液浓度的增大而增大,但是二者存在一定的差异,在相同质量浓度下,CMHC的抗氧化性要大于HC。
羟基自由基的清除主要有两种机制:(1)待测样品通过提供氢(H)离子将羟基自由基还原;(2)待测样品与能活化H2O2的过渡金属离子(如Fe2+)螯合,从而抑制羟基自由基的产生。经分析可得,羧甲基化处理半纤维素的羟基自由基清除活性的机制,则可能是由于改性引入的羧甲基基团能与Fe2+离子螯合,抑制H2O2活化,从而抑制Fenton反应中羟基自由基的产生。并提高了其清除羟基自由基(·OH)的能力,即抗氧化性的提高[13-14]。
2.3.3 吸湿、保湿性
图中可以看出,在0~24 h内,吸湿速率快,在24 h后,吸湿速率趋于缓慢,基本处于饱和状态。二者趋势相同,但是在同一时刻,CMHC的吸湿性明显高于HC。
图7中,HC和CMHC在绝干环境(干硅胶)中,CMHC的保湿效果略大于HC,二者水分流失都快;在RH=43%的环境中,CMHC的保湿效果明显优于HC,在前24 h内,水分流失较快,但保湿效果良好,直至72 h后,CMHC的保湿率还能保持在46.3%。

图5 半纤维素(HC)和羧甲基半纤维素(CMHC)的抗氧化性Fig 5 Oxidation resistance of hemicellulose (HC) and carboxymethyl hemicellulose (CMHC)
通过上述对HC和CMHC的吸湿、保湿性分析,羧甲基基团的引入有利于提高HC的吸湿、保湿性。CMHC在碱化反应中破坏了半纤维素中木聚糖等大分子链上羟基之间形成的氢键,使糖链末端上的羟基基团的吸收位点增加,且在醚化反应中引入的羧甲基基团能与水形成氢键,从而提高半纤维素的吸湿性;同时,分子链之间还相互交织成网状,加之与水的氢键结合,起到很强的保湿作用。
2.3.4 抑菌性
由图8可以看出,在相同质量浓度(20 mg/mL)下,HC和CMHC对枯草芽孢杆菌和沙门氏杆菌的抑菌性有所不同。观察图中的抑菌圈,HC对两种菌均无明显抑制作用;但CMHC对枯草芽孢杆菌的抑菌圈直径为14 mm,对沙门氏杆菌的抑菌圈直径为15 mm,可见羧甲基改性后提高了半纤维素的抑菌能力。

图6 半纤维素(HC)和羧甲基半纤维素(CMHC)的吸湿性Fig 6 Hygroscopicity of hemicellulose (HC) and carboxymethyl hemicellulose (CMHC)

图7 半纤维素(HC)和羧甲基半纤维素(CMHC)的保湿性Fig 7 Moisturizing properties of hemicellulose (HC) and carboxymethyl hemicellulose (CMHC)
根据抑菌性的原理分析,CMHC的抑菌性可能是由于其能够吸附在细胞的表面,一方面阻止营养物质向细胞内运输,另一方面改变了细胞膜的选择透过性,导致细胞质流失,从而质壁分离,起到杀菌抑菌的效果;或者CMHC溶液通过渗透进入细胞体内,和体内带有电荷的细胞质产生吸附作用,从而发生絮凝现象,扰乱细胞内正常的生理活动或阻断细菌体内DNA的转录从而抑制细菌的生长和繁殖[15]。

图8 半纤维素(HC)和羧甲基半纤维素(CMHC)对枯草芽孢杆菌和沙门氏杆菌的抑菌效果Fig 8 Antibacterial effects of hemicellulose (HC) and carboxymethyl hemicellulose (CMHC) on Bacillus subtilis and Salmonella
3 结 论
(1)以桉木APMP废液为原料进行半纤维素的提取,并对其进行羧甲基化改性,在最佳条件(NaOH/ClCH2COOH=1∶2)时,取代度最高为1.47;并对半纤维素和羧甲基半纤维素进行红外光谱分析,证明半纤维素被成功羧甲基化。
(2)对半纤维素和羧甲基半纤维素进行生物活性分析,最终得CMHC的抗氧化性、吸湿性、保湿性都明显高于HC,且改性后的CMHC具有较强的抑菌性,为未来在生物医药和化妆品领域的发展提供了坚实的理论基础。

