SM22α基因启动子区低甲基化与胃癌发生发展的相关性研究
马国明 左卫微 梁磊 贾纯亮 张磊 刘远廷 李景武 赵辉
胃癌是一种常见的恶性胃肠道肿瘤,近年来,尽管对胃癌的诊断和治疗取得了很大的进步,但胃癌患者5年总生存率仍然较低[1-3]。随着分子生物学技术的发展,蛋白质组织学技术的广泛应用可使研究人员发现和鉴定出一些可用于肿瘤诊断、预后评估及靶向治疗的生物标志物。平滑肌蛋白22α(smooth muscle 22 alpha,SM22α)是新近发现的一种与胃癌发生有关的分子标志物[4]。SM22α是一种细胞骨架相关蛋白,可通过与细胞骨架的肌动蛋白结合,参与细胞骨架构成并调节细胞的收缩功能。此外,SM22α还可能在细胞分化、迁移、侵袭和细胞外基质重构等过程中发挥重要作用[5,6]。研究表明,SM22α可以通过促进MMP-2的表达从而增加肿瘤细胞的侵袭和转移能力[7],在胰腺癌、食管癌、大肠癌等多种肿瘤组织中,SM22α均有不同程度的上调[8-10]。通过应用蛋白质组学技术,Huang等[4,11]发现胃癌组织中SM22α的表达明显高于正常癌旁组织。然而其表达上调的分子机制目前尚不明确。DNA甲基化在调控真核细胞基因表达方面起重要作用,基因启动子区CpG岛的甲基化可引起染色质构象发生改变,导致转录因子无法与其DNA上的结合位点结合,从而抑制基因的转录[12]。本研究检测胃癌组织及正常癌旁组织中SM22α基因启动子的甲基化状态及mRNA的表达情况,探讨它们的相关性及与胃癌发生发展的关系。
1 资料与方法
1.1 一般资料 选取2015年1月至2017年10月我院胃癌患者56例的癌组织及相应正常癌旁组织标本(距癌组织>6 cm);其中男35例,女21例;年龄39~76岁,中位年龄58岁。所有患者术前均未进行放化疗治疗,所取标本均经过术后病理证实。标本在离体后30 min内采集,迅速放入装有RNAlater液的冻存管里并浸泡,于4℃冰箱里过夜后转置于-20℃冰箱里低温保存备用。标本和资料收集均由患者本人及家属知情同意,并获得医院伦理学委员会批准通过。
1.2 主要试剂与仪器 DNA提取试剂盒(北京天根生物有限公司);EZ DNA Methylation-Gold试剂盒(美国Zymo Research公司);PCR反应试剂盒(美国Promega公司);TRIzol试剂盒(美国Invitrogen公司);RevertAid cDNA 合成试剂盒(美国Promega公司);qPCR反应试剂盒(上海凯杰生物技术有限公司);引物合成(上海生工公司);荧光定量PCR仪(7500 型)为美国ABI公司产品。
1.3 检测方法
1.3.1 DNA提取及甲基化特异性聚合酶链反应(MSP):应用DNA提取试剂盒提取组织DNA。应用EZ DNA Methylation-Gold试剂盒将DNA进行亚硫酸氢盐修饰。SM22α甲基化引物:上游引物 5’-AAT AGT GAA GTA GGA GTA GTC GTA AGT TC-3’,下游引物 5’-AAT CTA CCG AAA CTA CCG AAA C-3’;SM22α非甲基化引物:上游引物 5’-GAA TAG TGA AGT AGG AGT AGT TGT AAG TTT-3’,下游引物 5’-CAA TCT ACC AAA ACT ACC AAA AC-3’。将亚硫酸氢盐修饰的每个组织标本DNA进行2次PCR扩增(一次SM22α甲基化引物扩增;另一次SM22α非甲基化引物扩增),反应产物进行琼脂糖凝胶电泳,在凝胶成像仪下摄影成像并保存结果。阳性对照及阴性对照:以甲基转移酶处理后的正常人外周血DNA为模板,通过上述PCR扩增得到的产物为甲基化阳性对照;无菌去离子水代替模板 DNA 所得的PCR产物为阴性对照。结果判定:由SM22α甲基化引物扩增出目的条带,SM22α非甲基化引物未扩增出目的条带者为完全甲基化;由SM22α非甲基化引物扩增出目的条带,而SM22α甲基化引物无目的条带者为非甲基化;SM22α甲基化引物和非甲基化引物均扩增出目的条带者为部分甲基化,也记为SM22α甲基化阳性。
1.3.2 总RNA提取及qRT-PCR:应用TRIzol试剂盒抽提组织总RNA,测定其含量和纯度,然后进行逆转录。应用RevertAid cDNA合成试剂盒将总RNA逆转录合成cDNA。qPCR反应条件设定为:95℃预变性5 min;然后进行35个循环:95℃变性15 s、58℃退火30 s、72℃延伸25 s;最后95℃变性15 s、60℃退火60 s、95℃延伸30 s。反应引物:SM22α上游引物 5’-AGG TGT GGC TGA AGA ATG GCG-3’,下游引物 5’-TCT TCG TCT ACA TAA TCC TC-3’;GAPDH作为内参,上游引物 5’-ACC ACA GTC CAT GCC ATC AC-3’,下游引物 5’-TCC ACC ACC CTG TTG CTG TA-3’。 根据样品的Ct值,采用2-ΔΔCT法进行计算获得mRNA的相对表达量,每个样本均设3个副孔,取3次结果平均值为实验结果。

2 结果
2.1 SM22α在胃癌组织和正常癌旁组织中甲基化状态和mRNA表达情况 56个胃癌组织标本中,有16个标本检测到SM22α基因启动子区的甲基化,甲基化率为28.6%;而正常癌旁组织中检测到29个,甲基化率为51.8%,2组比较差异有统计学意义(χ2=6.278,P=0.012)。SM22α基因mRNA在胃癌组织中的平均表达量为(1.43±0.53),在正常癌旁组织中的平均表达量为(0.85±0.34)。胃癌组织中SM22α基因mRNA的表达量显著高于正常癌旁组织(t=-5.728,P<0.01)。见图1。
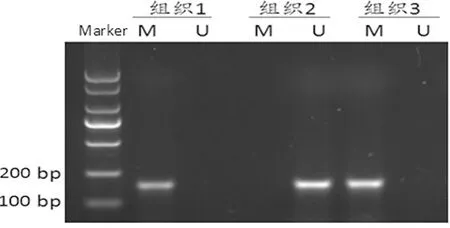
图1 不同组织标本的甲基化检测,M甲基化条带,U非甲基化条带
2.2 甲基化阳性和阴性的胃癌组织中SM22α基因mRNA表达情况 SM22α基因mRNA在甲基化阳性胃癌组织中的平均表达量为(1.16±0.41),在甲基化阴性胃癌组织中的平均表达量为(1.54±0.55)。甲基化阳性组织中mRNA的平均表达量明显低于甲基化阴性组织(t=2.513,P=0.015)。
2.3 SM22α基因甲基化状态及mRNA表达与胃癌患者临床病理特征的关系 胃癌组织中SM22α基因启动子区甲基化状态与胃癌患者的淋巴结转移显著相关(P=0.013),而与患者的年龄、性别、分化、分期及肿瘤大小无显著相关性(P>0.05)。胃癌组织中SM22α基因mRNA的表达量同样与胃癌患者淋巴结转移显著相关(P=0.036),而与其他病理参数无显著相关性(P>0.05)。见表1。
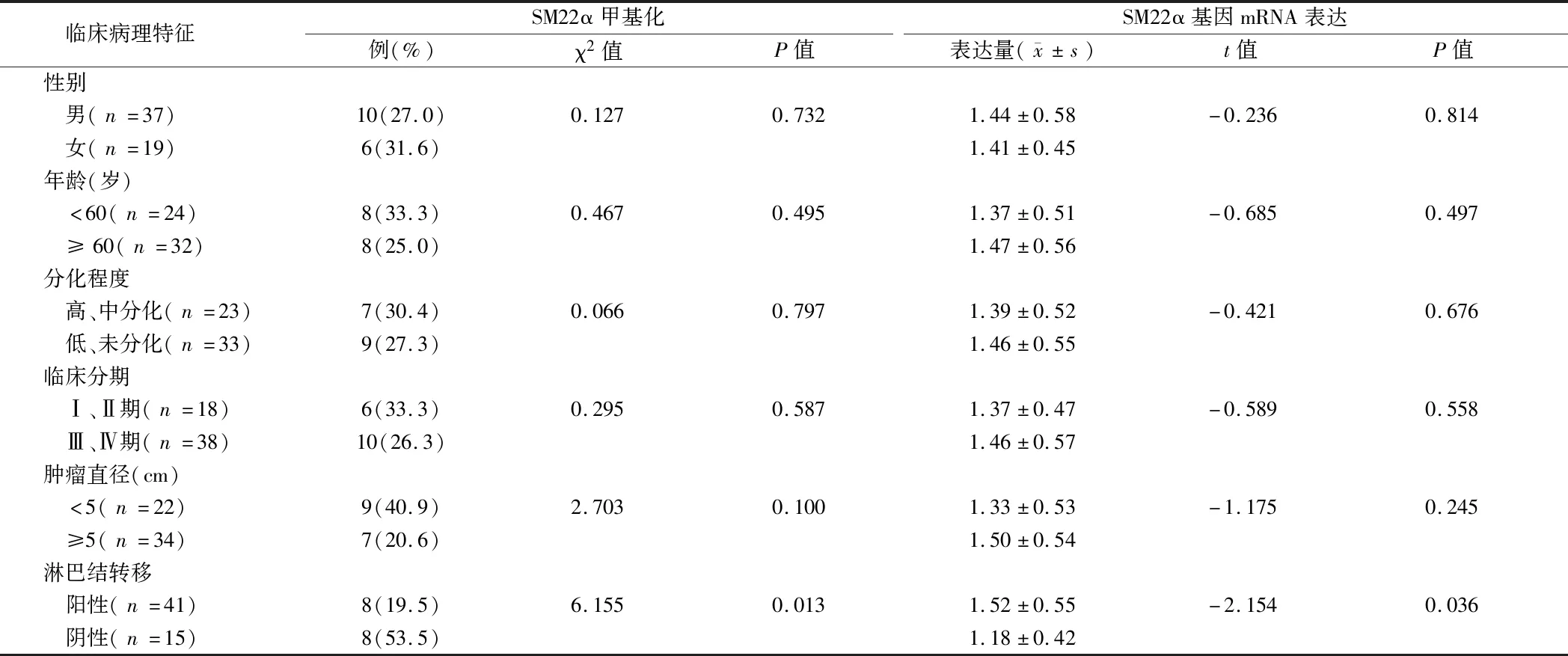
表1 SM22α基因甲基化状态及mRNA表达与胃癌患者临床病理特征的关系
3 讨论
本研究比较胃癌患者癌组织和正常癌旁组织SM22α基因启动子区甲基化状态及其mRNA表达情况,我们发现胃癌组织中SM22α基因启动子区的甲基化率显著低于正常癌旁组织,mRNA表达水平显著高于正常癌旁组织,且甲基化阳性的胃癌组织中SM22α基因mRNA表达量显著低于甲基化阴性的胃癌组织。此外,我们还发现胃癌组织中SM22α基因启动子区甲基化状态及其mRNA表达水平与胃癌患者的淋巴结转移有相关性。
SM22α最先在平滑肌细胞中被发现,后来在一些上皮细胞及纤维细胞中发现也有表达[13,14]。SM22α通过和细胞骨架蛋白肌动蛋白结合,在稳定细胞结构及维持细胞分化表型等方面发挥重要作用。近期的一些研究表明SM22α在多种恶性肿瘤组织中表达异常,如在胰腺癌、食管癌、大肠癌等癌组织中均有不同程度表达上调[8-10]。Zhou等[15]研究发现SM22α表达升高可以增加大肠癌细胞的侵袭能力。在胰腺癌细胞株中,SM22α的过表达可提高胰腺癌细胞株增殖能力,增加侵袭和转移能力[8]。Huang等[4,11]通过应用蛋白质组学技术均发现胃癌组织中SM22α的表达明显高于正常癌旁组织,本结果与上述研究结果一致,胃癌组织中SM22α基因mRNA的表达水平显著高于正常癌旁组织,且临床病理参数分析显示SM22α的表达水平与胃癌患者淋巴结转移显著相关,表明 SM22α基因的高表达可能增加胃癌细胞的侵袭能力,在胃癌发生、发展中起重要作用。然而SM22α在胃癌组织中表达异常的调控机制尚不明确。
DNA甲基化是一种重要的表观遗传学修饰,在调控组织特异性基因表达等方面起重要的作用。Yamamura等[16]研究表明平滑肌细胞中SM22α的表达水平主要由其基因启动子区甲基化状态来调控。在大肠癌细胞株HT29中,Zhao等[17]应用去甲基化试剂“地西他滨”处理细胞后,SM22α的mRNA及蛋白表达明显升高。此外,Sayar等[18]报道了乳腺癌组织中SM22α基因呈高甲基化状态,且其甲基化状态与SM22α的表达呈负相关性。本研究首次检测了胃癌组织中SM22α基因启动子区甲基化状态,结果发现胃癌组织中SM22α基因启动子区的甲基化率显著低于正常癌旁组织,且胃癌组织中SM22α基因甲基化状态与患者淋巴转移有相关性。此外,甲基化阳性的胃癌组织中SM22α基因mRNA表达水平显著低于甲基化阴性的胃癌组织。结果表明胃癌组织中SM22α基因启动子区的低甲基化可能通过上调其表达水平,从而增加胃癌细胞的侵袭能力,促进胃癌的发生和发展。
综上所述,胃癌组织中SM22α基因启动子区的甲基化率显著低于正常癌旁组织,其mRNA表达水平显著高于正常癌旁组织,甲基化阳性的胃癌组织中SM22α基因mRNA表达水平显著低于甲基化阴性的胃癌组织,且SM22α甲基化状态及mRNA表达均与胃癌患者的淋巴结转移有相关性。表明SM22α基因启动子区的低甲基化导致其表达升高可能在胃癌发生、发展中发挥着重要作用,有可能成为胃癌分子诊断和治疗的重要靶点。

