姜黄素对糖尿病肾病大鼠肾功能及肾组织JNK、Notch2/hes1信号通路的影响
邓文荣,石文清,李海俏,周志凌
1珠海市中西医结合医院,广东珠海519020;2珠海市人民医院
糖尿病肾病(DN)是糖尿病最常见的微血管并发症之一,若肾损伤未有效控制,可进一步发展为终末期DN,成为糖尿病患者死亡的主要原因。DN表现为肾小球高滤过、肾脏肥大、白蛋白尿甚至脓毒症[1]。DN早期干预以血压、血糖控制和饮食干预为主,终末期DN需进行血液透析、腹膜透析、器官移植等干预;然而早期干预控制病情效果有限,透析干预局限性较大且可出现心脑血管意外;器官移植肾源少,可出现排异反应,且并不能防止DN再次发生,对合并症状和疾病无明显改善效果[2]。因此,寻找有效防治DN药物十分必要。内质网应激是指氧化还原状态改变和钙离子平衡紊乱影响内质网引发的内质网细胞自我保护反应,内质网应激是糖尿病早期肾损伤的主要发病机制,其中涉及JNK、Notch2/hes1等多种凋亡信号通路[3]。通过干预这些信号通路来抑制肾脏内质网应激,可能成为DN的有效干预途径之一。姜黄素是从姜科植物姜黄中提取的物质,具有抗氧化、消炎作用,用于肿瘤治疗、免疫调节和抗肾纤维化等方面已获得良好效果,且其在DN中的应用也得到研究认可[4,5]。2019年4~7月,我们观察了姜黄素对DN大鼠的治疗作用,以及对肾脏内质网应激介导的凋亡信号通路JNK、Notch2/hes1的影响,探讨姜黄素肾脏保护作用的机制,旨在为姜黄素治疗DN提供理论依据。
1 材料与方法
1.1 动物、试剂与仪器 SPF级SD雄性大鼠70只,体质量205~230 g,购自广州中医药大学动物实验中心。大鼠自由饮水摄食,环境温度(22±2)℃,相对湿度55%±10%,适应性饲养1周后用于实验。链脲佐菌素(STZ)、姜黄素均购自美国Sigma公司,PCR试剂盒购自日本TaKaRa公司,BCA试剂盒购自上海江莱生物科技有限公司。恒温培养箱购自美国Forman Scientific公司,倒置显微镜购自日本Nikon公司,PCR扩增仪购自美国BIORAD公司。
1.2 动物分组与造模 将大鼠随机分成正常组、模型组、姜黄素组各20只。模型组和姜黄素组腹腔注射STZ 50 mg/kg(避光溶解于pH 4.28的柠檬酸钠缓冲液),7 d后取尾静脉血检测空腹血糖,收集尿液检测尿微量白蛋白、尿肌酐,以血糖水平≥16.7 mmol/L、尿微量白蛋白和尿肌酐显著高于正常组为造模成功。正常组常规饲养。
1.3 药物干预 造模成功后,姜黄素组给予姜黄素混悬液(溶解于1%羧甲基纤维素钠溶液)200 mg/(kg·d)灌胃,正常组和模型组给予等体积1%羧甲基纤维素钠溶液灌胃,连续8周。
1.4 血糖及肾功能指标检测 大鼠腹主动脉采血8~10 mL,1 000 r/min离心5 min,分离血清与血浆,-20 ℃保存待测。采用罗氏血糖仪检测血糖(GLU),日立7800型全自动生化分析仪检测糖化血红蛋白(HbA1c)、肌酐(Scr)、尿素氮(BUN)、血浆白蛋白(ALB)。
1.5 肾组织病理检查 处死大鼠,取肾组织加入4%甲醛溶液固定,常规行石蜡包埋,切成厚度为4 μm的连续切片。常规行HE及PAS染色,400倍光镜下观察肾组织病理变化。
1.6 肾组织JNK、Notch2、hes1 mRNA表达检测 采用RT-PCR法。取大鼠肾组织,TRIzol法提取组织总RNA,逆转录合成cDNA。引物由上海生物工程公司设计合成。引物序列:JNK上游5′-TGATGACGCTTACGTGGTA-3′,下游5′-GGCAAACCATTT CTCCCATA-3′;Notch2上游5′-CACCAACTTACGGATTAAACAAGCA-3′,下游5′-TCCGATTCACTGACAACAGACAC-3′;hes1上游5′-TGCTTTCCTCATCCCCAATG-3′,下游5′-GAAGGCGACACTGCGTTAGG-3′;内参β-actin上游5′-CGTTGACATCCGTAAAGACCTG-3′,下游5′-TAGGAGCCAGGGCAGTAATC-3′。反应体系:RNA 5 μg、2×ES Reaction Mix 10 μL、dT18 1 μL、RIES Mix 1 μL,并补水至20 μL。反应条件:94 ℃预变性5 min,94 ℃变性0.5 min、64 ℃退火 0.5 min、72 ℃延伸45 s,共33个循环,72 ℃延伸10 min。取PCR扩增产物,常规行琼脂糖凝胶电泳和成像系统扫描,采用2-ΔΔCT法计算目的基因的相对表达量。
1.7 肾组织JNK、Notch2、hes1表达检测 采用Western blotting法。取大鼠肾组织200 mg,冰上研碎,添加Ripa裂解液进行裂解。1 000 r/min离心5 min,取上清液,采用BCA法测定总蛋白质浓度。取5 μL上清液,加入上样缓冲液,SDS-聚丙稀酰胺凝胶电泳,加入一抗,37 ℃摇床孵育2 h,4 ℃孵育过夜。加入二抗羊抗兔IgG-HRP,37 ℃摇床孵育2 h。按照Marker分割硝酸纤维素膜,暗室内曝光。采用Image J 2X软件分析各条带平均光密度,以目的条带与内参β-actin的比值作为蛋白的相对表达量。

2 结果
2.1 三组血糖及肾功能指标比较 与正常组比较,模型组GLU、HbA1c、Scr、BUN水平均升高而ALB水平降低(P均<0.05);与模型组比较,姜黄素组GLU、HbA1c、Scr、BUN水平下降而ALB水平升高(P均<0.05)。见表1。
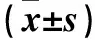
表1 三组血糖及肾功能指标比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
2.2 三组肾组织病理结果比较 正常肾组织细胞排列紧密,细胞结构完整良好,细胞核清晰,血管上皮细胞为扁平或椭圆形,肾小管上皮细胞呈圆形,核大,于管腔外排列呈环形,肾小管结构保持良好。模型组可见不同程度的肾间质小管片状坏死,小管上皮细胞肿胀和空泡变性,肾小管上皮细胞坏死脱落,管腔变大,炎性细胞浸润;姜黄素组也存在上述病理改变,但较模型组明显改善。
2.3 三组肾组织JNK、Notch2、hes1 mRNA表达比较 与正常组比较,模型组JNK、Notch2、hes1 mRNA相对表达量均升高(P均<0.05);与模型组比较,姜黄素组JNK、Notch2、hes1 mRNA相对表达量降低(P均<0.05)。见表2。
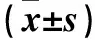
表2 三组肾组织JNK、Notch2、hes1 mRNA表达比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
2.4 三组肾组织JNK、Notch2、hes1蛋白表达比较 与正常组比较,模型组JNK、Notch2、hes1蛋白表达水平均升高(P均<0.05);与模型组比较,姜黄素组JNK、Notch2、hes1蛋白表达水平均降低(P均<0.05)。见表3。
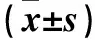
表3 三组肾组织JNK、Notch2、hes1蛋白表达比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
3 讨论
糖尿病的发生发展涉及多个生理病理过程,其中自由基引发以及介导的机体氧化应激损伤、机体自由基清除能力下降,而内质网应激诱导的凋亡信号通路与糖尿病导致的心血管系统、肾脏等并发症密切相关[6]。抑制糖尿病大鼠肾脏Notch通路相关基因表达有助于减少其蛋白尿排泄,缓解病情[7]。姜黄具有破血行气止痛功效,用于胸痹心痛、痛经、风湿痛、跌扑肿痛等具有良好效果[8],姜黄提取物姜黄素具有抗氧化、抗癌、抗老年痴呆、抗炎效果[9]。在肾脏病变中,姜黄素可通过抗氧化、促进免疫调节和抗肾纤维化等途径保护肾组织、改善肾功能,且不良反应较少,安全性较高[10]。
GLU和HbA1c是反映糖尿病病情的重要指标,长期糖代谢紊乱导致GLU、HbA1c水平升高,引起肾小球高血流动力学异常和肾小球高滤过状态,入球部小血管膨胀。随着DN的发展,开始出现蛋白尿和肾小球滤过率的降低,尿蛋白增多;进展至肾功能不全失代偿期后,由肾小球滤过排泄的肌酐和尿素氮升高,而血浆ALB低水平亦与肾小球滤过率降低密切相关,提示肝脏的合成功能也出现了异常[11~13]。本研究结果显示,模型组GLU、HbA1c、Scr、BUN水平均高于正常组,ALB水平则低于正常组,肾组织病理检查显示不同程度的肾间质小管片状坏死,小管上皮细胞肿胀和空泡变性,肾小管上皮细胞坏死脱落,管腔变大,炎性细胞浸润。表明DN大鼠发生肾小管坏死和间质性肾炎,存在严重的肾功能损伤。与模型组比较,姜黄素组GLU、HbA1c、Scr、BUN水平明显下降而ALB水平升高,肾脏组织损伤程度减轻。这表明姜黄素干预有助于控制血糖,改善肾小管滤过功能,从而减轻肾损伤。
研究显示,抗氧化系统异常是影响糖尿病发生发展的重要机制[14]。氧化还原状态改变可引发内质网应激,而内质网介导的IRE-1-TRAF2-ASK1-JNK相关通路凋亡信号通路中,磷酸化的IRE-1α与TRAF2相互聚集,激活凋亡信号调节激酶1(ASK1),形成IRE1α-TRAF2-ASK1复合物,然后激活下游的c-Jun氨基末端蛋激酶(JNK),进而参与细胞凋亡、增殖、介导炎性反应等过程[15]。本研究结果显示,模型组肾组织JNK、Notch2、hes1 mRNA及蛋白表达均较正常组升高,进一步证实了内质网应激介导的凋亡信号通路JNK、Notch2/hes1异常可能与DN有关。与模型组比较,姜黄素组肾组织JNK、Notch2、hes1 mRNA及蛋白表达水平降低,提示姜黄素可能通过干预肾脏内质网应激介导的凋亡信号通路JNK、Notch2/hes1达到肾脏保护作用。
综上所述,姜黄素能够降低DN大鼠的血糖,改善其肾功能,具有肾脏保护作用;其机制可能是通过抑制肾脏内质网应激介导的凋亡信号通路JNK、Notch2/hes1,抑制肾脏细胞凋亡,从而达到肾脏保护效果。

