miR-21基因缺失对糖尿病肾病小鼠肾损伤的影响及机制
李潇,杨彤,李小兵,赵国丽,高誉欣,王浩,牛世英,张月英
1济南大学 山东省医学科学院医学与生命科学学院,济南250200;2山东第一医科大学(山东省医学科学院);3临沂市第三人民医院
糖尿病肾病(DN)是糖尿病病情进展过程中发生的一种严重的致死性微血管并发症,其主要病理变化为肾脏功能和结构的改变,包括肾小球和肾小管肥大、基底膜增厚、足突融合等,后期发生肾脏不同程度的纤维化,导致肾脏功能丧失,是终末期肾病的主要病因之一[1]。微小RNA(miRNA)是一类非编码RNA,含21~25个核苷酸,转录后调控生命体各器官的生物学功能,在细胞活性、增殖、炎性反应、纤维化等信号通路中起到重要作用[2]。近年研究发现,miR-21与多种脏器纤维化关系密切,而转化生长因子β1(TGF-β1)/Smad通路可影响肾脏间质中纤维连接蛋白(FN)、Ⅰ型胶原蛋白(ColⅠ)的聚集,从而参与DN纤维化过程。2019年2~11月,我们采用miR-21基因敲除(miR-21 KO)小鼠构建DN模型,观察miR-21基因敲除对肾脏的保护作用,并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验动物 8周龄雄性C57BL/6小鼠20只,体质量18~20 g,其中野生型(WT)小鼠10只、miR-21 KO小鼠10只。饲养于SPF标准实验室,自由饮食摄水,环境温度18~25 ℃、相对湿度60%~80%,每日更换垫料、饲料和水。所有实验操作均符合山东第一医科大学动物伦理学要求。
1.2 动物分组与造模方法 将WT鼠分成WT-Con组、WT-DN组各5只,miR-21 KO鼠分成KO-Con组、KO-DN组各5只。禁食24 h后,WT-DN组、KO-DN组腹腔注射STZ 60 mg/kg(溶解于pH为4.5的柠檬酸缓冲液),WT-Con组、KO-Con组腹腔注射等量生理盐水作为对照。1周后采集尾静脉血检测空腹血糖及尿微量白蛋白、尿肌酐,以空腹血糖≥16.8 mmol、尿微量白蛋白和尿肌酐显著升高为DN造模成功。
1.3 标本采集 造模成功12周后,使用水和氯醛麻醉小鼠,快速灌注4%多聚甲醛进行固定。快速剥离双肾,一侧肾脏置于4%甲醛溶液固定,常规脱水,石蜡包埋,连续切3 μm厚切片,用于组织病理学的观察和免疫组化检测;另一侧肾脏用于制作电镜标本,固定在2.5%戊二醛溶液中。
1.4 肾组织病理观察 采用HE染色。取肾组织切片,二甲苯脱蜡至水,苏木素浸染10 min;流水冲洗,盐酸乙醇分化,流水返蓝,伊红染色5 min;随后至70%、80%、90%、95%、100%梯度乙醇脱色,二甲苯Ⅰ、Ⅱ透明;树胶封片,显微镜下观察肾小球和肾小管的病理改变。
1.5 肾脏纤维化程度观察 采用Masson染色。取肾组织切片,常规脱蜡至水。取出切片,在重铬酸钾-醋酸溶液中浸洗1 h以上除去汞盐沉淀。蒸馏水洗涤,经Masson丽春红酸性复红染液浸染5 min,再用0.2%冰醋酸水溶液浸洗片刻,之后用1%磷钼酸水溶液分化处理3~5 min。直接加入苯胺蓝染色5~10 min,再以0.2%冰醋酸浸洗片刻,95%乙醇及无水乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察肾脏纤维化改变,重点观察肾小管间质是否出现胶原纤维增多。
1.6 肾组织超微结构观察 将肾脏组织切成1 mm×1 mm×1 mm的小块,2.5%戊二醛固定;使用电子透射显微镜(日本JEOL公司)扫描,观察肾小球、肾小管、系膜区的亚显微结构改变。
1.7 肾组织TGF-β1、FN、ColⅠ蛋白表达检测 采用免疫组化法。取肾组织切片,常规脱蜡至水,3% H2O2溶液孵育20 min,加入pH 6.0的柠檬酸钠缓冲液中,加盖煮20 min进行抗原修复。滴加小鼠血清封闭液,37 ℃孵箱中封闭30 min。滴加一抗(TGF-β1稀释比例为1∶200,FN为1∶500,ColⅠ为1∶100),4 ℃过夜。PBS冲洗5 min×3次,滴加辣根过氧化物酶标记的鼠抗山羊二抗,37 ℃孵育1 h。PBS冲洗5 min×3次,DAB显色,苏木素复染,1%盐酸乙醇分化,流水返蓝。梯度乙醇脱水,二甲苯透明,树胶封片。显微镜下观察棕黄色阳性信号表达部位,并对免疫组化结果进行评分。随机选取5个高倍镜视野(×400),计数阳性细胞数占计数细胞的百分比,并观察免疫反应着色强度。阳性细胞百分比评分标准:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;着色强度评分标准:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。以两者积分相乘所得数值作为蛋白表达量。

2 结果
2.1 各组肾组织病理学结果比较 WT-Con组和KO-Con组肾脏组织肾小球及肾小管结构正常,未见明显病理变化。WT-DN组和KO-DN组均出现肾小球肥大,肾脏基底膜增厚或薄厚不均一改变,肾小管出现空泡样改变,偶见肾小管间质纤维化及系膜区有异样物质沉积。与WT-DN组相比,KO-DN组病变改变明显减轻。
2.2 各组肾组织纤维化程度比较 WT-Con组和KO-Con组肾小球、肾小管及间质未见异常胶原增多现象。WT-DN组和KO-DN组肾间质可见蓝色胶原纤维,肾小球基底膜不同程度增厚;WT-DN组肾小管间质可见大量胶原纤维聚集。与WT-DN组相比,KO-DN组肾小管间质纤维化明显减轻。
2.3 各组肾组织超微结构病理变化 WT-Con组和KO-Con组肾脏基底膜厚度均匀,足细胞伏于基底膜外侧,胞质伸出许多足突,系膜区由系膜细胞和系膜基质组成。WT-DN组肾脏可见明显基底膜弥漫性增厚,足细胞数量减少,足突间不同程度融合,系膜区有复合物沉积。与WT-DN组比较,KO-DN组肾脏超微结构损伤得到缓解,可见基底膜部分增厚,部分足突融合,少量胶原纤维聚集(见图1)。

图1 各组肾脏超微结构病理变化(15 000×)
2.4 各组肾组织TGF-β1、FN、ColⅠ蛋白表达水平比较 与WT-Con组和KO-Con组相比,WT-DN组和KO-DN组肾脏TGF-β1、FN、ColⅠ蛋白表达水平升高;与WT-DN组相比,KO-DN组TGF-β1、FN、ColⅠ蛋白表达水平降低(P均<0.05)。见表1。
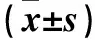
表1 各组肾组织TGF-β1、FN、ColⅠ蛋白表达水平比较
注:与WT-Con组相比,aP<0.05;与KO-Con组相比,bP<0.05;与WT-DN组相比,cP<0.05。
3 讨论
DN是糖尿病最常见的并发症之一,其病理特征伴有严重的微血管病变,是各种慢性肾病所导致的终末期肾病的主要原因,最终会引发肾小管间质纤维化的发生[3]。近年研究发现,miR-21与肝脏、肺脏、肾脏的纤维化病变关系密切[4~8],但其在DN损伤及肾纤维化中的作用尚存在争议。Liu等[9~11]报道,下调miR-21表达可减轻肾纤维化进展的程度,但具体机制尚未阐明。然而Zhang等[12]认为miR-21对DN患者可能是一种保护性因素,早期DN病变过程中miR-21表达下降,miR-21的表达有利于抑制系膜细胞增生,缓解肾脏纤维化过程。因此,有必要进一步明确miR-21在DN中的作用及机制。
本研究采用miR-21 KO小鼠构建DN模型,观察miR-21 KO对肾脏的保护作用,并初步探讨其可能的作用机制。HE染色显示,WT-DN小鼠肾脏出现明显肾小球肥大,肾小球基底膜改变及系膜区细胞外基质增多,而KO-DN小鼠肾脏出现轻微病变,仅表现为肾小球基底膜增厚,肾小管空泡化。表明miR-21基因缺失可以缓解DN的基本病理改变。进一步采用透射电镜观察小鼠肾脏超微结构病理变化,发现WT-DN小鼠肾脏基底膜增厚且厚薄不一,足细胞足突融合,系膜区有高密度物质沉积,并且有大量肾小管阻塞,几乎看不到正常的肾小管;而KO-DN小鼠肾脏超微结构病理变化明显减轻,主要表现为基底膜轻度增厚,部分足突融合,少量高密度物质沉积。进一步表明miR-21基因缺失可以抑制DN肾损伤。
Masson染色可以观察组织胶原纤维积聚情况,评价纤维化病变程度。本研究结果显示,WT-DN小鼠肾间质可见蓝色胶原纤维,肾小球基底膜有不同程度增厚;WT-DN小鼠肾小管间质可见大量胶原纤维聚集;与WT-DN小鼠比较,KO-DN小鼠肾小管间质纤维化明显减轻。这表明miR-21基因缺失可以减少胶原纤维的沉积,也就是说,miR-21对于DN是一种不利因素。
TGF-β1广泛分布于肾小球、肾小管及肾间质,可促进肾小球系膜细胞增生,加强基质蛋白的分泌,导致肾小球纤维化及炎症反应[13,14],被认为是致纤维化的重要因子,在DN的发展过程中起关键作用。DN的早期改变主要是肾小球肥大、系膜细胞增生、足突融合甚至消失,系膜细胞进一步分泌大量基质蛋白如FN、ColⅠ,大量聚集致肾脏纤维化[15]。一方面,TGF-β1可以促进细胞外基质蛋白聚集,引起肾小球基底膜增厚,从而加剧肾间质纤维化进程;另一方面,TGF-β1介导的Smad通路可以诱导肾间质发生上皮间质转化,从而引起肾间质的纤维化过程[16~18]。杜正驰等[19]报道,DN患者尿液中FN、ColⅠ水平与TGF-β1呈正相关,说明TGF-β1可能有刺激FN、ColⅠ在肾小管间质增多、聚集的作用。本研究结果显示,与与WT-Con组和KO-Con组相比,WT-DN组和KO-DN组肾脏TGF-β1、FN、ColⅠ蛋白表达水平升高;与WT-DN组相比,KO-DN组TGF-β1、FN、ColⅠ蛋白表达水平降低。这表明miR-21基因缺失可以缓解DN小鼠的肾脏病变,其作用机制可能与抑制TGF-β1分子从而减少肾脏基质蛋白表达有关。
综上所述,miR-21缺失能够抑制DN小鼠的肾脏纤维化改变,其机制可能与调控肾脏纤维化因子TGF-β1及相关基质蛋白FN、ColⅠ表达有关。因此认为,miR-21缺失可能对肾脏具有保护作用,有望作为DN纤维化的治疗靶点。

