MNU诱导大鼠膀胱癌基底膜病变与LN的相关性
姜 涛 高海捷
膀胱癌在全球癌症死亡率中排名13,是全球第九大最常见的癌症[1];作为泌尿外科最常见的恶性肿瘤之一,近十年间其发病率呈逐年增长趋势[2];约50%将在初次诊断后2年内再次复发,16%~25%将在内镜切除术后复发[3],严重影响人们的身心健康;为了更好的研究膀胱癌的生物学行为,动物实验成为了必不可少的一部分;而动物因为有着与人类相似的生理结构和遗传特性,对人类疾病动物模型的研究在一定条件下往往可以实际运用到人类。本次实验旨在通过对65只SD成年雌性大鼠膀胱癌造模过程的观察,探讨其发生、发展与基底膜中LN的相关性。
1 材料与方法
1.1 材料
实验的65只SD成年雌性大鼠,平均重量(185±35)g,购置于西安交通大学动物实验室;所有老鼠随机分为2组,实验组50只,对照组15只;正常喂养2周后进行实验。MNU购于美国Sigma公司,枸橼酸缓冲液、多聚甲醛购于灏洋生物有限公司;MNU(1 g装)置于4 ℃冰箱保存,实验前称取0.2 g加入10 ml(PH=6.0)的枸橼酸溶液混合配置成20 mg/ml MNU溶液,1小时内用完。5%的水合氯醛由陕西中医药大学实验中心自制;无菌硬膜外导管来自陕西中医药大学附属医院手术室;LN抗体来自武汉博士德公司。
1.2 方法
膀胱灌注:对实验组50大鼠进行MNU溶液膀胱灌注;利用10%的水合氯醛溶液(0.3 ml/100 g)进行腹腔注射麻醉;待大鼠麻醉后仰卧固定,用碘伏对尿道口进行消毒,选取硬膜外导管钝头面截取5 cm对大鼠进行导尿,导尿后予以膀胱灌注0.1 ml MNU溶液,拔出导管后按压夹闭尿道。对照组同样在水合氯醛麻醉下以0.1 ml枸橼酸缓冲液进行膀胱灌注。所有大鼠平均1.5~2.0小时排尿。均以含抗生素饮水作为大鼠灌注后饮水,预防感染,2天后恢复正常饮水;膀胱灌注每隔2周进行1次,共进行4次膀胱灌注;病理检测:每次膀胱灌注后1周随机选取实验组4只及对照组2只行HE病理染色观察膀胱粘膜病变情况;免疫组织化学:取与病理检测相对应的组织行免疫组化观察基底膜中LN的情况;最后正常喂养至诱癌终点14周,再对剩余大鼠分别行HE以及免疫组化。
1.2.1 采集标本 大鼠同样在10%的水合氯醛溶液腹腔注射麻醉后,仰卧固定,腹部常规消毒后在下腹部切开1.5 cm左右,钝行分离肌肉,切开膀胱组织观察膀胱粘膜情况,然后取下整块膀胱组织,浸泡于多聚甲醛溶液中;然后对切口进行缝合,最后注射大剂量的水合氯醛处死,安置好。
1.2.2 组织病理检测 膀胱组织常规切片脱蜡至水,水洗,吹干;苏木精复染2 min,水洗,吹干;将实验片放入酒精中浸泡30 s;滴加核固红10 s后,水洗,吹干,封片。
1.2.3 免疫组织化学 免疫组化检测基底膜中LN蛋白的表达情况。切片常规脱蜡至水;30%H2O2蒸馏水稀释10倍,室温10 min以灭活内源性酶,然后水洗;将切片浸入EDTA溶液,微波炉中高火加热至沸腾,放置5、6 min,重复加热第二次,然后自然冷却;滴加5%BSA封闭液,37 ℃ 30 min,甩去多余液体,不洗。滴加适当稀释的一抗(抗体按1∶100稀释),温箱孵育2两小时;PBS(pH 7.2~7.6)洗5 min×3次;滴加生物素化山羊抗兔IgG,37 ℃ 30 min;PBS(pH 7.2~7.6)洗5 min×3次;滴加试剂SABC,37 ℃ 30 min;PBS(pH 7.2~7.6)洗5 min×4次;使用DAB显色试剂盒显色,取1 ml蒸馏水,加试剂盒中A,B,C试剂各1滴,混匀后加至切片,室温显色,镜下控制反应时间约5分钟,蒸馏水洗涤;苏木精轻度复染,封片。
1.2.4 免疫组化结果判定 正常膀胱上皮细胞基底膜LN染色,基底膜呈连续、完整的结构,而膀胱癌细胞基底LN免疫反应物染色呈现不一,呈现出基底膜缺损、基底膜成分LN丢失或无基底膜形态。LN判断标准为:无着色或碎片状为“-”,断线状为“+”,连续状为“++”。
1.3 统计学方法
应用SPSS 19.0版统计软件包进行数据分析处理,对基底膜中LN表达情况采用χ2检验。
2 结果
2.1 一般结果
实验组50只,整个实验阶段死亡6只;实验大鼠病理检测为膀胱癌的有29只,其中原位癌18只,浸润性癌11只,膀胱非典型增生的9只,化学性炎症的5只,表现正常的1只。对照组死亡2只,其余13只病理检测均为正常膀胱组织。本组实验中MNU诱导膀胱癌的发生率为58%;死亡率为12%;导致膀胱粘膜出现其他异常改变为28%;正常为2%。
2.2 病理结果
第1次MNU膀胱灌注后1周,膀胱粘膜开始出现化学性膀胱炎表现;第2次MNU膀胱灌注后1周,膀胱粘膜炎症表现加重并开始出现非典型增生;第3次MNU膀胱灌注后1周膀胱粘膜出现大量异型增生细胞;第4次膀胱灌注后病理检查出现膀胱原位癌表现。诱癌终点14周,病理检查为浸润性癌或原位癌。
2.3 基底膜动态观察(表1)
第1次MNU膀胱灌注后1周,LN结果显示膀胱基底膜开始出现连续性断裂现象;第2次膀胱灌注后1周,LN结果显示膀胱基底膜断裂现象明显并出现小块缺损;第3次膀胱灌注后1周,LN结果显示膀胱基底膜大面积破坏,缺损;第4次膀胱灌注后1周,LN结果显示膀胱基底膜形态完全消失,部分LN缺失;诱癌终点第14周,LN结果显示无膀胱基底膜形态,视野下为散在碎片,大量LN缺失。
2.4 两组LN积分等级表达情况
正常膀胱组织中基底膜LN染色,呈现完整连续,而膀胱癌细胞基底LN呈现出基底膜缺损、基底膜成分LN丢失或无基底膜形态;LN在基底膜中的表达在正常膀胱组织与膀胱癌之间存在差异性统计意义(χ2=25.37;P<0.01),见表2;膀胱癌的发生、发展与基底膜破坏密切相关,且LN的缺失是基底膜破坏导致膀胱癌的因素之一。

表1 两组基膜LN积分等级表达情况/例
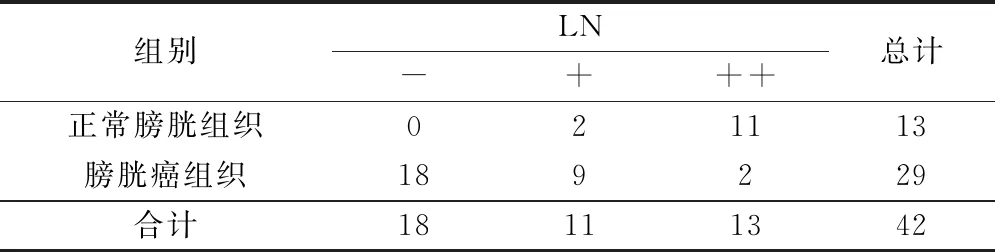
表2 不同组别中的LN积分等级表达情况/例
3 讨论
膀胱癌作为1个罕见高复发率的恶性肿瘤,侵袭和转移是其最主要的生物学特征,过程十分复杂,常包含黏附相关分子、细胞骨架蛋白、信号转导、侵袭转移相关基因、血管生成相关因子和蛋白水解酶等;因此膀胱癌诊治问题一直困扰着人们,为了更加有效的研究膀胱癌,Black等认为在膀胱癌动物模型必不可少[4];MNU诱导大鼠膀胱癌模型发生最早是由国外学者CC Irving 在1979首次报道的[5];随着时代的发展和需求的不同,各异的造模方式也应运而生,药物诱导方面还可以应用N-丁基-N (4-羟丁基) 亚硝胺 (BBN)、硝基呋喃噻唑甲酰胺 (FANFT);原位、异位移植膀胱癌细胞和调控特定基因诱发膀胱癌等也已十分成熟;但经典的MNU膀胱灌注诱导大鼠膀胱癌动物模型其拥有成瘤率高、简单易操作、周期短、大鼠成活率高等优点为人们所接受,广泛用于膀胱癌进一步研究探索[6-7],成为膀胱癌动物模型首选。而LN是在细胞外基质的基底层区域内发现的大小在(400~900 kDa)糖蛋白家族;是胚胎发育中出现最早的细胞外基质成分;作为一个桥梁分子,介导细胞同基膜结合;参与多种重要的生物学活动,包括参与基底膜的组成、细胞的黏附、游走、增殖、分化等;随着研究的进展,人们发现LN不仅存在于正常细胞中,在肿瘤细胞中的表达更为异常,可诱导肿瘤细胞增加蛋白水解酶的活性,分解并减少了LN,促进肿瘤恶性表型的发生,是影响肿瘤浸润转移的关键点;如Oh等研究发现LN异常表达可能是甲状腺乳头状癌预后及是否淋巴结转移的有效指标,可增加癌细胞入侵的能力,影响甲状腺癌患者的预后[8];Carpenter研究发现LN332作为肺组织的组分,其可以诱导乳腺癌细胞在转移期间转运至肺,并且有可能为抗转移治疗提供了靶标[9];Kiyokawa 在对肝细胞癌(HCC)早期诊断的研究中发现单体LN-γ2可以作为肝细胞癌的新型生物标志物[10];Liu 等在对肺癌的研究发现LN-5可能是治疗肺癌患者的新的治疗策略[11],Harryman研究认为LN-β3链有可能是有前景的生物标志物,也是个体化治疗预防或阻止转移扩散的合理靶点[12];大量的研究成果都表明LN在肿瘤侵袭转移方面的重要性。
在关于膀胱癌的研究中Sankiewicz等研究发现健康人和膀胱癌患者中LN-5的浓度明显不同,认为LN-5有可能作为潜在的膀胱癌的标记物[13];Nakagawa 等研究认为LN-γ2可能是诊断非肌层浸润性膀胱癌的有希望的生物标志物,可以通过监测尿液中的表达情况,用于诊断和提示术后复发的可能性[14];Kang等认为膀胱癌患者恶性程度越高,则表达更多LN332且LN332刺激膀胱癌细胞的运动和侵袭[15];Chang 研究发现LN-Lu/BCAM的存在在人泌尿道上皮中是致癌的并且其在膀胱癌中高表达可能具有作为新的治疗靶标的潜力[16];Pradhan等研究侵入性膀胱癌和非侵入性膀胱癌时发现侵袭性和恶性尿路上皮细胞周围完全没有LN染色,与正常基底膜染色有明显区别,LN的免疫组化染色可用于区分膀胱癌的侵袭程度[17];综上所述,LN在膀胱癌的发生发展方面有着至关重要的作用,值得去深入了解。
本组实验中,通过观察MNU诱导雌性大鼠膀胱癌基底膜变化过程以及基底膜中LN的表达情况,我们发现膀胱癌的发生发展过程与基底膜的破坏密切相关;随着MNU膀胱灌注次数增加膀胱粘膜可从化学性炎症阶段,到异型增生,再到癌变;在这个过程中基底膜出现连续性断裂,到缺损、丢失,最终到无基底膜形态;而且通过对基底膜中LN表达情况的检测,我们发现LN的缺失是导致膀胱癌的原因之一。
——纪念Békésy获诺贝尔奖60周年*

