白腐真菌预处理对煤厌氧发酵产甲烷的影响
张怀文,黄 松,闫夏彤,赵树峰,张洺潞,夏大平
白腐真菌预处理对煤厌氧发酵产甲烷的影响
张怀文,黄 松,闫夏彤,赵树峰,张洺潞,夏大平
(河南理工大学 能源科学与工程学院,河南 焦作 454000)
为研究白腐真菌预处理对煤厌氧发酵产甲烷的影响,以预处理长焰煤为实验组,未经预处理煤样为对照组,在适宜环境下进行厌氧发酵产气实验。利用重铬酸钾法、紫外分光光度法、扫描电镜等手段对产气过程中的COD(化学需氧量)质量浓度、辅酶F420活性及煤形貌变化等进行阶段性分析。结果表明:实验组与对照组总产气量和碳转化率分别是2 322.0 mL与5.10%、1 330.2 mL与4.70%,且实验组初始产气时间明显提前;实验组降解更为彻底,两者COD值分别是32~176 mg/L与576~609 mg/L;实验组与对照组辅酶F420活性最高值分别为0.011 72 μmol/L和0.007 97 μmol/L,且其活性受TOC(总有机碳)含量和产酸细菌的影响;预处理和产气结束后,实验组煤样表面更加粗糙,微生物吸附位点和吸附量也更多,且有菌簇的形成。实验证实,白腐真菌生物预处理在提高煤厌氧发酵产气量与碳转化率方面具有很强的优越性和可适用性,有利于煤层生物气资源的产业化利用。
长焰煤;生物预处理;白腐真菌;厌氧发酵;甲烷;河南义马千秋矿
煤层气是一种潜力巨大且尚未被完全开发的清洁能源,在世界能源结构中占有重要地位[1]。煤层气的勘探开发不仅能够减缓温室效应,降低矿井通风成本,同时也能获得高效清洁的甲烷能源,而微生物增产煤层气(MECBM)技术是增加煤层气资源量的重要途径之一[2]。
一般来讲,煤微生物厌氧降解产甲烷过程(MECBM技术核心)包括水解阶段(发酵细菌、水解细菌)、产酸阶段(产酸菌、同型产乙酸菌)、产甲烷阶段(产甲烷菌)等多阶段多菌群的协同完成[3-4],且水解阶段是整个过程的限速阶段[5]。前期预处理是解决水解阶段限速问题的重要方法之一,主要包括物理、化学及生物预处理等。研究表明,白腐真菌生物预处理是一种优异的预处理方式,能够通过木质素过氧化物酶、锰过氧化物酶、漆酶等关键酶催化自由基链式反应,实现对木质素的矿化并将多聚糖降解为可利用的单糖[6-8]。白腐真菌具有降解复杂底物(参与生化反应的物质,发酵反应的原料就是底物,也相当于生化反应的反应物)的能力,且降解范围广、反应条件温和、适应性强,是对煤炭进行生物降解和加工的一种新型研究方向[9-10]。白腐真菌对煤的降解包括氧化和氢化两个过程,不仅可以将部分煤样降解为气态小分子物质,而且有利于煤质的精选和燃烧特性的优化[11]。徐一雯等[12]研究了超声、微波及热碱预处理技术对厨余垃圾厌氧发酵产甲烷的影响;夏大平等[13]研究了酸、碱预处理后煤发酵联产氢气–甲烷生成特征与煤结构变化;张亦雯等[14]研究了3种不同H2O2浓度预处理中、高阶煤的生物甲烷生成潜力,发现0.05%H2O2直接注入煤层或将预处理液注入煤层均可实现生物甲烷的增产。
目前声波、酸碱、氧化剂等物理、化学等多种预处理方式对煤发酵产气的影响已多有报道[15-17],但鲜有报道生物预处理煤样的产气特征。鉴于此,分别对白腐真菌预处理和未进行预处理的长焰煤进行生物发酵产甲烷实验,研究分析产甲烷过程中不同阶段产气量、化学需氧量(COD)、辅酶F420活性及煤表面结构变化等规律,为进一步证实白腐真菌生物预处理的优越性和煤层生物气资源的商业化利用提供支撑和借鉴。
1 实验材料与方法
1.1 实验材料
煤样选自河南义马千秋矿,煤的镜质体最大反射率为0.56%,为长焰煤。煤层埋深500 m,储层温度25°C。在采煤工作面人工采集块状煤样(>8 cm× 8 cm × 8 cm)后放在氦气填充密封的低温厌氧罐内,并及时运往实验室密封保存。煤样的工业分析和元素分析结果见表1。
产气菌源来自焦作古汉山矿井水。在采煤工作面涌水口处人工采集新鲜水样,通入氦气后运往实验室冷藏保存。白腐真菌由河南理工大学煤层气生物工程实验室提供。
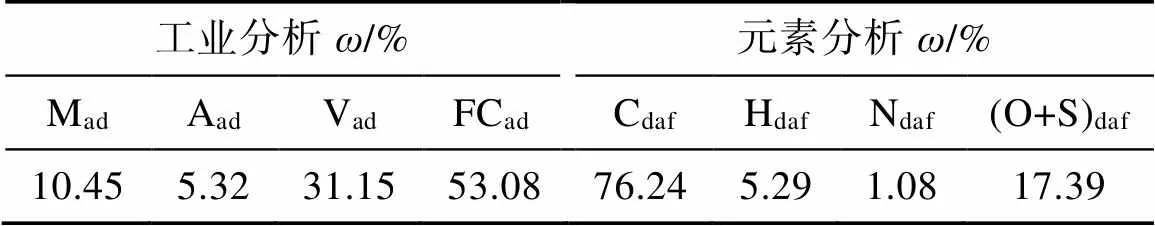
表1 义马千秋矿长焰煤的工业分析和元素分析
1.2 实验方案
以白腐真菌预处理煤样为实验组,未经预处理煤样为对照组,其他条件均保持一致。实验前将煤样破碎筛分至100~150目(0.1~1.5 mm),并储存在干燥样品袋内。产气实验在3 000 mL发酵瓶中进行,产生的气体通过排饱和食盐水法集于集气瓶中(图1)。主要实验流程如下。
a. 配置微量元素液 1.5 g氨基三乙酸,0.5 g MnSO4·2H2O,3.0 g MgSO4·7H2O,0.1 g FeSO4·7H2O,1.0 g NaCl,0.1 g CoCl2·6H2O,0.1 g CaCl2·2H2O,0.01 g CuSO4·5H2O,0.1 g ZnSO4·7H2O,0.01 g H3BO3,0.01 g KAl(SO4)2,0.02 g NiCl2·6H2O,0.01 g Na2MoO4与1 000 mL超纯水。
b. 配置产甲烷富集培养基 1.0 g NH4Cl,0.1 g MgCl2·6H2O,0.4 g K2HPO4·3H2O,0.2 g KH2PO4,1.0 g酵母膏,0.001 g刃天青,0.5 g L–半胱氨酸盐,0.2 g Na2S,2.0 g NaHCO3,2.0 g乙酸钠,2.0 g甲酸钠,0.1 g胰蛋白胨,10 mL微量元素液与1 000 mL矿井水。
c. 配置白腐真菌富集培养基 200 g马铃薯,20 g葡萄糖,5 g蛋白胨与1 000 mL超纯水,并将白腐真菌菌种接种到PDA固体培养基上。
将配置好的白腐真菌和产甲烷培养基在(35± 0.5)°C恒温培养箱内富集培养4~5 d。富集培养完成后向富含白腐真菌的发酵瓶内加入100 g新鲜煤样,好氧预处理6~7 d。预处理结束后,保留煤颗粒沉淀物并用KOH溶液中和预处理发酵液,同时向预处理发酵瓶内加入同质量、同粒度的煤样及1 000 mL产甲烷富集液,轻轻摇晃至混合均匀,在预处理装置基础上形成产甲烷装置。
实验装置如图1所示。
在液体取样口4每隔3 d抽取一次菌液,置于50 mL离心管内,并向离心管内充入氦气以保证其厌氧条件,用封口膜密封后放置在4°C冰箱内冷藏保存。
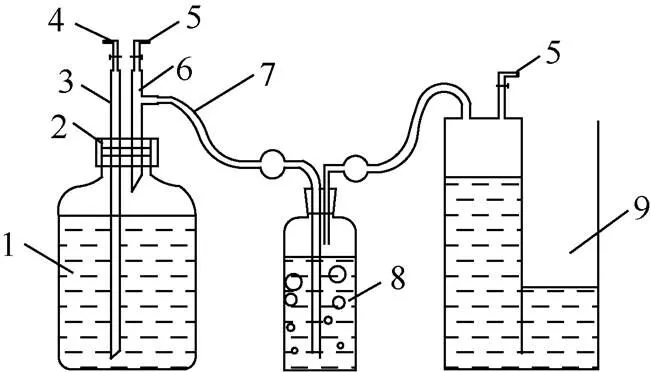
1—发酵瓶;2—橡胶塞;3、6—穿刺钢针;4—液体取样口;5—气体取样口;7—橡胶软管;8—洗气瓶;9—集气装置
1.3 分析方法
1.3.1 产气量
利用排水集气法测量产气量大小,即用量筒对排水集气装置中的排水体积进行测量,水体积即为产气量大小。
1.3.2 化学需氧量(COD)
采用6B-200型COD速测仪测试产甲烷过程中发酵液的COD质量浓度。测试前对发酵液进行稀释(发酵液∶蒸馏水=1∶20)。取7支带有标号的洁净消解管,分别对应不同取液阶段的测试样品(0.15 mL),并依次向消解管内加入1 mL C1试剂(一种氧化剂),5 mL C2试剂(浓硫酸)。将消解管依次放入6B-12型智能消解仪内消解10 min,消解完成后先在空气中自然冷却2 min,再向各消解管内分别加入3 mL蒸馏水,并再次在自来水中冷却2 min。水冷结束后将消解管内各试液倒入特定比色皿中测试样品的COD值。
1.3.3 辅酶F420活性
取不同阶段发酵液各10 mL加入50 mL离心管中,并加入10 mL生理盐水搅拌稀释,在6 000 r/min条件下离心15 min。收集沉淀物,并再次加入15 mL生理盐水,同时在95°C恒温水浴锅内水浴加热30 min。冷却至室温后,向离心管内加入25 mL乙醇溶液,并再次在6 000 r/min条件下离心15 min。离心后取上部清液,并用4 mol/L氢氧化钠溶液调节上部清液pH值至13.5,之后再在8 000 r/min条件下离心15 min,并将离心后的上部清液等体积分成2份。其中一份用6 mol/L的盐酸溶液调节pH值略低于3.0,并记录盐酸使用量,另一份加入与盐酸相同体积的蒸馏水作为参照对比样。使用紫外可见分光光度计测试上述2份试液在波长420 nm处的吸光度值,并按照式(1)计算辅酶F420的活性。
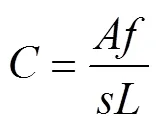
式中:为辅酶F420浓度,μmol/L;为pH<3的样品溶液做参照,pH=13.5的试液在420 nm的吸光度值;为稀释倍数(25倍);为比色皿厚度(1.3 cm);为F420在pH=13.5时的毫摩尔消光系数(54.3)。
1.3.4 其他指标
实验组与对照组发酵液离心后取上部清液,并用蒸馏水稀释10倍。使用UV-5200紫外可见分光光度计测试上部清液(稀释后)在254 nm处吸光度值UV254,用来代替TOC(总有机碳)含量。采用FEI Quanta FEG 250场发射扫描电子显微镜(SEM)观察产气前后煤表面变化特征。
2 结果与讨论
2.1 产气量
实验组与对照组产气量结果如图2所示。由图2可以发现,两者产气量均大致呈现先上升后下降的变化趋势,且总产气量分别是2 322.0 mL与1 330.2 mL。①实验组在反应第1 天开始产气(122.0 mL),最大值出现在第3天(294.0 mL),占总产气量的12.66%。4 d之后产气量开始逐渐下降,最终维持在67.67 mL。②对照组初始产气时间晚于实验组(第5天),且出现两个明显的产气峰值。这是因为白腐真菌能够有效降解煤中的木质素[18-19],继而缩短了产甲烷过程的水解持续时间。11~16 d,产气量由44 mL增加到294 mL。16 d之后产气量开始下降,最终定格在32 mL,远小于实验组。
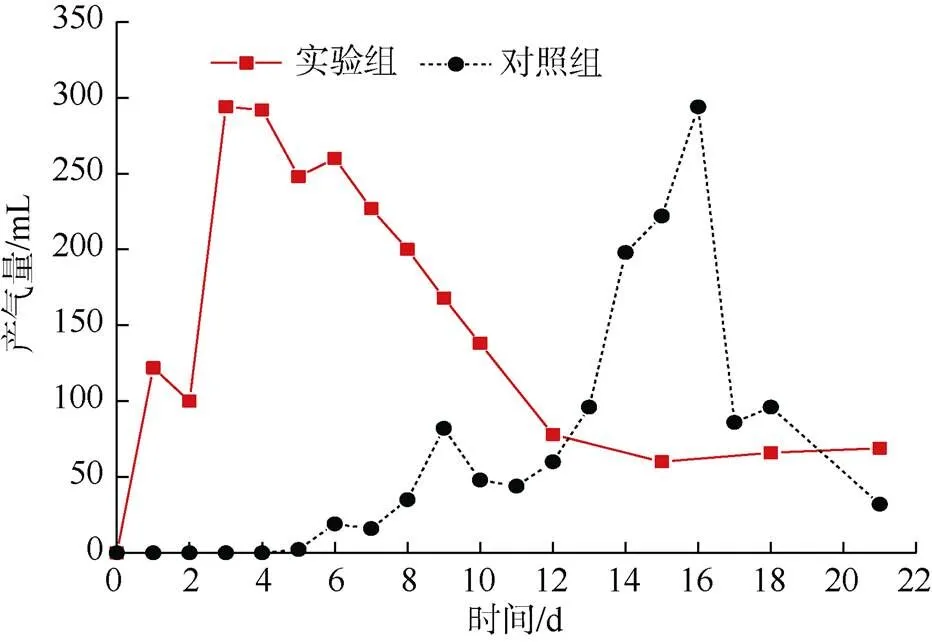
图2 实验组和对照组产气量变化特征
2.2 化学需氧量COD与碳转化率
煤是一种微溶于水的大分子有机混合物,外源菌的添加降解可使煤中脂肪烃、小分子芳香烃等可溶性有机质增加。发酵液中有机质含量越多,化学需氧量COD值越大。实验组与对照组发酵液内COD值如图3所示。实验组与对照组COD分别为32.34~176.00 mg/L与576~609 mg/L,碳转化率分别是5.10%与4.70%(表2)。这说明实验组的降解转化过程更为彻底,更多的有机质被转化生成CH4、CO2等目标产物,而不是残留在发酵液内。
产气前由于未对白腐真菌做进一步分离处理,使得实验组前3 d发酵液内有机质降解量大于生成量,COD值由65.02 mg/L降至32.34 mg/L (图3)。随后实验组水解和产酸阶段(3~9 d)生成的氨基酸类、酯类、酸醇类等小分子有机质使得COD值由32.34 mg/L增加到137.13 mg/L。12~21 d,产甲烷菌利用乙酸、甲基类等有机质生成CH4与CO2,同时酸毒性有机质开始逐步积累,使得COD值(71.412—176.00—66.32—97.47 mg/L)呈先增加后降低再增加的浮动特征。对照组COD值变化与实验组基本相似,但拐点出现时间略有差异,这与两者反应体系内微生物多样性和菌群间竞争强度密切相关。
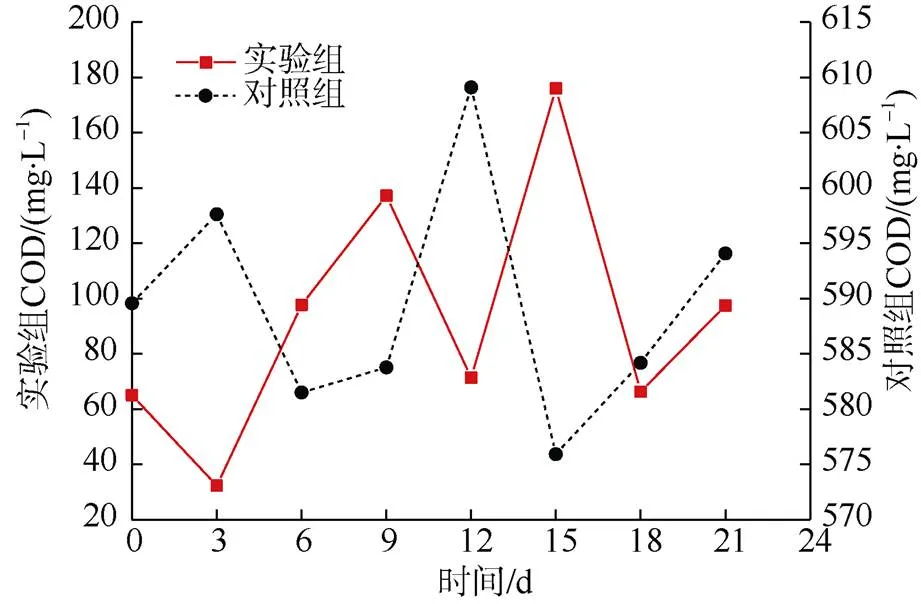
图3 实验组与对照组化学需氧量COD

表2 产气前后碳含量变化
2.3 辅酶F420活性
研究证实,单位比色皿在254 nm波长光程下紫外线吸收度UV254与TOC相关度高,可以作为总有机碳含量TOC的一种很好的替代参数[20]。煤厌氧发酵产甲烷是一系列生物化学的偶联反应,产甲烷菌位于整条厌氧生物链最顶端,而辅酶F420作为一种产甲烷菌所特有的酶类,与产甲烷菌的活性有着不可分割的联系,是产甲烷菌活性状态的反应指标之一[21-22]。因此,采用紫外分光光度法测试,反映试液内底物变化情况及产甲烷活性状态的UV254大小和辅酶F420活性,测试结果如图4所示。
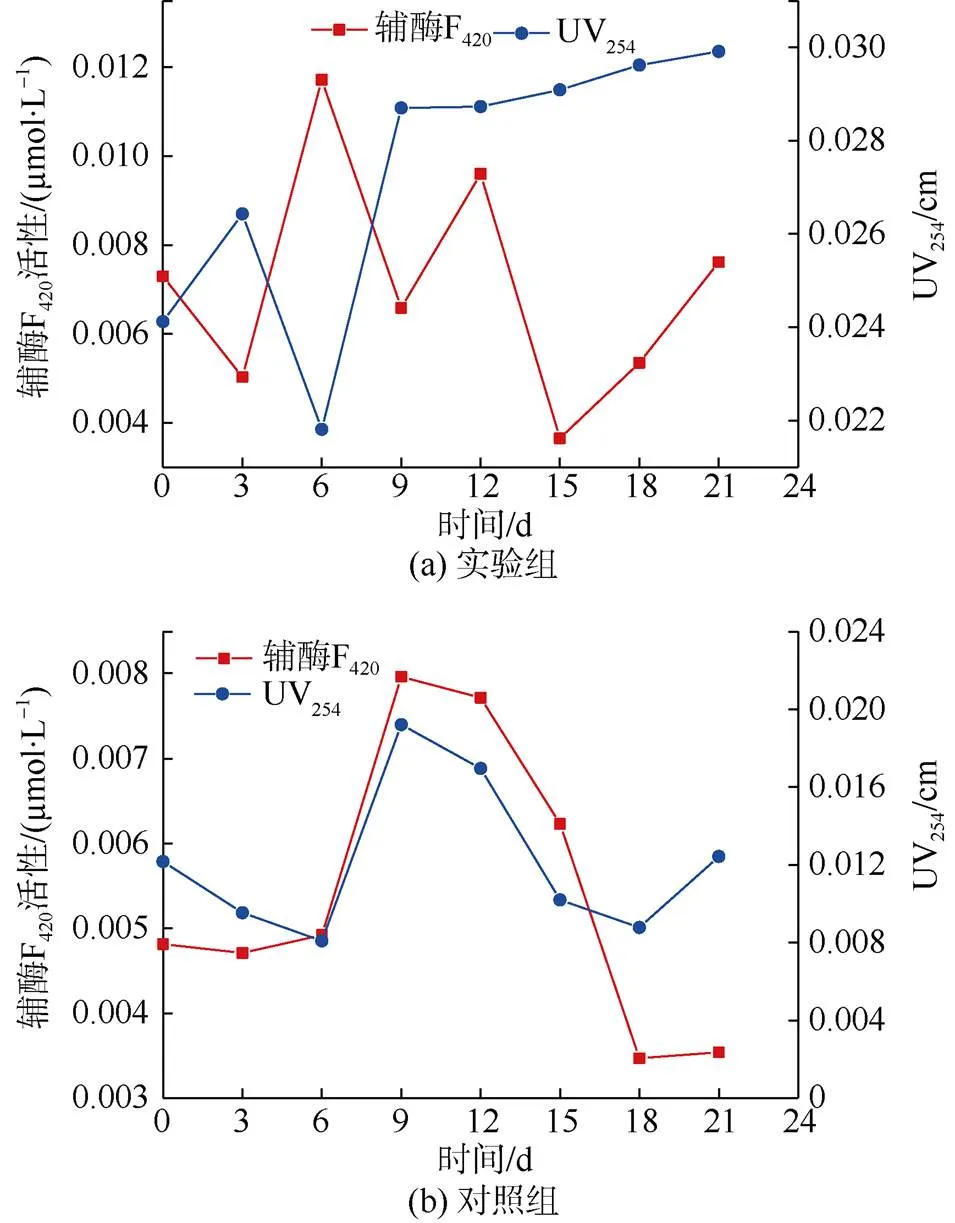
图4 辅酶F420与UV254变化
一般来说,产酸细菌生长速率较快,世代时间(微生物每繁殖一代所需要的时间)为10~30 min,而产甲烷菌生长非常缓慢,其世代时间一般在4~6 d[23]。实验组煤样经预处理后,其孔隙连通性增强,孔径增大,为微生物提供了更多的吸附位和降解点[24-25]。从开始接种到培养第3天,产甲烷菌的世代时间还未完成,数量较少,但产酸细菌的世代时间早已完成,数量较多,并对煤进行了部分降解,使发酵液内生成了乙酸、丙酸、丁酸等酸性有机物。但丙酸、丁酸等酸性有机物无法被产甲烷菌直接利用,导致发酵液内总有机碳的生成速率高于降解速率。因此,实验组UV254值升至0.026 43 cm,辅酶F420活性降至0.005 03 μmol/L(图4a)。随着产甲烷菌世代时间的完成,辅酶F420活性增长迅速,在第6天时达到最大活性值0.011 72 μmol/L,同时有机碳开始被大量消耗,在第6天时含量出现最低值,UV254为0.021 81 cm。之后产甲烷菌的活性由于酸性有机物的过度积累而受到抑制,由最大值降至最小值(0.003 65 μmol/L),有机碳含量开始逐步增加,UV254最终维持在0.03 cm附近。
在反应前6 d,对照组发酵液内用于满足菌体繁殖代谢及细胞活动所需能量的有机碳源酵母膏优先被消耗,致使发酵液内有机碳不断减少,UV254降低至0.008 09 cm(图4b),而产酸细菌与产甲烷菌在生长速率的差异性,使发酵细菌、产氢产乙酸菌产生的酸抑制了辅酶F420活性[26-27],导致其在第3~6天增长较为缓慢。之后水解和产酸阶段生成的酸性物质与煤中碳源被其有效利用,辅酶F420活性增长迅速,在第9天时达到最大活性值0.007 97 μmol/L,而细菌代谢所生成的大量含碳有机物也直接导致了接种液内有机碳的快速增加。9~18 d,有效碳源的减少影响并降低了辅酶F420的活性,使其降低至最小值0.003 47 μmol/L。18 d之后,对照组与实验组中,辅酶F420活性的增加可能与产甲烷菌群的迁移和本身生理状态的调整、煤孔隙结构的变化相关,仍需进一步研究证实。
2.4 SEM分析
实验组与对照组产气前后扫描电镜图片如图5所示。

图5 实验组与对照组产气前后煤显微结构变化特征
由图5可以发现,实验组在产气前(预处理结束后)煤表面更加粗糙,且表面微生物吸附量也更多,这为其后续产甲烷过程中水解期的缩短与总产气量的增加提供了必要的物质基础。产气结束后煤表面更加粗糙,且有菌簇的形成。与实验组相比,产气前对照组煤表面相对光滑,且微生物吸附量也较少。产气结束后,对照组煤表面同样变得较为粗糙,但粗糙度小于实验组。图5表明煤样在产气前后均发生了不同程度的降解,并伴有菌群的迁移和吸附,且白腐真菌预处理能够明显改善和提高煤中有机质的有效降解。这与实验组具有高产气量、高碳转化率、高辅酶活性的“三高”特征具有很好的吻合性。
3 结论
a.煤样经白腐真菌预处理后初始产气时间明显提前,较对照组提前4 d,总产气量和碳转化率也明显增加。
b. 实验组降解更为彻底,实验组和对照组化学需氧量COD分别是32~176 mg/L与576~609 mg/L。
c.辅酶F420活性受TOC含量和产酸细菌的影响,且实验组辅酶活性更高,降解过程也更为彻底。
d.白腐真菌预处理为微生物在煤表面提高了更多的吸附位点,煤表面更加粗糙,且产气结束后有菌簇的形成。
请听作者语音介绍创新技术成果等信息,欢迎与作者进行交流

[1] 占迪,何环,廖远松,等. 褐煤强化产甲烷菌群的群落分析及条件优化[J]. 微生物学报,2018,58(4):684–698. ZHAN Di,HE Huan,LIAO Yuansong,et al. Community structure analysis of methanogenic flora and optimization for bioaugmentation methane generation from lignite[J]. Acta Microbiologica Sinica,2018,58(4):684–698.
[2] 郭红光,王飞,李治刚. 微生物增产煤层气技术研究进展[J]. 微生物学通报,2015,42(3):584–590. GUO Hongguang,WANG Fei,LI Zhigang. Research progress of microbially enhanced coalbed methane[J]. Microbiology China,2015,42(3):584–590.
[3] VINSON D S,BLAIR N E,MARTINI A M,et al. Microbial methane from in situ biodegradation of coal and shale:A review and reevaluation of hydrogen and carbon isotope signatures[J]. Chemical Geology,2017,453:128–145.
[4] FLORES R M,RICE C A,STRICKER G D,et al. Methanogenic pathways of coal-bed gas in the Powder River basin,United States:The geologic factor[J]. International Journal of Coal Geology,2008,76(1/2):52–75.
[5] 贾舒婷,张栋,赵建夫,等. 不同预处理方法促进初沉/剩余污泥厌氧发酵产沼气研究进展[J]. 化工进展,2013,32(1):193–198. JIA Shuting,ZHANG Dong,ZHAO Jianfu,et al. Research on different pre-treatment methods for improving anaerobic digestion of primary/excess sludge of biogas production[J]. Chemical Industry and Engineering Progress,2013,32(1):193–198.
[6] 汪少洁. 白腐菌降解转化低阶煤的试验及机理研究[D]. 武汉:华中科技大学,2008. WANG Shaojie. Experimental and mechanism study on white rot fungi degradation of low-rank coal[D]. Wuhan:Huazhong University of Science & Technology,2008.
[7] PINTO P A,DIAS A A,FRAGA I,et al. Influence of ligninolytic enzymes on straw saccharification during fungal pretreatment[J]. Bioresource Technology,2012,111:261–267.
[8] KELLER F A,HAMILTON J E,NGUYEN Q A. Microbial pretreatment of biomass[J]. Applied Biochemistry and Biotechnology,2003,105(1/2/3):27–41.
[9] 柳珊,吴树彪,张万钦,等. 白腐真菌预处理对玉米秸秆厌氧发酵产甲烷影响实验[J]. 农业机械学报,2013,44(增刊2):124–129. LIU Shan,WU Shubiao,ZHANG Wanqin,et al. Effect of white-rot fungi pretreatment on methane production from anaerobic digestion of corn stover[J]. Transactions of the Chinese Society of Agricultural Machinery,2013,44(S2):124–129.
[10] 李俊旺. 白腐真菌降解褐煤的研究[D]. 淮南:安徽理工大学,2009. LI Junwang. Studies on lignite degradation by white rot fungi[D]. Huainan:Anhui University of Science & Technology,2009.
[11] 王龙贵,张明旭,欧泽深,等. 白腐真菌对煤炭的降解转化试验[J]. 煤炭学报,2006,31(2):241–244. WANG Longgui,ZHANG Mingxu,OU Zeshen,et al. Experimental of coal biodegradation by white rot fungus[J]. Journal of China Coal Society,2006,31(2):241–244.
[12] 徐一雯,蒋建国,刘诺,等. 预处理对厨余垃圾等有机废弃物联合厌氧发酵的影响[J]. 清华大学学报(自然科学版),2019,59(7):558–566. XU Yiwen,JIANG Jianguo,LIU Nuo,et al. Effects of pretreatment on anaerobic co-digestion of kitchen waste and other organic wastes[J]. Journal of Tsinghua University(Science and Technology),2019,59(7):558–566.
[13] 夏大平,陈曦,王闯,等. 褐煤酸碱预处理–微生物气化联产H2–CH4的实验研究[J]. 煤炭学报,2017,42(12):3221– 3228. XIA Daping,CHEN Xi,WANG Chuang,et al. Experimental study on the production of H2-CH4from lignite jointly with acid-alkali pretreatment-microbial gasification[J]. Journal of China Coal Society,2017,42(12):3221–3228.
[14] 张亦雯,郭红光,李亚平,等. 过氧化氢预处理中/高煤阶煤增产生物甲烷研究[J]. 煤炭科学技术,2019,47(9):262– 267. ZHANG Yiwen,GUO Hongguang,LI Yaping,et al. Study on medium/high rank coal-producing methane with hydrogen peroxide pretreatment[J]. Coal Science and Technology,2019,47(9):262–267.
[15] 陈曦. 预处理褐煤的微生物降解联产H2-CH4实验研究[D]. 焦作:河南理工大学,2018. CHEN Xi. The coproduction of H2-CH4by microbial degradation of pretreated lignite[D]. Jiaozuo:Henan Polytechnic University,2018.
[16] HUANG Z X,LIERS C,ULLRICH R,et al. Depolymerization and solubilization of chemically pretreated Powder River basin subbituminous coal by manganese peroxidase(MnP) from Bjerkandera adusta[J]. Fuel,2013,112:295–301.
[17] JONES E J P,HARRIS S H,BARNHART E P,et al. The effect of coalbed dewatering and partial oxidation on biogenic methane potential[J]. International Journal of Coal Geology,2013,115:54–63.
[18] COLLINS P J,FIELD J A,TEUNISSEN P,et al. Stabilization of lignin peroxidases in white rot fungi by tryptophan[J]. Applied and Environmental Microbiology,1997,63(7):2543–2548.
[19] FERRAZ A,RODRIGUEZ J,FREER J,et al. Biodegradation of Pinus radiata softwood by white-and brown-rot fungi[J]. World Journal of Microbiology and Biotechnology,2001,17(1):31–34.
[20] 蒋绍阶,刘宗源. UV254作为水处理中有机物控制指标的意义[J]. 重庆建筑大学学报,2002,24(2):61–65. JIANG Shaojie,LIU Zongyuan. The meaning of UV254as an organic matter monitoring parameter in water supply & wastewater treatment[J]. Journal of Chongqing Jianzhu University,2002,24(2):61–65.
[21] CHENG Yunhuan,SANG Shuxun,HUANG Huazhou,et al. Variation of coenzyme F420activity and methane yield in landfill simulation of organic waste[J]. Journal of China University of Mining & Technology,2007,17(3):403–408.
[22] YADVIK A,SREEKRISHNAN T R,KOHLI S,et al. Enhancement of biogas production from solid substrates using different techniques:A review[J]. Bioresource Technology,2004,95(1):1–10.
[23] 任南琪,王爱杰. 厌氧生物技术原理与应用[M]. 北京:化学工业出版社,2004:73–74. REN Nanqi,WANG Aijie. Technical principle and application of anaerobic biotechnology[M]. Beijing:Chemical Industry Press,2004:73–74.
[24] 董志伟,郭红玉,夏大平,等. 基于显微CT的煤生物降解过程中孔隙演化精细表征[J]. 煤田地质与勘探,2019,47(5):63–69.DONG Zhiwei,GUO Hongyu,XIA Daping,et al. Micro CT-based meticulous characterization of porosity evolution of coal in the process of biodegradation[J]. Coal Geology & Exploration,2019,47(5):63–69.
[25] 夏大平,苏现波,吴昱,等. 不同预处理方式和模拟产气实验对煤结构的影响[J]. 煤炭学报,2013,38(1):129–133. XIA Daping,SU Xianbo,WU Yu,et al. Effect of experiment of different pretreatment methods and simulating biogenic methane production on coal structure[J]. Journal of China Coal Society,2013,38(1):129–133.
[26] 王爱宽,秦勇. 褐煤本源菌在煤层生物气生成中的微生物学特征[J]. 中国矿业大学学报,2011,40(6):888–893. WANG Aikuan,QIN Yong. Performance of indigenous bacteria during the biogenic gas generation from brown coal[J]. Journal of China University of Mining & Technology,2011,40(6):888–893.
[27] 孙斌,李金珊,承磊,等. 低阶煤生物采气可行性:以二连盆地吉尔嘎朗图凹陷为例[J]. 石油学报,2018,39(11):1272–1278. SUN Bin,LI Jinshan,CHENG Lei. The feasibility of biological gas recovery in low-rank coal:A case study of Jiergalangtu depression in Erlian basin[J]. Acta Petrolei Sinica,2018,39(11):1272–1278.
Effect of white rot fungi pretreatment on methane production from anaerobic fermentation of coal
ZHANG Huaiwen, HUANG Song, YAN Xiatong, ZHAO Shufeng, ZHANG Minglu, XIA Daping
(School of Energy Science and Engineering, Henan Polytechnic University, Jiaozuo 454000, China)
To investigate the effect of white rot fungi pretreatment on methane production from anaerobic fermentation of coal, fermentation experiments of biogas production were conducted using long flame coal. The coal samples pretreated with white rot fungi were the experimental group(EG), and original untreated coal samples were the control group(CG). The COD(chemical oxygen demand) mass concentration, activity of coenzyme F420, and changes of coal morphology were measured using potassium dichromate method, ultraviolet spectrophotometry, and SEM, respectively. The results showed the following: The total gas production and conversion rate in the EG and CG were 2 322.00 mL and 5.10%, 1 330.20 mL and 4.70%, respectively. Moreover, the hydrolysis stage in the EG was significantly shorter than that in the CG. The COD value in the EG and CG was 32-176 mg/L and 576- 609 mg/aL, respectively, and the degradation of EG was more thorough. The maximum value of coenzyme F420in the EG and CG was 0.011 72 μmol/L and 0.007 97 μmol/L, respectively, and its activity was effected by TOC(total organic carbon) content and acid-producing bacteria. At the end of pretreatment and gas produciton, the roughness of the coal surface in the EG was stronger, the adsorption sites and adsorption capacity of microorganisms were also more high, and accompanied by the generation of bacterioflora. This test research demonstrates the advantages and adaptability of biological pretreatment with white rot fungi, which is beneficial to the industrialization utilization of biogas resources in coal.
long flame coal; biological pretreatment; white rot fungi; anaerobic fermentation; methane; Qianqiu coal mine of Yima in Henan

P618.11
A
10.3969/j.issn.1001-1986.2020.02.019
1001-1986(2020)02-0120-06
2019-10-11;
2019-12-11
河南省科技攻关项目(182102310845)
Science and Technology Key Project of Henan Province(182102310845)
张怀文,1992年生,男,山西晋中人,硕士研究生,研究方向为煤层生物气能源开发. E-mail:1136636126@qq.com
夏大平,1983年生,女,安徽颍上人,博士,副教授,从事煤层气地质与勘探开发研究工作. E-mail:xiadp22@hpu.edu.cn
张怀文,黄松,闫夏彤,等. 白腐真菌预处理对煤厌氧发酵产甲烷的影响[J]. 煤田地质与勘探,2020,48(2):120–125.
ZHANG Huaiwen,HUANG Song,YAN Xiatong,et al. Effect of white rot fungi pretreatment on methane production from anaerobic fermentation of coal[J]. Coal Geology & Exploration,2020,48(2):120–125.
(责任编辑 范章群)

