不同根系分泌物对土壤N2O排放及同位素特征值的影响
庄姗,林伟,丁军军,郑欠,寇馨月,李巧珍,李玉中,2
不同根系分泌物对土壤N2O排放及同位素特征值的影响
庄姗1,林伟1,丁军军1,郑欠1,寇馨月1,李巧珍1,李玉中1,2
(1中国农业科学院农业环境与可持续发展研究所/农业农村部旱地节水农业重点实验室,北京 100081;2中国农业科学院环境稳定同位素实验室,北京 100081)
【】探究植物根系分泌的主要组分(有机酸、氨基酸、糖类)对土壤N2O排放及其微生物过程的影响,为选择适宜的植物进而控制土壤N2O排放提供支撑。通过室内试验分别添加草酸、丝氨酸、葡萄糖于土壤中模拟根系的3种主要分泌物,每种分泌物设置两个浓度水平:低浓度(150 μg C·d-1)和高浓度(300 μg C·d-1),另设置添加蒸馏水的对照组,共7个处理。将土壤置于120 mL玻璃瓶中进行培养,24 h内采集气体样品7次,每次培养2 h,获取N2O排放速率、日累积排放量和同位素特征值(15Nbulk18O和SP(site preference,SP=15Nα-15Nβ))。添加3种根系分泌物组分后,土壤N2O排放速率均逐渐升高,且均高于对照。高浓度处理组N2O累积排放量为:葡萄糖((3.2±1.3)mg·kg-1·d-1)处理>丝氨酸((2.6±0.5)mg·kg-1·d-1)处理>草酸((1.4±0.2)mg·kg-1·d-1)处理,低浓度处理组为:草酸((2.7±1.3)mg·kg-1·d-1)处理>丝氨酸((1.8±0.4)mg·kg-1·d-1)处理>葡萄糖((1.6±0.8)mg·kg-1·d-1)处理;添加根系分泌物的不同处理间土壤N2O的18O值无明显差异,并稳定在24.1‰—25.6‰,且均显著高于对照((20.1±1.5)‰);土壤N2O的15Nbulk值与添加根系分泌物的种类有关,其中草酸处理组为(-20.06±2.22)‰、丝氨酸处理组为(-22.33±1.10)‰、葡萄糖处理组为(-13.86±1.11)‰、对照组为(-23.14±3.72)‰。各处理土壤N2O的SP值的变化范围为13.13‰—15.03‰,根系分泌物浓度越高,SP值越低。综合分析不同处理4个指标(N2O排放速率、N2O的15Nbulk18O和SP值)的不同时刻的检测值与日均值的校正系数,添加根系分泌物后第16小时各处理4个指标的校正系数最接近于1。在NH+ 4-300 mg N·kg-1的土壤环境下根系分泌物促进N2O的排放,且在培养期间(24 h)土壤N2O排放速率逐渐升高。高浓度处理组葡萄糖对土壤N2O排放速率促进效果最强,低浓度处理组草酸对土壤N2O排放速率促进效果最强。与对照组相比,根系分泌物的添加使N2O的18O值显著升高;与对照组相比,葡萄糖的添加使15Nbulk值显著升高。根系分泌物浓度越高,反硝化作用对N2O的贡献越大。
根系分泌物;硝化作用;反硝化作用;N2O;同位素特征值
0 引言
【研究意义】N2O是一种重要的温室气体,能够破坏平流层中的臭氧层且参与大气中光化学反应,从而进一步加剧温室效应[1]。土壤是N2O的主要排放源[1-2],约占全球N2O排放总量的65%[3]。自20世纪初合成氨技术发明以来,氮肥被大量的投入到农业生产中,在增加作物产量的同时也使得N2O排放量增加了19%[4-6]。而菜地具有高水、高肥、肥料利用率低等特点[7],造成了N2O的大量排放。因此研究菜地N2O排放对减缓全球变暖具有重要的理论和现实意义。【前人研究进展】硝化作用和反硝化作用是N2O产生的主要过程[8]。传统的研究方法主要有乙炔抑制法和同位素标记法等,这些方法在实际操作过程中都有一些局限性,如抑制剂(乙炔)和标记物在系统中扩散不均,易受系统干扰等[9-10]。而自然丰度条件下的N2O同位素位嗜值(SP值)不受N2O前体同位素的影响,进而克服土壤与N作用的环境阻碍而直接评价N2O产生的微生物过程,是估测N2O来源及贡献的一种有效方法[11]。尽管N2O的15Nbulk和18O值易受底物同位素影响,但也能够在一定程度上反应微生物过程,其与SP值相结合进行分析有助于更加全面了解N2O的排放行为。N2O排放的影响因素很多,其中对土壤孔隙含水量(WFPS)[12-13]、pH[14]、O2浓度[15]、温度[16-18]等研究较多。然而,植物通过根系分泌物对N2O的产生也具有重要的影响。植物净光合固定的碳5%—25%通过根系分泌物流失到土壤中[19-21],并以有机酸,氨基酸,糖类和其他类型分子的形式释放,是土壤重要的碳源,影响土壤硝化和反硝化作用[22-23];根系分泌物还可以作为电子供体还原NO- 3和NO- 2[24],改变N2O产生的电子传递途径;还可通过改变根际周围微生物的群落结构影响N2O的产生[25]。草酸、丝氨酸、葡萄糖分别是根系分泌物中普遍存在并且含量较多的一种低分子有机酸、氨基酸、糖类[26],它们在N2O产生过程中的作用机理存在一定差异。研究发现草酸显著促进土壤中有机态氮和有机无机复合态氮的矿化速度,促进氮的释放[27]。也有研究表明草酸促进N2O还原基因的复制,对N2O的还原产生影响[28]。葡萄糖也能够促进氮的分解,但这种促进作用明显小于草酸,此外,优先利用葡萄糖的微生物可能导致氮分解率下降[28]。丝氨酸不仅是细胞蛋白质的重要组成部分,也是微生物的能量来源,在土壤中可以矿化为NH+ 4,改变土壤的C/N和pH[29]。【本研究切入点】不同植物根系分泌物的组成和含量不同,大量研究表明N2O的排放与根系分泌物的组成和含量有关[24-25,29-30],但鲜有系统研究不同组分单独作用对N2O产生过程的影响。又由于根系分泌物组成和土壤环境的复杂,在自然条件下很难做到定量提取研究[31],所以通过模拟根系分泌物组分和含量制备根系分泌物溶液添加到土壤中是研究根系分泌物作用下土壤N2O排放特征的重要方法。尽管实验室环境能够控制土壤温度、湿度等环境因子以减少环境差异对N2O排放的影响,但添加根系分泌物后微生物对各根系分泌物的相互作用和响应时间是影响N2O排放量的关键,N2O排放的时空变异性对定量分析不同根系分泌物组分对N2O产生作用的影响仍无法排除。因此研究不同根系分泌物组分对土壤N2O排放的影响,同时确定合理的气体取样时间,对于提高试验效率,深入研究根系分泌物对N2O产生在时间和空间上的作用至关重要。【拟解决的关键问题】通过对根系分泌物中3种主要组分(有机酸、丝氨酸、糖类)的主要成分(草酸、丝氨酸、葡萄糖)作用下土壤N2O排放和同位素特征的综合分析,揭示不同根系分泌物对土壤N2O产生过程的影响及其作用机制,为选择适宜的植物进而减缓土壤N2O排放提供支撑。
1 材料与方法
1.1 土壤采集
土壤采集于中国农业科学院农业环境与可持续发展研究所顺义实验基地,东经40°05′2″,北纬116°55′19″。基地为典型的暖温带半湿润大陆性季风气候,年平均日照2 684 h,年平均气温12.5℃,年平均降水量623.5 mm,无霜期195 d左右。土壤类型为潮褐土,土壤密度1.40 g·cm-3,有机质16.48 g·kg-1,全氮1.10 g·kg-1, 全磷0.68 g·kg-1,全钾20.31 g·kg-1,pH 8.7。
土壤采集于2018年8月(雨后2 d),取0—20 cm表层土壤于阴凉处自然风干。除去砂石、植物根系等杂质,过2 mm筛,室内保存备用。
1.2 试验方法
选择3种代表性有机物,即草酸代表有机酸,丝氨酸代表氨基酸,葡萄糖代表糖类,以此为研究对象。依据白菜根系分泌速率[26],设置2个添加水平:150 μg C·d-1(低浓度)和300 μg C·d-1(高浓度),另添加蒸馏水为空白对照,共7个处理,每次添加溶液体积为0.85 mL,每种处理设3次重复。用120 mL密封性良好的血清瓶作培养瓶,称取40 g风干土放入120 mL血清瓶中,共21个。用蒸馏水调节土壤孔隙含水量(WFPS:water-filled-pore-space)至75%左右(称重法),放入25℃恒温培养箱黑暗预培养。根据培养前重量每4天补充一次水分(日蒸发量约为0.85 mL),共补充3次。第12天补充水分的同时施入(NH4)2SO4溶液(300 mgN·kg-1干土,足量氮使微生物对根系分泌物敏感,且使土壤产生的N2O同位素丰度在仪器测结果最准确的范围内)。在第14天用2.5 mL一次性注射器依次吸取草酸、丝氨酸、葡萄糖溶液和蒸馏水,插入土壤缓慢推动注射器使溶液缓慢送出,作为正式培养第1天,之后每隔24 h添加一次。尽管丝氨酸能够提供N素,但是培养期间添加丝氨酸N素的总量不足土壤总氮的3%,对N2O排放量的影响较小。
1.3 主要药品及规格
草酸(H2C2O4·2H2O):分析纯,北京化工厂;D-无水葡萄糖(C6H12O6):>99.9%,MYM Biological Technology;丝氨酸(C3H7NO3):99%,北京百灵威科技有限公司;硫酸铵((NH 4)2SO4):分析纯,天津市福晨化学试剂厂。
1.4 气体样品采集
在正式培养的第3天,添加根系分泌物溶液后的第2、4、8、12、16、20和24小时取样,共采集7次。采样前将培养瓶盖上橡胶塞和铝盖,并用密封器压紧密封,培养2 h。其他时间保持培养瓶敞口。用50 mL针筒抽取30 mL氦气注入培养瓶中,来回抽动针筒重复3次,将气体混匀,再将针筒抽到30 mL刻度处,待针筒不回弹后拔出并迅速插入已抽成真空的20 mL血清瓶,做好标记。取样的同时抽取实验室内空气作为N2O的环境背景值(3次重复)。
1.5 样品测定与方法:
1.5.1 N2O同位素特征值测定与校正 稳定同位素质谱仪(Delta V Plus‐Precon, Thermo Fisher Scientific, Bremen, Germany)用来测定N2O同位素特征值:15Nα15Nbulk18O计算公式如下[32]:
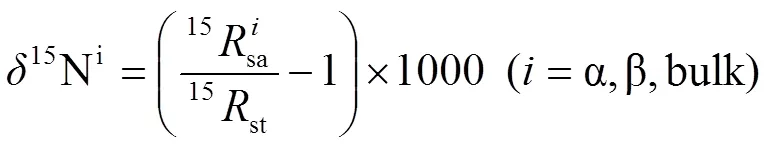
18O(‰)(2)
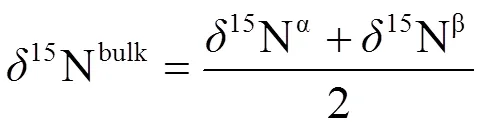
式中,=15N/14N,=18O/16O。sa表示样品,st表示标准物。15N和18O的标准分别是大气中的N2和维也纳标准平均海洋水(Vienna Standard Mean Ocean Water),校准用标准参考气体(美国液化空气特种气体有限责任公司(Air Liquide America, Specialty Gases LLC))。
由于测定的N2O为空气中和土壤产生的N2O的混合气,受空气同位素值的影响,各检测结果(15Nα15Nbulk18O)需按照如下公式校正[33]:
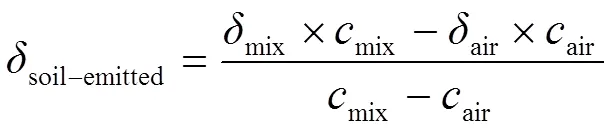
式中,soil-emitted代表土壤排放N2O的同位素值;mix、mix分别表示土壤与空气混合气体的同位素值和N2O浓度;air、air分别表示空气背景的同位素值和N2O浓度(0.63 mg·m-3。mix-air为土壤排放的N2O浓度。
由于土壤N2O排放具有时间变异性,N2O的日平均同位素特征值用通量的加权平均值来表示[34]:
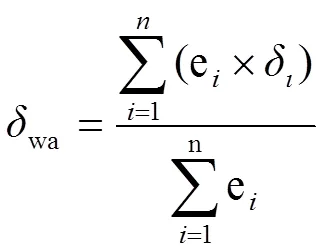
式中,wa表示同位素的日通量加权平均值。e表示第-1取样到次取样时间内土壤排放N2O的量(时刻的排放速率×时间间隔(2 h 或4 h))。δ表示次取样检测的同位素特征值。
1.5.2 N2O来源确定的理论基础 N2O为直线型分子:Nβ-Nα=O。根据两个氮原子与氧原子的相对位置不同,则中间的氮原子命名为α氮原子,末端的氮原子为β氮原子[32]。自然丰度条件下N2O分子中15N原子出现在α位和β位的差异,称为同位素位嗜值(site preference),即SP值,计算公式如下[35-36]:
=15Nα-15Nβ(6)
在不同微生物群落或酶参与下的不同反应过程产生的N2O的值不同,这是值用于土壤N2O溯源研究的重要理论基础。纯细菌培养下硝化作用和反硝化作用的值是已知的,且其值不受底物氮氧同位素的影响。但自然状况下这两种过程往往同时存在[32],为测定气体样品中N2O的同位素值,通常利用同位素二源混合模型计算硝化作用和反硝化作用对N2O的贡献[37]。公式如下:
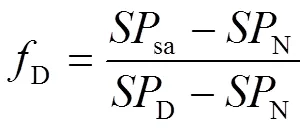
N=1-D(8)
式中,N和D分别表示N2O来自土壤中硝化和反硝化作用的贡献比例N表示纯细菌培养条件下硝化作用的值,为33‰[38-39];D表示纯细菌培养条件下反硝化作用的值,为0‰[40-41];sa表示测得样品的SP值,样品值大于33‰或小于0‰均按33‰或0‰计算。
1.5.3 N2O排放速率的计算 采集的气体用稳定同位素质谱仪(Delta V Plus-Preco,Thermo Fisher Scientific,Bremen,Germany)结合痕量气体浓缩系统测定N2O气体峰面积,根据N2O在样品中峰面积与环境背景中峰面积的比值,计算样品N2O浓度,根据培养前后瓶内N2O的浓度变化计算单位时间内土壤N2O的排放速率(培养前以及环境背景气体N2O的体积分数为320 nmol·mol-1)。公式如下[42]:
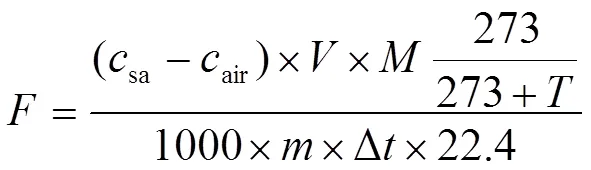
式中,表示N2O排放速率(μg·kg·h-1),22.4为标准大气压下的摩尔体积(L·mol-1)。为标准状态下N2O气体的摩尔质量(44 g·mol-1)。1000为单位换算。表示培养瓶的体积,0.09 L。sa、air分别表示培养后瓶内气体和空气中N2O浓度(nmol·mol-1)。Δ为培养时间,2 h。为培养温度,25℃。
1.5.4 N2O通量和同位素值的校正系数 各采样时刻N2O排放速率和日平均排放速率的校正,各采样时刻测得的同位素值和同位素的日均值之间的校正公式如下[43-44]:
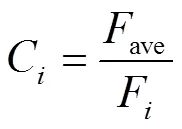
式中,F(=2、4、8、12、16、20、24)表示各时间的平均通量。C为校正系数,ave为N2O日平均排放速率、15Nbulk、18O和SP的日平均值,其中15Nbulk、18O和SP的日平均值为各时刻排放速率的加权平均值(根据公式(5)计算)。F为实测的第次实测通量,或第次取样检测的同位素值。校正系数越接近1,则说明该时刻测量的N2O排放速率和同位素值越接近日平均值,测量结果越具有代表性,即可采用该时刻作为最佳的取样时间[45]。
1.6 数据处理与分析
采用Microsoft Excel·2016对试验数据进行处理和做图。用SPSS·25.0(SPSS Inc., Chicago, IL, USA)进行统计分析。各处理间N2O累计排放量,18O,15Nbulk和SP用单因素方差分析(One-Way ANOVA),LSD法进行多重比较。双因素方差分析(Two-Way ANOVA)比较根系分泌物组分和浓度及其交互作用对N2O排放量和同位素特征值的影响。用一元线性回归分析最佳采样时间的检测值和日均值间的关系。
2 结果
2.1 N2O排放速率的日变化
如图1所示,在取样期间所有处理的N2O排放速率均呈上升趋势,添加根系分泌物处理组均高于对照。在培养时间内添加低浓度、高浓度草酸处理土壤N2O排放速率迅速升高,分别从13.21 μg·kg-1·h-1增加到226.28 μg·kg-1·h-1和从17.84 μg·kg-1·h-1增加到97.21 μg·kg-1·h-1,添加草酸后土壤N2O排放速率,低浓度处理组高于高浓度处理组;葡萄糖处理中低浓度组低于高浓度组,低浓度丝氨酸、高浓度丝氨酸、低浓度葡萄糖和高浓度葡萄糖处理的土壤N2O排放速率分别从70.72 μg·kg-1·h-1增加到125.79 μg·kg-1·h-1、50.82 μg·kg-1·h-1增加到171.71 μg·kg-1·h-1、20.34 μg·kg-1·h-1增加126.69 μg·kg-1·h-1和20.46 μg·kg-1·h-1增加到185.21 μg·kg-1·h-1。
双因素方差分析显示N2O累计排放量受根系分泌物和浓度共同作用的影响(<0.05)(表1)。N2O累计排放量低浓度处理组:草酸处理>丝氨酸处理>葡萄糖处理,而在高浓度处理组:葡萄糖处理>丝氨酸处理>草酸处理。单因素方差分析显示,低浓度草酸、高浓度丝氨酸和高浓度葡萄糖处理土壤N2O累计排放速率显著高于对照(<0.05)。增加根系分泌物浓度时,仅高浓度葡萄糖处理N2O累计排放量显著高于低浓度葡萄糖处理(<0.05)。
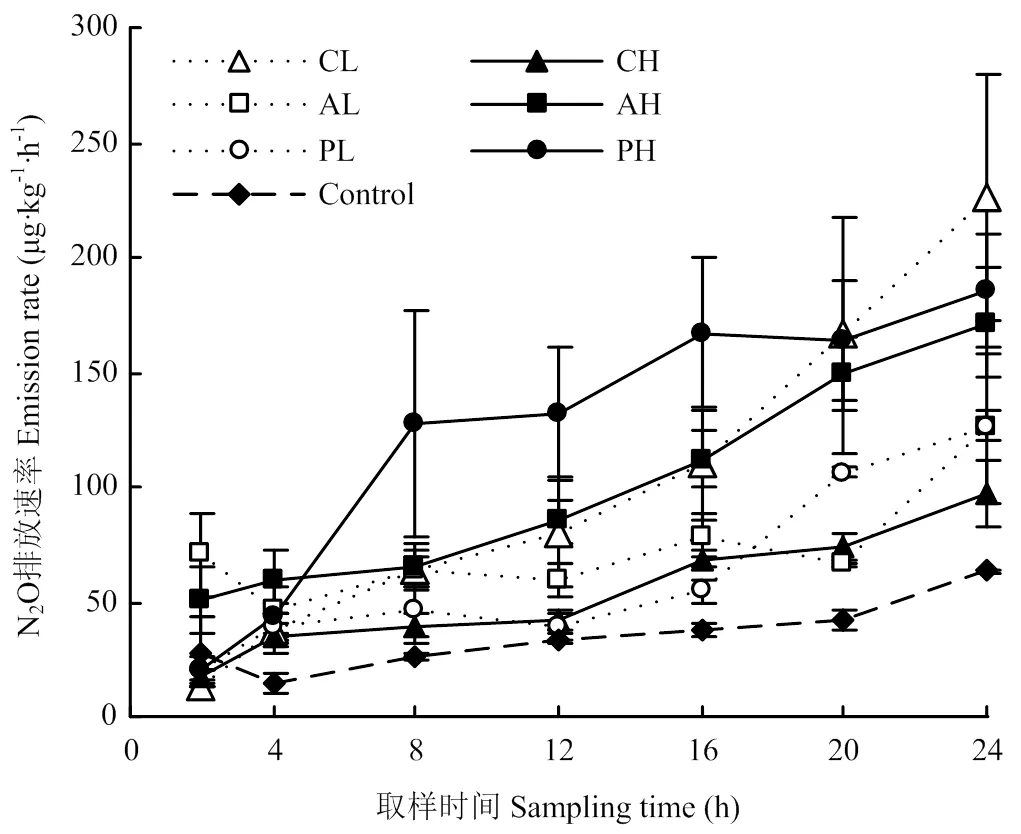
误差线表示标准误差(n=3)。下同
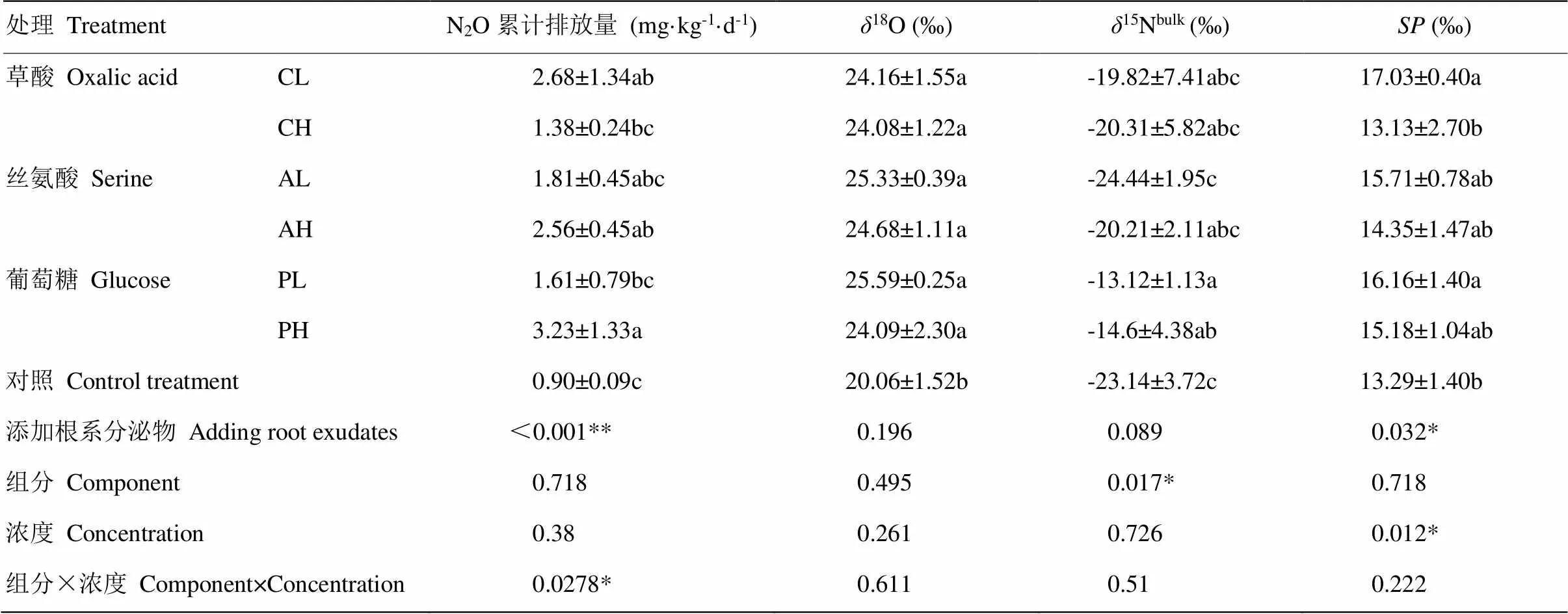
表1 N2O累计排放量和同位素日加权平均值
CL:150 μg C·d-1草酸处理;CH:300 μg C·d-1草酸处理;AL:150 μg C·d-1丝氨酸处理;AH:300 μg·C·d-1丝氨酸处理;PL:150 μg C·d-1葡萄糖处理;PH:300 μg·C·d-1葡萄糖处理;Control:蒸馏水处理(对照)。下同
CL: 150 μg C·d-1Oxalic acid treatment; CH: 300 μg·C·d-1Oxalic acid treatment; AL:150 μg C·d-1serine treatment; AH:300 μg C·d-1serine Treatment; PL:150 μg C·d-1glucose treatment; PH: 300 μg C·d-1glucose treatment; Control: Distilled water treatment. The same as below
18O,15Nbulk和SP的值为各处理不同采样时间同位素值的加权平均值,由公式(5)计算。下同
The weighted average of18O,15Nbulkand SP were calculated by equation (5). The same as below
同列中小写字母表示单因素方差分析(One-Way ANOVA)显著性<0.05。*表示双因素方差分析(Two-Way ANOVA)显著性<0.05
The values followed by different little letters in the same column indicate the significant differences between treatments at<0.05 level using One-Way ANOVA. * indicate the significant differences between treatments at<0.05 level using Two-Way ANOVA
2.2 N2O同位素值的日变化
不同处理土壤N2O同位素特征值不同(图2)。添加根系分必物处理的18O变化基本一致,稳定在23.43‰—25.90‰;而对照则在20.69‰—22.13‰。3种不同根系分泌物处理N2O的15Nbulk值不同,葡萄糖处理组15Nbulk值最高,变化范围分别是:-15.22‰— 13.55 ‰(低浓度)和-14.82‰—-10.70‰(高浓度)。低浓度丝氨酸处理15Nbulk值的范围是-26.56‰— 22.07‰,低于高浓度丝氨酸处理(-22.21‰— -16.66‰)。两浓度草酸处理15Nbulk值差异较小,低、高浓度的变化范围分别是-21.89‰—-15.27‰和-23.97‰—-16.75‰。3种根系分泌物浓度越高,SP值越低,低浓度草酸处理SP值从16.27‰增加至17.65‰,高浓度草酸处理SP值从16.69‰降至12.67‰;两浓度的丝氨酸处理SP值逐渐升高,低浓度丝氨酸和高浓度丝氨酸处理变化范围是:11.64‰—18.50‰和11.45‰—14.83‰;两浓度葡萄糖处理SP值先升高后降低,极值分别出现在添加葡萄糖后的第8小时(18.79‰)和第12小时(17.26‰)。
双因素方差分析显示,N2O的15Nbulk受添加根系分泌物成分的影响(<0.05),其中葡萄糖处理15Nbulk值最高((-13.86±1.11)‰)。SP值受添加根系分泌物浓度的影响(<0.05),浓度越高,SP值越低。单因素方差分析显示添加根系分泌物处理N2O的18O值显著高于对照(<0.05),但不同组分处理间无差异;添加葡萄糖和丝氨酸的不同浓度间N2O的SP值均无明显差异;添加草酸后土壤N2O的SP值,低浓度处理组显著高于高浓度处理组(<0.05)。
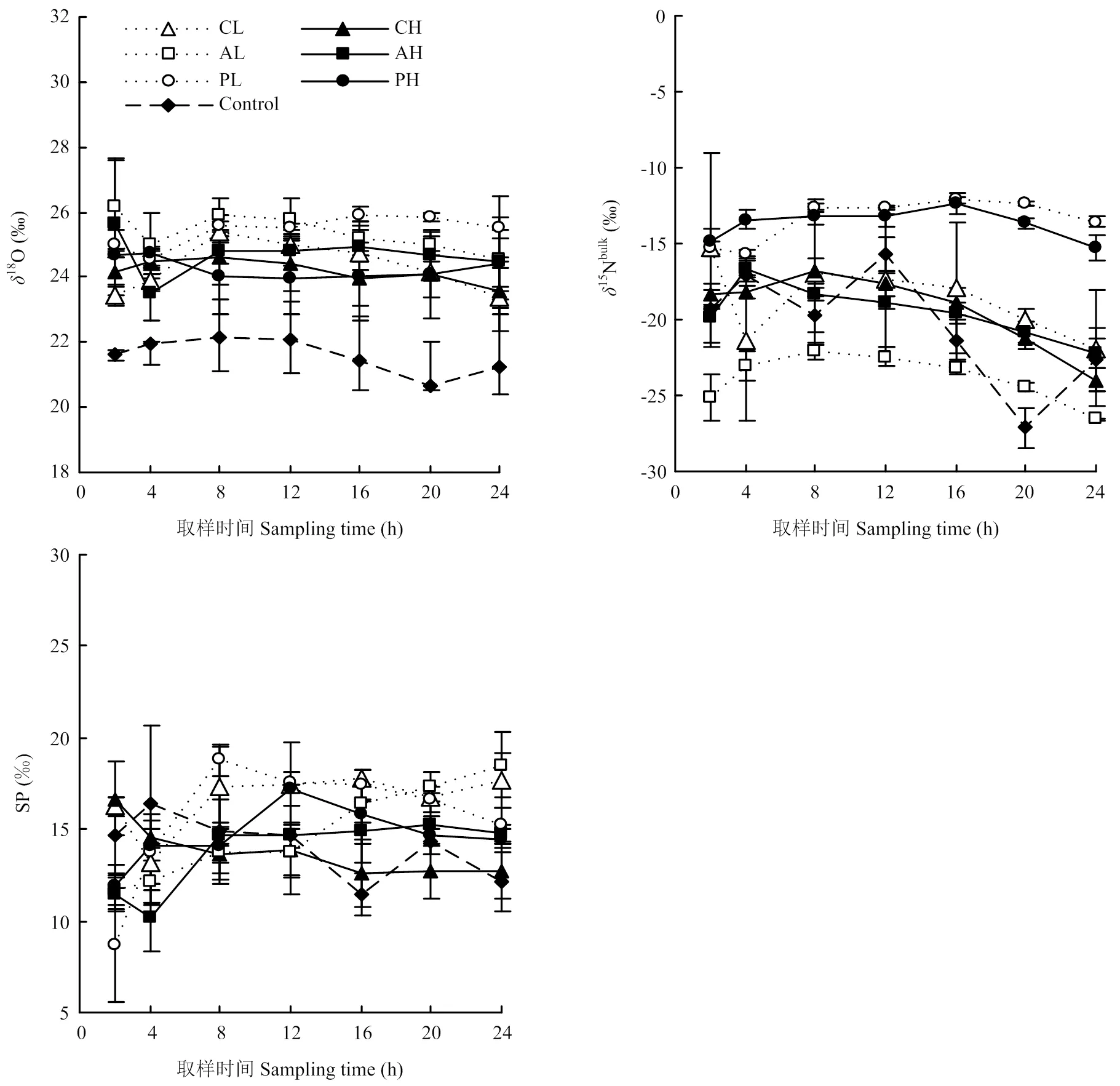
图2 添加不同根系分泌物后N2O同位素特征值(δ18O, δ15Nbulk, SP)随时间的变化
2.3 不同处理反硝化作用对N2O排放的贡献
通过二元混合模型(公式(6),(7))计算各处理反硝化作用和硝化作用对土壤N2O排放的相对贡献率如图3所示。空白对照处理、低浓度草酸、高浓度草酸、低浓度丝氨酸、高浓度丝氨酸、低浓度葡萄糖、高浓度葡萄糖处理反硝化作用的贡献分别是:60%、48%、60%、52%、57%、51%、54%。添加草酸、丝氨酸、葡萄糖的浓度越高,反硝化作用越强。
2.4 各时刻N2O排放速率和同位素特征值的校正系数
N2O排放速率和同位素特征值随时间有一定的变化,添加根系分泌物后各时刻的检测值和日平均值的校正系数如图4所示。不同指标的校正系数的波动范围不同,N2O排放速率的校正系数波动较大(0.49—8.46),同位素值的校正系数波动较小(0.79—1.87),其中各指标前8 h校正系数的波动较大,后逐渐减小。N2O排放速率的校正系数为1时的点在添加根系分泌物后的第16 h;N2O的18O值24 h内比较稳定,各处理校正系数稳定在1附近;N2O的15Nbulk值的校正系数呈先增高后降低的趋势,校正系数为1的点出现在添加根系分泌物后的第2—8小时和第16—20小时;SP值的校正系数为1的点出现在添加根系分泌物后的第16—20小时。
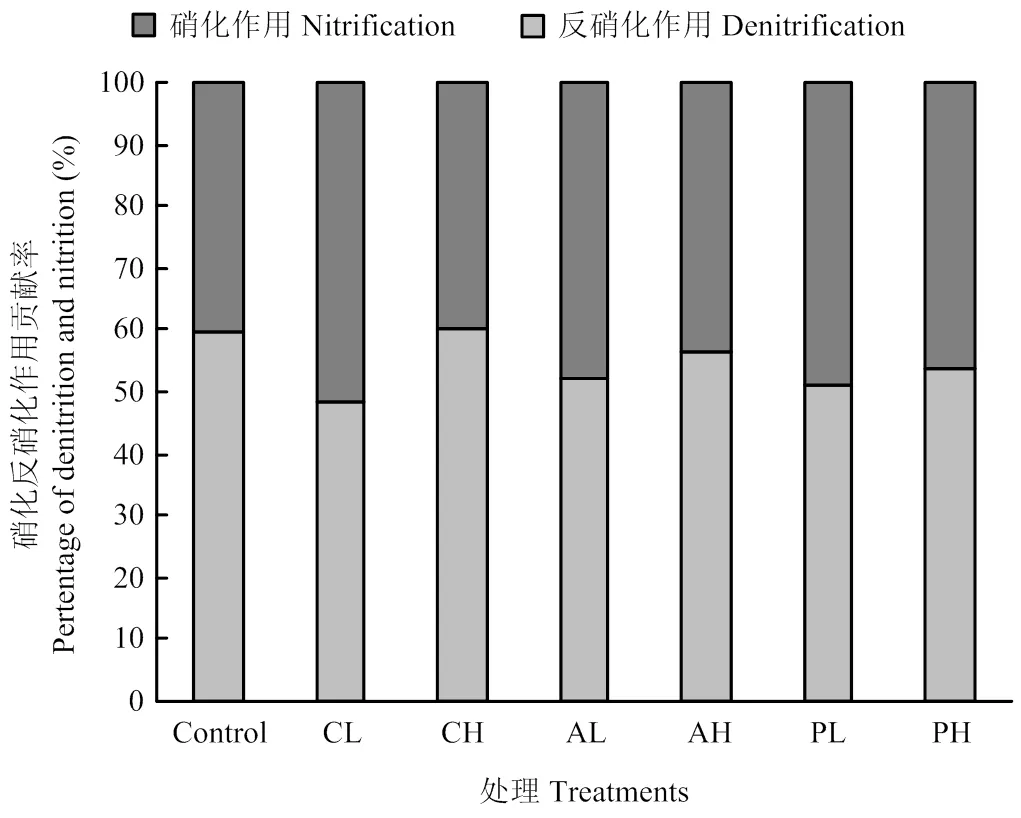
图3 不同处理反硝化作用-硝化作用对N2O排放的贡献

图4 添加根系分泌物后各时刻N2O排放速率,稳定同位素值(δ18O, δ15Nbulk,SP)的校正系数
3 讨论
3.1 根系分泌物组分和浓度对N2O排放量及其同位素特征值的影响
本研究发现添加根系分泌物处理土壤N2O排放量高于对照,说明根系分泌物的添加会促进土壤N2O的排放,这和以往研究结果一致[46-47]。植物根系分泌物使植物通过光合作用固定的碳外流[48],并以有机碳的形式释放到土壤中。微生物从根系分泌物中获取能量,使土壤酶数量增大,活性增强,导致N2O排放量的增加[49]。植物根系分泌物也可作为碳源改变微生物细胞内N2O产生过程的电子传递途径[50],并促进N2O的产生。微生物对不同根系分泌物的响应机制不同,从而导致N2O产生路径也会有差异,进而造成N2O排放量的差异。
本研究发现添加3种根系分泌物处理间土壤N2O的18O值无明显差异,且均显著高于对照(<0.05)。还原为N2O的反硝化过程(→→NO→ N2O)可看作O逐渐去除的过程,16O比18O更容易断裂使得产物N2O中富集18O从而产生同位素分馏[38];同时,N2O还原(N2O→N2)过程也会导致剩余N2O的18O值升高[51-52]。而在还原过程中产生的中间产物可能会与环境中的H2O发生O交换,从而减弱在还原过程中发生的分馏效应[38]。以上反硝化过程中的每一个还原步骤均是在不同酶的催化下发生,且导致不同的O同位素分馏[53]。因此根系分泌物处理组土壤N2O的18O值高于对照组可能是由于根系分泌物的添加促进了反硝化作用的进行,使反硝化还原酶活性改变所致;且3种根系分泌物可能共同作用了某一种对O同位素分馏起关键作用的酶而导致处理间N2O的18O值无差异。另外,添加3种根系分泌物可能造成了不同程度的N2O向N2的还原。
各根系分泌物处理N2O的15Nbulk值不同,15Nbulk值受根系分泌物组分的影响。在肥料充足的土壤条件下,N2O的15Nbulk值的升高和降低是由多种原因造成的,同位素的分馏可能是重要的原因。硝化作用的产物可作为反硝化作用的底物,根据同位素分馏原理,微生物优先利用轻同位素而导致产物发生重同位素贫化[54]使由反硝化过程产生的N2O的15Nbulk值降低;其次,N2O还原可能对15Nbulk值产生重要影响,N2O还原过程中14N-O键比15N-O键更容易断裂,导致剩余N2O的15Nbulk值升高;所以添加根系分泌物通过促进反硝化过程和N2O还原可能会导致N2O的15Nbulk值升高[30]。又因为土壤中的不同微生物过程导致的N同位素分馏不同[55],这使得不同根系分泌物处理的土壤N2O的15Nbulk值有差异。由于葡萄糖会促进N2O还原过程,该理论已在本课题组其他研究中得到验证[56]。此外,Speir等[57]通过15N标记肥料也发现,葡萄糖为易有效碳,而易有效碳的添加会促进反硝化过程进行完全,促进N2O向N2的还原过程,这可能是葡萄糖处理组N2O的15Nbulk值显著高于对照的原因(<0.05)。
SP值表征的是直线型分子N2O(N-N-O)的分子内15N的位置嗜好性差异,该值和微生物过程有关,是一个被国际认可的N2O溯源研究工具[35]。本研究发现同一根系分泌物组分作用下,SP值随根系分泌物浓度的升高而降低。由于纯细菌培养下硝化作用下产生的N2O的SP值为33‰[38-39],反硝化作用下产生的N2O的SP值为0‰[40-41]。本研究所有处理SP值介于两者之间则说明产生的N2O来源于硝化作用和反硝化作用的共同作用。根据硝化和反硝化的二元混合模型可知SP值的升高和降低分别代表土壤微生物过程趋于硝化作用方向和反硝化作用进行,SP值越低,则反硝化作用越强。根系分泌物的添加为土壤提供碳源,从而促进了异养微生物作用下的反硝化过程。在适宜范围内,反硝化作用随着土壤碳源浓度的升高而增强,则产生的N2O的SP值也会因此而降低。
3.2 基于N2O排放速率及同位素特征值确定最佳取样时间
在采取手动N2O气体观测中,通常采用1次的检测结果而作为1日甚至多日的平均情况,所以采样时间的选择尤为重要。根据研究需要,基于不同指标的取样时间不同,N2O排放速率、N2O的15Nbulk及SP值的最佳取样时间分别为添加根系分泌物后的第12—16 h、4—8 h或16—20 h和16 h。由于N2O的18O值随着培养时间无明显变化,因此,取样时间对N2O的18O值的影响不大。综合N2O的排放速率和各稳定同位素值的取样时间,选择添加根系分泌物后的第16 h为最佳取样时间,从而可以对各个指标进行综合分析,更有利于量化不同微生物过程对土壤N2O排放的贡献率。对各处理最佳取样时间下得到的各个指标的结果分别与日平均值做相关分析显示(图5)。N2O排放速率:2=0.93(<0.001),N2O的18O值:2=0.71(<0.001),N2O的15Nbulk值:2=0.91(<0.05),SP值:2=0.91(<0.001)。因此,确定不同处理组的最佳取样时间是添加根系分泌物后的第16小时。此外,该时刻同位素值相对稳定,说明土壤内微生物过程稳定,利于分析N2O产生的微生物过程,因此结果最具代表性。
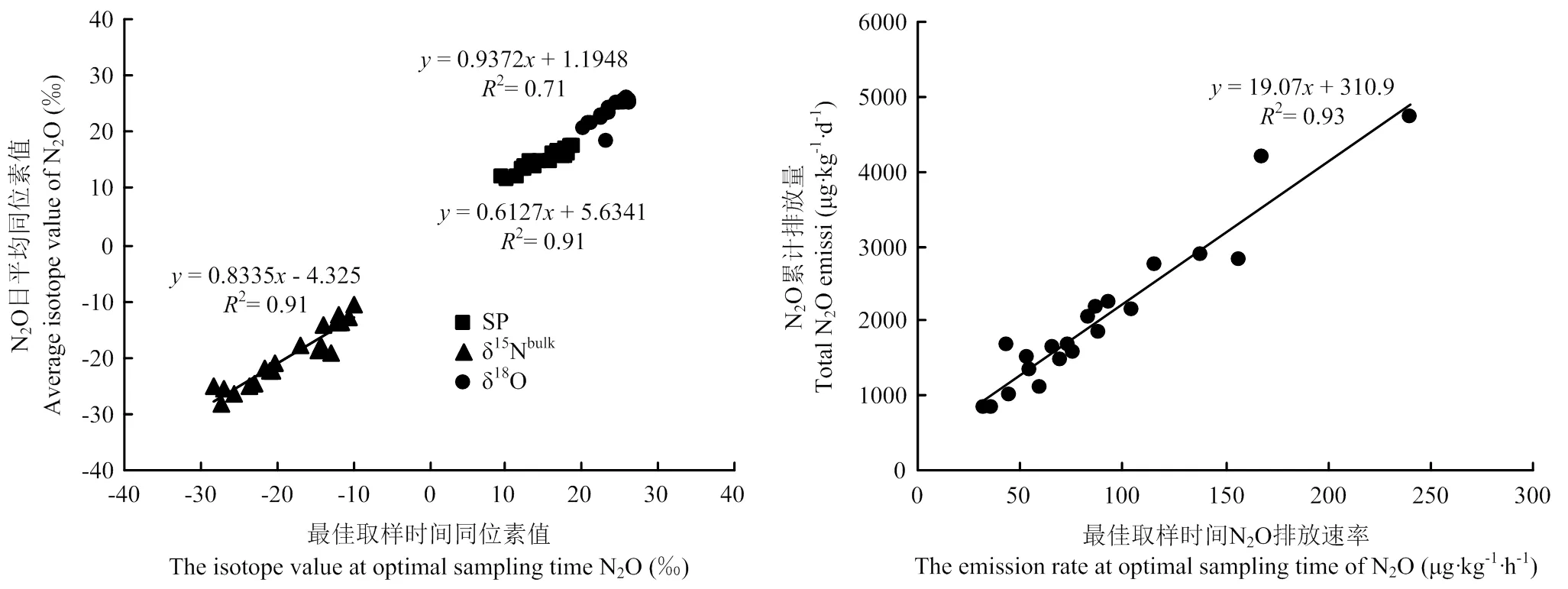
图5 最佳取样时间N2O排放速率、稳定同位素值(δ18O, δ15Nbulk, SP)和日平均值的比较
3.3 研究展望
鉴于稳定同位素技术在区分N2O产生的微生物过程中存在优势,未来将继续利用同位素技术围绕不同根系分泌物组分及其组合作用下对土壤N2O的贡献规律及其产生的多种微生物途径进行研究。由于N2O还原对同位素值的影响较大,且促进N2O还原为N2是减少农业土壤N2O排放的努力方向,所以未来研究将N2O还原纳入考虑,同时引入国际稳定同位素先进技术和方法,如15Nbulk-18O模型和15Nbulk-SP模型,通过对反应底物浓度、底物同位素和前体同位素图谱的综合分析,进一步阐明植物根系分泌物对土壤N2O产生的作用机制。
4 结论
通过外源添加根系分泌物3种主要组分,研究其对N2O排放高峰期的排放速率和稳定同位素特征值的影响。在施加NH+ 4的土壤中添加草酸、丝氨酸、葡萄糖促进土壤N2O的排放,高浓度组处理葡萄糖的促进效果最强,而低浓度组处理草酸的促进效果最强;根系分泌物作用下土壤排放N2O的18O的值升高;根系分泌物不同组分作用下N2O的15Nbulk值不同,葡萄糖的添加使15Nbulk值显著升高;各处理N2O的SP值的范围为13.13‰—15.03‰,根系分泌物浓度越高SP值越低;反硝化作用对N2O的贡献越强。通过对所测指标(N2O排放速率、15Nbulk、18O和SP值)的校正系数和回归分析显示添加根系分泌物后的最佳取样时间为添加根系分泌物后的第16小时。
[1] Chapuis Lardy L, Wrage N, Metay A, Chotte J L, Bernoux M. Soils, a sink for N2O? A review.2010, 13(1): 1-17.
[2] Conrad R. Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO).1996, 60(4): 609-640.
[3] SEITZINGER S P, KROEZE C, STYLES R V. Global distribution of N2O emissions from aquatic systems: natural emissions and anthropogenic effects.2000, 2(3/4): 267-279.
[4] NEVISON C, HOLLAND E. A reexamination of the impact of anthropogenically fixed nitrogen on atmospheric N2O and the stratospheric O3layer.. 1997, 102(D21): 25519-25536.
[5] 韩丽梅, 鞠会艳, 杨振明. 两种基因型大豆根分泌物对大豆根腐病菌的化感作用. 应用生态学报, 2005(1): 137-141.
HAN L M, JU H Y, YANG Z M. Allelopathy of root exudates from two genotypes soybeans on root rot pathogenic fungi.2005(1): 137-141. (in Chinese)
[6] STAVI I, LAL R. Agriculture and greenhouse gases, a common tragedy. A review.2013, 33(2): 275-289.
[7] 胡春胜, 张玉铭, 秦树平, 王玉英, 李欣晓, 董文旭. 华北平原农田生态系统氮素过程及其环境效应研究. 中国生态农业学报, 2018, 26(10): 1501-1514.
HU C S, ZHANG Y M, QIN S P, WANG Y Y, LI X X, DONG W X. Nitrogen processes and related environmental effects on agroecosystem
in the North China Plain.2018, 26(10): 1501-1514. (in Chinese)
[8] MAN-YOUNG J, REINHARD W, DEULLAE M, ANETTE G, SOO JE P, JONG GEOL, SO JEONG K, SUNG KEUN RHEE. Isotopic signatures of N2O produced by ammonia-oxidizing archaea from soils.2013, 8(5): 1115-1125.
[9] Bernot M J, Dodds W K, Gardner W S, mccarthy M J, Sobolev D, Tank L. Comparing denitrification estimates for a texas estuary by using acetylene inhibition and membrane inlet mass spectrometry., 2003, 69(10): 5950-5956.
[10] Sutka R L, Ostrom N E, Ostrom P H, Breznak J A, Gandhi H, Pitt A J, Li F. Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances.2006 72(1): 638-644.
[11] BAGGS E, MAIR L, MAHMOOD S. A review of stable isotope techniques for N2O source partitioning in soils: recent progress, remaining challenges and future considerations.2007, 22(11): 1664-1672.
[12] 丁军军, 张薇, 李玉中, 林伟, 徐春英, 李巧珍.不同灌溉量对华北平原菜地N2O排放及其来源的影响. 应用生态学报, 2017, 28(7): 2269-2276.
DING J J, ZHANG W, LI Y Z, LIN W, XU C Y, LI Q Z. Effects of soil water condition on N2O emission and its sources in vegetable farmland of North China Plain.2017, 28(7): 2269-2276. (in Chinese)
[13] 郑欠, 丁军军, 李玉中, 林伟, 徐春英, 李巧珍, 毛丽丽. 土壤含水量对硝化和反硝化过程N2O排放及同位素特征值的影响. 中国农业科学, 2017, 50(24): 4747-4758.
ZHENG Q, DING J J, LI Y Z, LIN W, XU C Y, LI Q Z, MAO L L. The effects of soil water content on N2O emissions and isotopic signature of nitrification and denitrification.2017, 50(24): 4747-4758. (in Chinese)
[14] ČUHEL J, ŠIMEK M, LAΜGHLIN R J, BRU D, CHENEBY D. WATSON CJ, PHILIPPOT L. Insights into the effect of soil pH on N2O and N2emissions and denitrifier community size and activity.2010, 76(6): 1870-1878.
[15] HANG-WEI H, DELI C, JI-ZHENG H. Microbial regulation of terrestrial nitrous oxide formation: understanding the biological pathways for prediction of emission rates.2015, 39(5): 729-749.
[16] SHUKRA RAJ P, OHKYUNG C, SAMIR KUMAR K, KARTIK C, SUNGPYO K, JAW WOO L. Effects of temperature on nitrous oxide (N2O) emission from intensive aquaculture system.2015, 518-519: 16-23.
[17] LAI T V, FARQUHARSON R, DENTON M D. High soil temperatures alter the rates of nitrification, denitrification and associated N2O emissions.2019,19(5): 2176-2189.
[18] BOUWMAN A F, BEUSEN A H W, GRIFFIOEN J, VAN GROENIGEN J W, HEFTING M M, OENEMA O, VAN PUIJENBROEK P J T M, SEITZINGE R S, SLOMP C P, STEHFEST E. Global trends and uncertainties in terrestrial denitrification and N2O emissions.2013, 368(1621): 91-97.
[19] JONES D L, NGUYEN C, FINLAY R D. Carbon flow in the rhizosphere: carbon trading at the soil–root interface.2009, 321(1/2): 5-33.
[20] BAIS H P, WEIR T L, PERRY L G, GILROY S, VIVANCO J M. The role of root exudates in rhizosphere interactions with plants and other organisms.,2006, 57(1): 233-266.
[21] HAICHAR F E Z, SANTAELLA C, HEULIN T, ACHOUAK W. Root exudates mediated interactions belowground.2014, 77(7): 69-80.
[22] BATEMAN E J, BAGGS E M. Contributions of nitrification and denitrification to N2O emissions from soils at different water-filled pore space.2005, 41(6): 379-388.
[23] WU H, WANG X, HE X, ZHANG S, LIANG R, SHEN J. Effects of root exudates on denitrifier gene abundance, community structure and activity in a micro-polluted constructed wetland.2017, 598: 697-703.
[24] 马舒坦, 颜晓元. 甲酸盐和葡萄糖对两种土壤N2O排放的刺激作用. 农业环境科学学报, 2019, 38(1): 241-248.
MA S T, YAN X Y. Effect of formate and glucose organic carbon on N2O emission from two soils.2019, 38(1): 241-248. (in Chinese)
[25] LAPALANGARICA FUENTES A, MANRUBIA M, GILES M E, MITCHELL S, DANIELL T J. Effect of model root exudate on denitrifier community dynamics and activity at different water-filled pore space levels in a fertilised soil.2018, 120: 70-79.
[26] 徐卫红, 刘吉振, 黄河, 熊治廷. 高锌胁迫下不同大白菜品种生长、Zn吸收及根系分泌物的研究. 中国农学通报, 2006, 22(8): 458.
XU W H, LIU J Z, HUANG H, XIONG Z Y. Study of Zn stress on plant growth, Zn uptake and root exudates in different cultivars of Chinese Cabbage.2006, 22(8): 458. (in Chinese)
[27] YUAN Y S, ZHAO W Q, ZHANG Z L, XIAO J, LI D D, LIU Q, YIN H J. Impacts of oxalic acid and glucose additions on N transformation in microcosms via artificial roots.2018, 121: 16-23.
[28] BOL R, RÖCKMANN T, BLACKWELL M, YAMULKI S. Influence of flooding on15N,18O,115N and215N signatures of N2O released from estuarine soils-a laboratory experiment using tidal flooding chambers.2004, 18(14): 1561-1568.
[29] HU G Q, HE H B, ZHANG W, ZHAO J S, CUI J H, LI B, ZHANG X D. The transformation and renewal of soil amino acids induced by the availability of extraneous C and N.2016, 96: 86-96.
[30] HENRY S, TEXIER S, HALLET S, BRU D, DAMBREVILLE C, CHÈNEBY D, BIZOUARD F, GERMON J C, PHILIPPOT L. Disentangling the rhizosphere effect on nitrate reducers and denitrifiers: insight into the role of root exudates.2010, 10(11): 3082-3092.
[31] OBURGER E, JONES D L. Sampling root exudates – mission impossible?2018, 6:116-133.
[32] TOYODA S, YOSHIDA N. Determination of nitrogen isotopomers of nitrous oxide on a modified isotope ratio mass spectrometer., 1999, 71(20): 4711-4718.
[33] OPDYKE M R, OSTROM N E, OSTROM P H. Evidence for the predominance of denitrification as a source of N2O in temperate agricultural soils based on isotopologue measurements.2009, 23(4). DOI:10.1029/2009GB003523.
[34] 房福力, 李玉中. 基于同位素特征的华北平原菜地N2O排放监测中取样时间的探讨. 植物营养与肥料学报, 2016, 22(4): 978-987.
FANG F L, LI Y Z. Preliminary research on N2O sampling time based on isotopomer signature measurement of vegetable fields in the North China Plain.2016, 22(4): 978-987. (in Chinese)
[35] Toyoda S, Mutobe H, Yamagishi H, Yoshida N, Tanji Y. Fractionation of N2O isotopomers during production by denitrifier.2005, 37(8): 1535-1545.
[36] DECOCK C, SIX J. How reliable is the intramolecular distribution of15N in N2O to source partition N2O emitted from soil?2013, 65: 114-127.
[37] ZHANG W, LI Y Z, XU C Y, LI Q Z, LIN W. Isotope signatures of N2O emitted from vegetable soil: Ammonia oxidation drives N2O production in NH+ 4-fertilized soil of North China., 2016, 6: 29257.
[38] Toyoda S, Mutobe H, Yamagishi H, Yoshida N, Tanji Y. Fractionation of N2O isotopomers during production by denitrifier.2005, 37(8): 1535-1545.
[39] Jung M Y, Well R, Min D, Giesemann A, Rhee S K. Isotopic signatures of N2O produced by ammonia-oxidizing archaea from soils.2013, 8(5): 1115-1125.
[40] Yamazaki T, Hozuki T, Arai K, Toyoda S, Koba K, Fujiwara T. Isotopomeric characterization of nitrous oxide produced by reaction of enzymes extracted from nitrifying and denitrifying bacteria.2014, 11(10): 2679-2689.
[41] BRAKER G, LEWICKASZCZEBAK D. Dual isotope and isotopomer signatures of nitrous oxide from fungal denitrification a pure culture study.2014, 28(17): 1893-1903.
[42] 张仲新, 李玉娥, 华珞, 万运帆, 姜宁宁. 不同施肥量对设施菜地N2O排放通量的影响. 农业工程学报, 2010, 26(5): 269-275.
ZHANG Z X, LI Y E, HUA L, WAN Y F, JIANG N N. Effects of different fertilizer levels on N2O flux from protected vegetable land.2010, 26(5): 269-275. (in Chinese)
[43] 田慎重, 宁堂原, 迟淑筠, 王瑜, 王丙文, 韩惠芳, 李成庆, 李增嘉. 不同耕作措施的温室气体排放日变化及最佳观测时间. 生态学报, 2012, 32(3): 879-888.
Tian s Z, ning t Y, chi s Y, wang y, wang b W, han h F, li c Q, li z J. Diurnal variations of the greenhouse gases emission and their optimal observation duration under different tillage systems.2012, 32(3): 879-888. (in Chinese)
[44] 徐钰, 刘兆辉, 石璟, 魏建林, 李国生, 王梅, 江丽华. 北方设施菜地土壤N2O排放通量日变化及最佳观测时间确定. 中国农业气象, 2016, 37(5): 505-512.
XU Y, LIU Z H, SHI J, WEI J L, LI G S, WANG M, JIANG L H. Diurnal variation characteristic of nitrous oxide from greenhouse vegetable soil during emission peak and its optimal observation duration.2016, 37(5): 505-512. (in Chinese)
[45] 郑循华, 王明星, 王跃思. 太湖地区农田NO排放不连续测量最佳时间. 环境科学, 2000, 21(1): 1-6.
Zheng x H, wang m X, wang y S. Diurnal variation of NO emission from an ecosystem and the optimum observation time for intermittent flux measurement.2000, 21(1): 1-6. (in Chinese)
[46] 王琳, 周晓丽, 马银丽, 巨晓棠, 吉艳芝, 张丽娟. 铵态氮源和碳源对土壤N2O、CO2释放的影响. 农业资源与环境学报, 2016, 33(1): 23-28.
WANG L, ZHOU X L, MA Y L, JU X T, JI Y Z , ZHANG L J. Effect of ammonium nitrogen source and carbon source on the CO2and N2O emissions of soil.2016, 33(1): 23-28. (in Chinese)
[47] 李贵桐, 李保国, 黄元仿. 碳源与底物对不同层次土壤产生N2O能力的影响. 土壤与环境, 2002, 11(3): 227-231.
LI G T, LI B G, HUANG Y F. Effects of carbon and substrate on the N2O productivity of different soil layers.2002, 11(3): 227-231. (in Chinese)
[48] NGUYEN C. Rhizodeposition of organic C by plants: mechanisms and controls.2003, 23: 375-396.
[49] HENRY S, TEXIER S, HALLET S, BRU D, DAMBREVILLE C, CHÈNEBY D, BIZOUARD F, GERMON J C, PHILIPPOT L. Disentangling the rhizosphere effect on nitrate reducers and denitrifiers: Insight into the role of root exudates., 2010, 10(11): 3082-3092.
[50] Mothapo N, Chen H, Cubeta M A, Grossman J M, Fuller F, Shi W. Phylogenetic, taxonomic and functional diversity of fungal denitrifiers and associated N2O production efficacy.2015, 83: 160-175.
[51] Kool D M, Wrage N, Oenema O, Dolfing J, Van Groenigen J W. Oxygen exchange between (de)nitrification intermediates and H2O and its implications for source determination of NO- 3, and N2O: a review.2010, 21(22): 3569-3578.
[52] CASCIOTTI K L, SIGMAN D M, HASTINGS M G, BOHLKE J K, HILKERT A. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method.2002, 74(19): 4905-4912.
[53] ROHE L, WELL R, LEWICKA SZCZEBAK D. Use of oxygen isotopes to differentiate between nitrous oxide produced by fungi or bacteria during denitrification.2017, 31(16): 1297-1312.
[54] PÉREZ T, TRUMBORE S. E, TYLER S C, MATSON P A, ORTIZ MONASTERIO I, RAHN T, GRIFFITH D W T. Identifying the agricultural imprint on the global N2O budget using stable isotopes.2001, 106(9): 9869-9878.
[55] Hyodo A, Malghani S, Zhou Y, Mushinski R M, West J B. Biochar amendment suppresses N2O emissions but has no impact on15N site preference in an anaerobic soil.2019, 33(2):165-175.
[56] 郑欠. 土壤水分和pH对N2O排放及同位素特征值影响的机理研究[D]. 北京: 中国农业科学院, 2018.
ZHENG Q. The study on mechanism of N2O emissions and isotopic signature under different soil water content and pH[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[57] SPEIR T W, KETTLES H A, MORE R D. Aerobic emissions of N2O and N2from soil cores: Factors influencing production from13N-labelled NO3-and NH4+.1995, 27(10): 1299-1306.
[58] Henderson S L, Dandie C E, Goyer C, Patten C, Zebarth B J, Burton D L, Trevors J T. Changes in denitrifier abundance, denitrification gene mRNA levels, nitrous oxide emissions, and denitrification in anoxic soil microcosms amended with glucose and plant residues.2010, 76: 2155-2164.
[59] 贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力红壤性水稻土氮素转化的影响. 中国农业科学, 2010, 43(8): 1617-1624.
JIA J X, LI Z P, CHE Y P. Effects of glucose addition on N transformations in paddy soils with a gradient of organic C content in subtropical China., 2010, 43(8): 1617-1624. (in Chinese)
[60] 崔敏, 冉炜, 沈其荣. 水溶性有机质对土壤硝化作用过程的影响. 生态与农村环境学报, 2006, 22(3): 45-50.
CUI M, RAN W, SHEN Q R. Effects of dissolved organic matter on nitrification in soil., 2006, 22(3): 45-50. (in Chinese)
[61] 王风, 陈思, 杨厚花, 沈仕洲, 张克强, 王晓光. 葡萄糖添加对室温和冻结过程土壤N2O排放特征影响. 生态科学, 2017, 36(3): 31-35.
WANG F, CHEN S, YANG H H, SHEN S Z, ZHANG K Q, WANG X G. Effect of glucose addition on N2O emission from three types of cultivated soils under ambient and freezing temperature.2017, 36(3): 31-35. (in Chinese)
[62] 姜宁宁, 李玉娥, 华珞, 万运帆, 石生伟. 不同氮源及秸秆添加对菜地土壤N2O排放影响. 土壤通报, 2012, 43(1): 219-223.
JANG N N, LI Y E, HUA L, WAN Y F, SHI S W. Effect of different nitrogen sources and straw adding on N2O emission from vegetable soil.2012, 43(1): 219-223. (in Chinese)
[63] 林伟, 张薇, 李玉中, 徐春英, 徐春英, 李巧珍, 郑欠. 有机肥与无机肥配施对菜地土壤N2O排放及其来源的影响. 农业工程学报, 2016, 32(19): 148-153.
LIN W, ZHANG W, LI Y Z, XU C Y, LI Q Z, ZHENG Q. Effects of combined application of manure and inorganic fertilizer on N2O emissions and sources in vegetable soils.2016, 32(19): 148-153. ( in Chinese)
[64] 林伟, 丁军军, 李玉中, 徐春英, 李巧珍, 郑欠, 庄姗. 有机肥和无机肥对菜地土壤N2O排放及其来源的影响. 应用生态学报, 2018, 29(5): 100-108. (in Chinese)
LIN W, DING J J, LI Y Z, XU C Y, LI Q Z, ZHENG Q, ZHUANG S. Effects of organic and inorganic fertilizers on emission and sources of N2O in vegetable soils.2018, 29(5): 100-108. (in Chinese)
[65] MCLAIN J E T, MARTENS D A. Nitrous oxide flux from soil amino acid mineralization., 2005, 37(2): 289-299.
[66] CLARHOLM M, SKYLLBERG U, ROSLING A. Organic acid induced release of nutrients from metal-stabilized soil organic matter- The unbutton model.2015, 84: 168-176.
[67] Keiluweit M, Boμgoure J J, Nico P S, Pett Ridge J, Kleber M. Mineral protection of soil carbon counteracted by root exudates.2015, 5(6): 588-595.
[68] MALÝ S, KRÁLOVEC J, HAMPEL D. Effects of long-term mineral fertilization on microbial biomass, microbial activity, and the presence of R and K -strategists in soil.2009, 45(7): 753-760.
[69] LIU B, BAKKEN L R, FROSTEGARD A. Denitrification gene pools, transcription and kinetics of NO, N2O and N2production as affected by soil pH.2010, 72(3): 407-417.
Effects of Different Root Exudates on Soil N2O Emissions and Isotopic Signature
ZHUANG Shan1, LIN Wei1, DING JunJun1, ZHENG Qian1, KOU XinYue1, LI QiaoZhen1, LI YuZhong1,2
(1Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/Key Laboratory of Dryland Farming Agriculture, Ministry of Agriculture and Rural Affairs, Beijing 100081;2Environmental Stable Isotope Laboratory, Chinese Academy of Agricultural Sciences, Beijing 100081)
【】The aim of this study was to investigate the effects of the main plant root exudates (organic acids, amino acids, sugars) on N2O emission and its microbial processes, so as to provide a support for selecting suitable plants to control soil N2O emissions. 【】 Three main components of root exudates, including oxalic acid, serine and glucose, were added in the soil, and two levels of concentration were set for each component: low concentration (150 μg C·d-1) and high concentration (300 μg C·d-1). There were totally 7 treatments with a control treatment treated with distilled water, and all treatments were incubated in 120 mL glass bottles in incubator. The gas samples were sampled 7 times within 24 hours after 2-hour incubation each time. After sampling, the N2O emission rate, daily cumulative emission and isotope signatures (15Nbulk,18O and SP (intramolecular15N site preference,15Nα-15Nβ)) were measured, then the optimal sampling time was determined according to their daily variation rules. 【】 The N2O emission rate of soils increased gradually after adding three components of root exudates, which were higher than the control treatment. The cumulative emission of N2O in the high concentration treatment was: Glucose treatments ((3.2±1.3) mg·kg-1·d-1)>Serine treatments ((2.6±0.5) mg·kg-1·d-1)>Oxalic acid treatments((1.4±0.2) mg·kg-1·d-1), low concentration treatment: Oxalic acid ((2.7±1.3) mg·kg-1·d-1)>Serine ((1.8±0.4) mg·kg-1·d-1)>Glucose ((1.6±0.8) mg·kg-1·d-1); the values of18O of N2O were not different among different root exudate treatments and were stable at 24.1‰-25.6‰, but significantly higher than the control treatment ((20.1±1.5) ‰);the15Nbulkvalue of N2O was related to the component of root exudates added, which was (-20.06±2.22) ‰ of oxalic acid treatment, (-22.33±1.10) ‰ of serine treatment, (-13.86±1.11) ‰ treated of glucose treatment, and (-23.14±3.72) ‰ of the control treatment. The SP value of N2O of each treatment ranged from 13.13‰ to 15.03‰, and the higher the root exudate concentration, the lower the SP value; after a comprehensive analysis of the correction coefficients of four indexes (N2O emission rate, the value of15Nbulk,18O and SP) at each sampling time and their daily mean values of 7 treatments, the correction coefficients of all treatments were closest to 1 at the 16th hour after the addition of root exudates.【】 In the soil environment with NH+ 4- 300 mg N·kg-1, the root exudates promoted N2O emission and the N2O emission rate increased gradually during the culture time (24 hours). The promotion effect of glucose in high concentration group was the strongest, while that of oxalic acid in low concentration group was the strongest. Compared with thecontrol treatment, the addition of root exudates significantly increased the18O value of N2O; the addition of glucose significantly increased the15Nbulkvalue of N2O. The higher the concentration of root exudates, the stronger the contribution of denitrification to N2O was detected.
root exudates; nitrification; denitrification; N2O; isotopic signature

10.3864/j.issn.0578-1752.2020.09.013
2019-08-02;
2019-11-06
国家自然科学基金(41473004,41701308)、国家重点研发计划项目(2017YFD0201702)
庄姗,Tel:18519190629;E-mail:489300802@qq.com。通信作者李玉中,Tel:18810871629;E-mail:liyuzhong@caas.cn
(责任编辑 李云霞)

