NMDA受体在全身麻醉药神经毒性中的作用研究进展
范舜钦, 张嘉伟, 李蒙蒙, 朱守强, 杨志来, 张雷, 顾尔伟
(1安徽医科大学第一附属医院麻醉科, 安徽 合肥 230022; 2安徽医科大学第一临床医学院, 安徽 合肥 230032)
据世界卫生组织统计, 全球每年约2.34亿人接受手术和麻醉, 其中全身麻醉药可能产生的神经毒性备受关注。 目前, 全身麻醉药神经毒性作用主要集中于婴幼儿发育神经毒性及老年群体围术期神经认知障碍(perioperative neurocognitive disorders, PND)领域。 在发育神经毒性方面, 临床研究发现[1-3], 短时间单次暴露于全身麻醉药不会影响婴幼儿神经发育; 而长时间或反复多次全身麻醉药暴露, 尚无明确证据表明会产生发育神经毒性作用; 而多数动物研究[4-5]发现长时间或反复多次全身麻醉药暴露会产生发育神经毒性。 临床与基础研究结论不一致, 可能一方面由于动物实验麻醉方法(持续时间及反复暴露次数)与临床麻醉真实情况相去甚远; 另一方面动物实验多未考虑手术创伤及其他医疗行为的潜在影响。 在PND研究方面, 虽然尚未明确全身麻醉药与PND之间的因果关系, 但基础实验和临床研究均表明全身麻醉药和手术暴露容易使老年患者(或老年啮齿类动物)发生PND[6-7]。 然而, 全身麻醉药产生神经毒性的具体机制尚不明确, 炎症反应、 神经递质失调以及离子通道功能异常均为可能的机制[8-9], 其中N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA )受体功能及分布异常在其中发挥了重要作用[10]。 本文将对NMDA受体在全身麻醉药神经毒性中的作用研究进展作一综述。
1 NMDA受体与全身麻醉药神经毒性
NMDA受体属于兴奋性离子型通道蛋白, 存在于神经元突触前与突触后结构中。 NMDA受体至少具有5个亚基, 主要由NR1亚基及至少4个NR2亚基组成。 NMDA受体亚基表达水平对其功能有很大的影响, NR2B和 NR2A在海马和皮层神经元中占主导地位, NR2C主要存在于小脑, NR2D较少表达。 NR2B在出生前以及出生后2周表达较高, 此后其表达水平下降[11-12]; NR2A在出生后的第1个月中表达稳定增加[12]。 在发育过程中, 突触中NR2B与NR2A的比例逐渐增加[13]。 在成熟海马体中, 突触 NR2A 的表达水平超过NR2B。 NMDA受体亚基具有N末端、 三次跨膜结构域以及C末端(图1)[14]。 NMDA受体C端的磷酸化是其发挥生理作用的主要方式[15-16]。 研究指出[17], NMDA受体在突触的空间分布也对其生物学效应产生影响: 突触上NMDA受体的激活可介导神经保护作用, 而突触外NMDA受体的激活可引起神经元死亡。
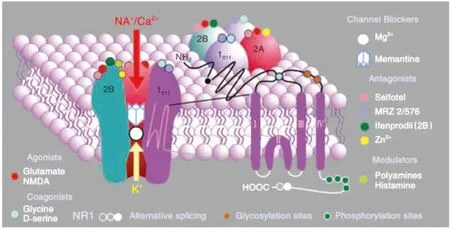
Memantine: NR2B 功能抑制剂; Ifenprodil: NR2B 功能抑制剂; MRZ 2/576: 甘氨酸位点NMDA受体拮抗剂.图1 NMDA受体在2个NR1和2个NR2亚基之间形成异四聚体[14]
NMDA受体广泛分布于中枢神经系统, 参与突触可塑性的形成, 并与中枢神经系统的发育以及疼痛、 学习、 记忆等密切相关[18]。 NMDA受体可通过介导钙离子内流增强突触可塑性; 然而, 其过度开放将导致钙超载或启动细胞死亡信号转导途径, 诱发凋亡。 此外, 通过调控突触上与突触外NMDA受体的表达与功能也可对细胞存活产生影响[14]。 NMDA受体作为许多全身麻醉药的作用靶点, 也是介导全身麻醉药神经毒性的重要机制之一。 全身麻醉药主要通过以下机制影响NMDA受体进而产生神经毒性作用: (1)NMDA受体亚基表达量改变[4]; (2)NMDA受体亚基磷酸化状态及信号转导通路变化[7]; (3)NMDA受体亚基在突触上和突触外的分布发生改变[19]。
2 NMDA受体在吸入麻醉药神经毒性中的作用
2.1 七氟醚
七氟醚是小儿手术麻醉诱导及全身麻醉维持中最常用的吸入麻醉药。 Zhang 等[4]研究发现6日龄小鼠连续3 d暴露于2.1%七氟醚, 成年后Y迷宫实验显示小鼠学习、 记忆能力下降, 同时发现小鼠前额皮层(prefrontal cortex, PFC)中NMDA受体 NR1和 NR2B表达增高以及 NR2A 表达降低, 而海马区NMDA受体表达未受明显影响, 表明七氟醚引起发育神经毒性与 PFC部位NMDA受体亚基表达变化有关。 Wang等[19]研究发现7日龄小鼠暴露于七氟醚(3%, 6 h)后, NR2A表达受到明显抑制, 而 NR2B表达增加。 神经元细胞暴露于Bic(bicuculline, GABA受体阻滞剂)/4-AP(4-aminopyridine, 弱钾通道阻滞剂)上时, 突触上NMDA受体可被激活, 继而减弱七氟醚产生的神经毒性作用, 但PEAQX(NR2A功能抑制剂)可以消除此效应, 而Ifenprodil(NR2B 功能抑制剂)则不会, 提示激活突触上NR2A可减轻七氟醚引起的发育神经毒性; 进一步研究发现, 在阻断突触上 NMDA受体的前提下, 给予 Ifenprodil也可以改善七氟醚诱导的神经细胞凋亡, 而 PEAQX 无该作用, 表明抑制突触外 NR2B也可减轻七氟醚引起的发育神经毒性。 Tian 等[7]在老年鼠研究中将17月龄大鼠连续3 d暴露于七氟醚(3%, 3 h), 发现七氟醚可显著降低非受体型蛋白酪氨酸激酶(Fyn)介导的NR2B的磷酸化, 并在水迷宫(Morris water maze, MWM)实验中发现其空间学习记忆功能缺陷, 表明NR2B功能异常参与了七氟醚引起的神经毒性。 NMDA受体介导七氟醚神经毒性作用的研究尚局限于动物模型中, 其在人体中的具体作用需进一步研究。
2.2 异氟醚
异氟醚是临床常用的吸入麻醉药之一。 Liu 等[5]将7日龄小鼠连续3 d暴露于异氟醚(1.5%, 2 h)发现其可引起海马NR2B表达水平下降, 导致小鼠海马神经元损伤和学习记忆能力下降, 提示异氟醚可通过影响NMDA受体亚基表达水平而产生神经毒性作用。 细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)是NMDA受体下游细胞信号激酶, 其磷酸化激活状态参与细胞内多种生物学反应, 对长期记忆形成和突触可塑性至关重要[20]。 Liu等[21]将成年雄性小鼠(8周龄)暴露于不同浓度及不同时间的异氟醚, 发现2 h内低浓度(0.5 MAC)的异氟醚可诱导海马NR2B表达水平、 磷酸化ERK1/2(p-ERK1/2)与总ERK1/2的比值上升, 对神经细胞和小鼠认知功能产生保护作用; 而高浓度(1.0 MAC)的异氟醚超过4 h可导致NR2B表达水平、 p-ERK1/2与总ERK1/2的比值下降, 产生神经毒性作用和小鼠认知功能下降。 结果表明, 异氟醚对空间学习和记忆的影响具有浓度依赖性和时间依赖性, 提示临床使用异氟醚时应控制给药浓度和时间以减轻可能出现的并发症。
2.3 氧化亚氮(N2O)
N2O是一种具有较强镇痛作用的吸入麻醉药, 常与其他麻醉药复合应用于全身麻醉。 Mawhinney等[22]将344只3月龄和18月龄Fischer鼠随机分为2组, 一组给予1.8%异氟醚/70% N2O, 另一组给予O2作为对照组。 3个月后, 水迷宫实验显示仅18月龄大鼠表现出空间学习障碍, Western blot检测发现海马和皮层中NMDA受体亚基NR2B表达水平增加、 p-ERK1/2与总ERK1/2的比值显著下降, 表明异氟醚/N2O可通过改变NMDA受体亚基表达及影响NMDA受体介导的信号通路而导致老年鼠空间学习障碍。 有关N2O是否可产生发育神经毒性尚不明确, 需进一步研究。
3 NMDA受体在静脉麻醉药神经毒性中的作用
3.1 氯胺酮
氯胺酮是一种具有确切镇痛作用的静脉麻醉药。 作为NMDA受体非竞争性拮抗剂, 氯胺酮主要通过阻断NMDA受体而发挥全身麻醉作用。 Ren等[23]对妊娠大鼠连续5 d给予氯胺酮, 通过多项行为测试发现胚胎期给予氯胺酮可引起子代成年期(8周龄)焦虑样行为。 在敲除子代鼠海马区NR2B亚基基因后, 8周龄时的焦虑样行为将明显缓解, 提示氯胺酮可通过影响NMDA受体亚基表达水平而产生神经毒性作用。 Elsamadicy等[24]在临床研究方面发现, 接受氯胺酮麻醉的脊柱手术患者术后谵妄发生率显著高于未接受氯胺酮麻醉的患者, 多元Logistic回归分析结果表明术中使用氯胺酮是患者术后谵妄发生率增高的独立危险因素。 Plyler等[25]2019年发表一项观察性研究, 发现麻醉维持期持续泵注2 μg/(kg·min)氯胺酮的老年脊柱手术患者与维持期持续泵注4 μg/(kg·min)氯胺酮的患者相比(诱导期均接受0.5 mg/kg氯胺酮), 术后谵妄发生率明显降低, 提示氯胺酮与术后谵妄之间可能存在剂量依赖性。
3.2 丙泊酚
丙泊酚是一种快速、 短效静脉麻醉药, 苏醒迅速而完全, 广泛用于全身麻醉诱导与维持。 Emik等[26]对成年雌鼠腹腔注射丙泊酚, 通过多种行为学实验发现, 麻醉后出现认知功能受损; 在丙泊酚麻醉前腹腔注射美金刚, 发现美金刚可缩短麻醉恢复时间、 改善认知功能, 提示丙泊酚可通过激动NMDA受体而产生神经毒性。 Chen 等[27]对妊娠 14 d的大鼠腹腔注射丙泊酚, 5 h后剖宫产, 发现胚胎大脑外侧神经节隆起组织caspase-3增多; 培养至妊娠21 d剖宫产, 发现胚胎大脑神经细胞增殖减少; 出生后第25天进行行为学实验, 发现子代大鼠青春期出现空间认知和学习功能障碍; 出生后30 d发现海马CA1和CA3锥体神经元树突分支减少和树突长度缩短, 以及海马NR2A、 NR2B、 NR1等亚基表达水平降低, 提示丙泊酚可通过下调发育期大脑海马经细胞NMDA受体不同亚基的表达, 产生神经毒性。 Wang等[28]对6日龄小鼠连续6 d腹腔注射丙泊酚, 发现28日龄时小鼠海马细胞质内NR2B蛋白表达增加, 而细胞质外NR2B蛋白无明显变化; 同时海马细胞质内外 NR2B亚型Ser1303/1480残基位点的磷酸化水平增加, 海马NR2B膜易位(蛋白质在细胞膜内外位置的改变)下降; 水迷宫实验显示青春期小鼠(28日龄)出现空间记忆缺陷, 表明新生鼠长时间暴露于丙泊酚可能通过增加NR2B的磷酸化水平, 下调海马NR2B亚基膜易位, 产生神经毒性。 由此可见, 丙泊酚产生发育神经毒性的机制可能随模型不同而不同, NMDA受体在其中的具体分子机制尚待深入研究。
4 展望
全身麻醉药通过NMDA受体产生神经毒性在动物实验上已经得到证实, 但由于人体接受全身麻醉时往往需要复合用药, 且存在手术创伤、 并存疾病等影响, 目前基础研究模型与临床实际情况尚存在较大距离, 今后应完善动物实验设计使其更贴近实际临床麻醉, 使结论更具说服力和参考价值。 在以NMDA受体为靶点的神经毒性防治研究中, 虽然小样本临床研究提示美金刚可降低心脏手术患者术后PND发生率[29], 但仍需多中心、 大样本、 随机对照研究验证。 此外, 突触内外NMDA受体的空间分布影响NMDA受体的功能, 尤其是突触外NMDA受体的过度激活可能参与了神经退行性疾病[如阿尔茨海默病(Alzheimer’s disease, AD)]的发生发展[30-32]。 研究表明[33], β淀粉样蛋白(amyloid-beta, Aβ)可通过下调突触上NMDA受体(主要为NR2B), 或增强突触外NR2B的激活而产生神经毒性。 而美金刚通过拮抗突触外NR2B, 低剂量的NMDA通过阻断突触上NMDA受体可减轻Aβ导致的神经毒性。 鉴于全身麻醉药神经毒性与AD发病机制之间有许多共同之处[34]。 因此, 药物调控NMDA受体亚基空间分布能否减轻全身麻醉药神经毒性将会成为未来的研究方向之一。

