LncRNA WDR86-AS1调节 FOXO3a对滋养细胞增殖和侵袭能力的影响
张展, 黄晨曦, 王萍, 刘灵
(1.郑州大学 第三附属医院 检验科, 河南 郑州 450052; 2.郑州大学 第三附属医院 产前诊断中心, 河南 郑州 450052)
子痫前期(preeclampsia,PE)是妊娠特发性综合征,以妊娠20周新发高血压 (≥140/90 mmHg)和蛋白尿(≥300 mg/24 h)为主要特征,目前世界的发病率为3%~5%,是造成胎儿和产妇发病和死亡的主要原因,但其具体发病机制仍未知[1].研究表明滋养细胞增殖能力降低和侵袭能力不足可能是引起子痫前期发病的重要原因[2].长链非编码RNA(long non-coding RNAs, LncRNA)是一种长度超过200 bp的非编码RNA,因为其不编码蛋白质,一直被认为是基因组转录的“噪音”[3],但是近年来随着高通量测序和生物信息学技术的发展,越来越多的LncRNA及其与疾病的关系被大家认知.胎盘组织的研究发现LncRNA可能与子痫前期的发病相关[4].有研究表明LncRNAWDR86-AS1在PE胎盘组织中表达升高.叉头框转录因子3a(forkhead box protein o 3a,FOXO3a)是叉头框蛋白O家族的成员之一,这个家族包含4个成员:FOXO1、FOXO4、FOXO3a和FOXO6,其中以FOXO3a的分布和功能最为广泛[5].FOXO3a主要调节细胞增殖、凋亡、 细胞周期、氧化应激和免疫应答等多方面功能[6].本研究选择PE孕妇和健康孕妇的胎盘组织进行验证,探究LncRNAWDR86-AS1调节FOXO3a对滋养细胞功能影响,以及可能参与子痫前期发病的机制.
1 资料与方法
1.1 材料
1.1.1 材料
选择在郑州大学第三附属医院分娩的子痫前期(PE)孕妇和健康孕妇的胎盘组织各25例,分为PE组和对照组.PE的诊断标准依据文献[7],排除多胎妊娠,妊娠糖尿病,慢性高血压,慢性肾脏疾病等妊娠合并症.研究经郑州大学第三附属医院伦理委员会批准,患者均知情同意.
1.1.2 试剂
人早孕绒毛外滋养细胞HTR8/SVneo购自美国ATCC公司,DMEM高糖培养基购自HyClone公司,胎牛血清购自杭州四季青公司,胰酶购自Gibco公司.TRIzol Reagent、UItraSYBR Mixture和组织裂解液购自康为世纪,ReverTra Ace qPCR-RT kit 购自日本东洋纺公司.CCK-8购自日本同仁.Lipo3000TMreagent 购自Invitrogen公司,LncRNAWDR86-AS1 和FOXO3asiRNA购自广州锐博公司.兔抗人FOXO3a单克隆抗体购自CST公司,兔抗人GAPDH单克隆抗体购自Abcam公司,HRP标记的山羊抗兔IgG购自鼎国公司.
1.2 方法
1.2.1 标本收集
胎盘娩出后15 min内从胎盘的母体面收集胎盘组织(1 cm3),排除梗死、出血和钙化区域,将取出的组织块用生理盐水冲洗并用滤纸吸去表面血液,一部分用体积分数为10%的甲醛脱水后用石蜡包埋,储存用于免疫组化研究;一部分储存在-80 ℃冰箱内用于RNA和蛋白的提取.
1.2.2 免疫组化
胎盘组织蜡块切成4 μm的薄片固定在载玻片上,将切片在二甲苯中脱蜡,分级乙醇中水化.然后浸入柠檬酸抗原修复液中在微波炉中处理15 min,进行抗原修复,用体积分数为3% H2O2,37 ℃ 孵育15 min以抑制内源性过氧化物酶活性.滴加质量分数为10%的山羊血清封闭液在室温孵育30 min.用兔抗人FOXO3a单克隆抗体(V一抗原液∶V一抗稀释液=1∶800) 4 ℃孵育过夜.阴性对照按照相同方法用磷酸盐缓冲盐水(PBS)处理2 h.然后用二抗(V二抗原液∶V二抗稀释液=1∶2 000,SP-9001,OriGene Technologies)孵育1 h.使用3,3′-二氨基联苯胺四盐酸盐底物试剂盒(ZSGB-BIO)显色,用苏木素,复染2 min.结果判断采用半定量积分法,在细胞密集的区域内随机选取5个高倍镜视野,计数100个细胞.计算出阳性染色细胞的百分数进行评分,阳性细胞百分数为小于5%、5%~25%、26%~50%、51%~75%、大于75%分别记为0、1、2、3、4分;染色强度的评分:无着色、浅棕黄色、棕黄色、棕褐色分别记为0、1、2、3分.免疫组化积分是细胞阳性率评分与染色强度评分相乘之积.
1.2.3 细胞培养和LncRNAWDR86-AS1和FOXO3asiRNA转染
将HTR8/SVneo细胞置于含有质量分数为10%胎牛血清的培养基中,并在37 ℃体积分数为5% CO2的培养箱中培养,当细胞融合达90%用胰酶进行传代.在6孔板中铺细胞1×105/孔,分为siNC组和siWD组,当细胞融合达60%时,使用Lipo3000TM将阴性对照(nonsense control,NC)和LncRNAWDR86-AS1siRNA转染入HTR8/SVneo细胞中,培养24 h用于后续实验;在6孔板中铺细胞1×105/孔,分为siNC组和siFOXO3a组,同样的方法将NC和FOXO3asiRNA转染入HTR8/SVneo细胞中,培养24 h用于后续实验.
1.2.4 Quantitative RT-PCR检测
用TRIzol Reagent提取组织和细胞的总RNA,并用ReverTra Ace qPCR-RT kit在37 ℃ 15 min, 50 ℃ 5 min 和98 ℃ 5 min下逆转录为cDNA.使用UItraSYBR Mixture在StepOnePlusTMReal-Time PCR System上进行PCR的扩增,扩增的条件:95 ℃ 10 min, 95 ℃ 15 s,65 ℃ 1 min 共40个循环.引物序列:LncRNAWDR86-AS1上游:5′-ACCGCTGACCTTACCTACTTCCTC-3′,下游:5′-AGGCTTCCGTCCTCAGTTCCAG-3′;FOXO3a上游:5′-GGTGCTAAGCAGGCCTCATCTC-3′,下游: 5′-AATGGCGTGGGATTCACAAAG-3′; GAPDH上游: 5′-AGAACGGGAAGCTTGTCATC-3′,下游:5′-CATCGCCCCACTTGATTTTG-3′.以GAPDH为内参,用2-ΔΔCT来计算LncRNAWDR86-AS1和FOXO3amRNA的相对表达量.
1.2.5 Western blot检测
用V组织裂解液∶V蛋白酶抑制剂=100∶1提取胎盘组织和细胞的总蛋白,BCA法进行蛋白定量,配置质量分数为8%的分离胶和质量分数为5%的浓缩胶,每孔加入40 μg蛋白进行电泳.电泳后湿转至PVDF膜上,膜在质量分数为5%脱脂奶粉封闭2 h后,在4 ℃冰箱孵育过夜, 一抗与二抗原液均使用含有质量分数为5%脱脂奶粉的TBST溶液稀释,V一抗原液∶VTBST溶液=1∶1 000.室温复温1 h,TBST洗3×10 min,然后室温孵育1 h,V二抗原液∶VTBST溶液=1∶10 000,TBST洗3×15 min后ECL化学发光法显色.用Image J软件分析条带灰度值,计算FOXO3a蛋白的相对表达.
1.2.6 CCK-8检测
用NC和LncRNAWDR86-AS1或FOXO3asiRNA转染HTR8/SVneo细胞,转染24 h后,按每孔5×103个铺于96孔板中,每组设5个重复,在含有质量分数为10%胎牛血清的DMEM高糖培养基中分别培养24、48、72 h,每孔加入10 μL CCK-8继续培养1 h,检测细胞活力.
1.2.7 Transwell分析
Transwell 小室铺胶,细胞转染24 h后消化制成无血清细胞悬液(2.5×108/L),上室加200 μL的细胞悬液,下室加750 μL含质量分数为20%的胎牛血清的培养基,在37 ℃,体积分数为5% CO2培养箱培养48 h,用棉签擦除上室的细胞和基质胶,PBS洗3遍,体积分数为4 %多聚甲醛固定15 min,质量分数为0.1%结晶紫染色10 min后拍照,高倍镜下随机取3个视野计数,取平均值,实验独立重复3次.
1.3 统计学分析
实验数据均使用GraphPad Prism 6.0软件进行统计分析.计量资料均采用(均数±标准差)表示,两组定量资料使用t检验,相关性采用Spearman相关分析,以P<0.05为有统计学差异.
2 结果
2.1 对照组和PE组临床资料比较
对照组和PE组在分娩年龄上无统计学意义,但是PE组在孕周、收缩压、舒张压和蛋白尿含量方面均高于对照组,有统计学差异(P<0.05),在孕周和新生儿体质量低于对照组,有统计学差异(P<0.05,表1).


组别分娩年龄/岁孕周/周收缩压/mmHg舒张压/mmHg24 h蛋白尿/g新生儿体质量/g对照组31.92±4.6938.50±0.50113.64±7.1372.36±8.610.09±0.033552.4±346.01PE组32.28±4.0732.00±1.67162.68±14.56103.20±10.074.92±2.791447.2±389.78P值0.780.001)0.001)0.001)0.001)0.001)
1)与对照组相比较,P<0.001.
1)Compared with the control group,P<0.001
2.2 LncRNA WDR86-AS1、FOXO3a mRNA及FOXO3a蛋白在对照组和PE组中表达
PE组中LncRNAWDR86-AS1、FOXO3amRNA和FOXO3a蛋白表达均高于对照组,有统计学差异(P<0.05,表2,图1).
表2 LncRNAWDR86-AS1、FOXO3amRNA和FOXO3a蛋白在胎盘组织中的表达


组别nLncRNA WDR86-AS1FOXO3a mRNAFOXO3a 蛋白对照组250.30±0.180.89±0.290.35±0.08PE组251.71±0.961)1.66±0.891)1.07±0.051)
1)与对照组相比较,P<0.05.
1)Compared with the control group,P<0.05
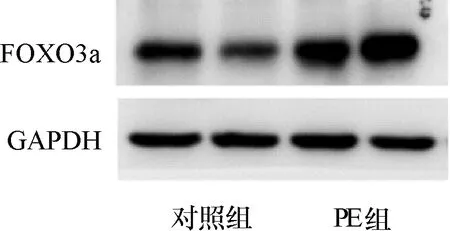
图1 FOXO3a蛋白在对照组和PE组胎盘组织中表达
2.3 FOXO3a在对照组和PE组中的表达及分布及LncRNA WDR86-AS1和FOXO3a 在PE组中表达的相关性
FOXO3a在PE组滋养细胞的胞质和胞核中均有表达,且PE组表达(4.72±2.41)高于对照组(1.40±1.08),有统计学差异(t=-6.29,P<0.05,图2A).LncRNA WDR86-AS1和FOXO3a 在PE组中表达呈正相关(r=0.54,P<0.05,图2B).

图2A FOXO3a在对照组和PE组胎盘组织中的表达(×200)
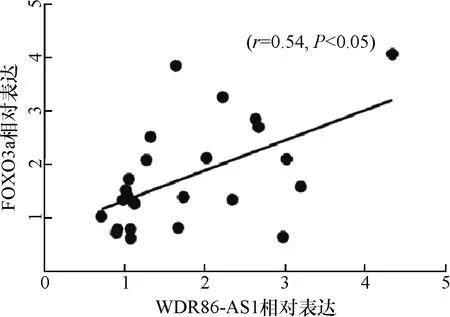
图2B PE组织中WDR86-AS1与FOXO3a表达的相关性
Fig.2B The correlation of expression between WDR86-AS1 and FOXO3a in preeclampsia placental tissue
2.4 转染LncRNA WDR86-AS1 siRNA 后, LncRNA WDR86-AS1、FOXO3a mRNA和FOXO3a蛋白在siNC组和siWD组中的表达
siWD组LncRNAWDR86-AS1、FOXO3amRNA和FOXO3a蛋白表达均低于siNC组,有统计学差异(P<0.05,表3和图3).
表3 LncRNAWDR86-AS1、FOXO3amRNA和FOXO3a蛋白在siNC组与siWD组表达


组别LncRNA WDR86-AS1FOXO3a mRNAFOXO3a 蛋白siNC组1.02±0.231.01±0.211.58±0.07siWD组0.15±0.051)0.35±0.031)0.43±0.061)
1)与siNC组相比较,P<0.05.
1)Compared with the siNC group,P<0.05.

图3 FOXO3a蛋白在siNC组与sIWD组细胞中表达
2.5 转染LncRNA WDR86-AS1 siRNA 后,siNC组和siWD 组细胞的增殖活力和侵袭能力比较
HTR8/SVneo细胞转染siRNA 0、24、48、72 h后发现,转染24、48 h siWD组细胞增殖活力高于siNC组,有统计学差异(P<0.05,表4),转染0、72 h两组细胞增殖活力无统计学差异(表4).siWD组(77.4±10.24)侵袭细胞数目高于siNC组(45.8±6.22),有统计学差异(P<0.05,图4).
2.6 转染FOXO3a siRNA后, FOXO3a mRNA和蛋白在siNC组和siFOXO3a组中的表达
siFOXO3a组FOXO3amRNA(0.20±0.04)表达低于siNC组(0.96±0.13),有统计学差异(P<0.05);siFOXO3a组(1.47±0.12)FOXO3a蛋白表达低于siNC组(0.08±0.04),有统计学差异(P<0.05,图5).
表4 转染LncRNAWDR86-AS1siRNA 0、24、48、72 h细胞增殖活力比较


组别0 h24 h48 h72 hsiNC0.48±0.070.71±0.060.99±0.101.14±0.05siWD0.46±0.090.90±0.121)1.22±0.101)1.24±0.07
1)与siNC组相比较,P<0.05.
1)Compared with the siNC group,P<0.05.

图4 滋养细胞在siNC组与sIWD组侵装能力的比较(×200)
Fig.4 Comparison of trophoblastic invasion in siNC and siWD groups(×200)

图5 FOXO3a蛋白在siNC组与siFOXO3a组细胞中表达
2.7 转染FOXO3a siRNA 后,siNC组和siFOXO3a 组细胞的增殖活力和侵袭能力比较
HTR8/SVneo细胞转染FOXO3asiRNA 0、24、48和72 h后发现,转染24、48 h siFOXO3a组细胞增殖活力高于siNC组,有统计学差异(P<0.05,表5),转染0、72 h两组细胞增殖活力无统计学差异 (表5).siFOXO3a组(65.8±13.42)侵袭细胞数目高于siNC组(41.4±7.1),有统计学差异(P<0.05,图6).
表5 转染siRNA 0,24,48,72 h细胞增殖活力比较


组别0 h24 h48 h72 hsiNC组0.37±0.080.69±0.100.93±0.171.11±0.12siFOXO3a组0.41±0.090.89±0.171)1.09±0.131)1.21±0.11
1)与siNC组相比较,P<0.05.
1)Compared with the siNC group,P<0.05.
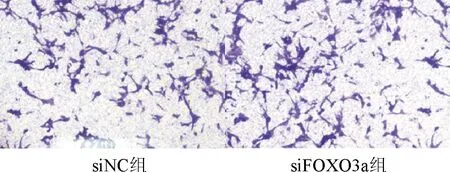
图6 滋养细胞在siNC组与siWD组侵袭能力的比较(×200)
Fig.6 Comparison of trophoblastic invasion in siNC and siFOXO3a group(×200)
3 讨论
在正常妊娠中原始细胞滋养细胞逐渐分化为绒毛外滋养细胞,该细胞进行增殖和侵袭促进螺旋动脉重塑,因此绒毛外滋养细胞的增殖和侵袭能力对胎盘的发育至关重要[8].研究发现滋养细胞增殖活力降低,侵袭不足等功能异常,引起的子宫螺旋动脉重铸不足,胎盘浅着床,可能是子痫前期发病的主要原因[9].因此本研究选择人早孕绒毛外滋养细胞系HTR-8/SVneo细胞,该细胞系是进行滋养细胞增殖、侵袭能力研究的常用细胞.
LncRNA是长度大于200个核苷酸的非编码RNA,可以在转录和转录后水平、翻译水平、蛋白质的结构和细胞间相互作用等方面影响细胞增殖、侵袭、凋亡等多种生物学功能[10-12].越来越多的研究表明LncRNA与疾病的发生发展相关,例如癌症[13]、神经精神疾病[14]、肾脏疾病[15]等.对PE胎盘组织的研究中也发现许多异常表达的LncRNA,且在细胞水平上改变LncRNA的表达可影响细胞的增殖、迁移和侵袭等功能,LncRNACRNDE在PE胎盘组织中下调,可通过调节miR-1277表达影响滋养细胞的增殖、侵袭和迁移[16];LncRNATUG1在PE胎盘组织中下调,通过靶向调节miR-29b影响滋养细胞的增殖、凋亡、侵袭[17];LncRNATCL6在PE胎盘组织中上调,过度表达LncRNA TCL6可通过靶向调节PTEN抑制滋养层细胞的增殖[18].本研究中,在PE胎盘组织中发现LncRNAWDR86-AS1表达升高,与Li等[19]的研究一致.
FOXO3a是一个核转录因子,可与核输出蛋白 14-3-3结合,由胞核转移到胞质,抑制FOX03a的转录活性;此外还可通过隐藏核定位信号阻止其再次入核,进一步抑制FOXO3a的转录活性[20].FOXO3a可接收多个上游信号参与细胞信号通路,通过这种核穿梭机制实现失活和激活,影响细胞凋亡、增殖和DNA损伤等多方面能力[21].研究发现多种LncRNA可以通过调节FOXO3a表达,影响细胞的增殖、侵袭和凋亡等生物学功能,进而可能参与疾病的发展[22-24].目前FOXO3a在胎盘组织中的研究较少,主要发现FOXO3a在引产和流产病人的蜕膜组织和胎盘组织中表达升高[25],本研究结果显示在PE胎盘组织中FOXO3a的表达升高,但其表达与FOXO3a的关系尚未可知.通过对PE胎盘组织中LncRNAWDR86-AS1、FOXO3a表达进行相关性分析,发现二者表达呈正相关.在HTR-8/SVneo细胞中沉默LncRNAWDR86-AS1,细胞的增殖和侵袭能力增加,与Li等[19]的研究一致,但发现沉默LncRNAWDR86-AS1,FOXO3a的表达随之降低,因此在滋养细胞中LncRNAWDR86-AS1可调节FOXO3a的表达.在HTR-8/SVneo细胞中沉默FOXO3a,细胞的增殖和侵袭能力增加,因此LncRNAWDR86-AS1可通过调节FOXO3a的表达影响滋养细胞的增殖和侵袭能力.在PE胎盘组织中LncRNAWDR86-AS1和FOXO3a的表达升高,可能影响了滋养细胞增殖侵袭能力、参与疾病的发展.
综上所述,LncRNAWDR86-AS1可以调节FOXO3a的表达影响滋养细胞的增殖和侵袭能力,可能参与PE的发生发展.但是LncRNAWDR86-AS1调节FOXO3a的具体机制仍不清楚,将进一步探索.

