双氢青蒿素和达沙替尼联合用药对肝癌HepG2细胞的抑制作用
安姿旖, 周兆, 刘革修
(暨南大学 血液研究所, 广东 广州 510010)
肝癌是世界上最常见的第5大恶性肿瘤,并在肿瘤相关死因中排位第2[1],而肝细胞肝癌(hepatocellular,HCC)是最常见的类型,比例高达90%[2].由于大部分患者确诊时已为晚期肝癌[3],使得姑息化疗成为目前主要的治疗手段之一.由于晚期肝癌患者的肝功能受损和常规化疗药物的非选择细胞毒性,限制化疗药物的使用剂量和疗程;另外由于肝癌细胞自身及所处肿瘤微环境形成的复杂,使化疗药物常常效果不佳,且容易发生化疗耐药.因此,迫切需要寻找新的治疗方法应对晚期肝癌.
双氢青蒿素(dihydroartemisinin,DHA)是青蒿素的衍生物,分子式C12H24O5[4],相对分子量为284.35,具有水溶性强、易吸收、代谢迅速、毒副作用弱等优势,尤其是其口服生物利用度是青蒿素的10倍以上,抗疟作用是青蒿素的4~8倍[5].研究证明,双氢青蒿素不仅可以治疗疟疾,还可以抑制肿瘤细胞的生长[6-7],增强肿瘤细胞的化疗敏感性[8],逆转耐药[9].已有研究表明DHA可诱导肝癌细胞凋亡[7, 10-11].
达沙替尼(dasatinib,Das)是一种高效、具有ATP竞争的口服双Src/Abl激酶抑制剂,具有抗多种肿瘤增殖活性的作用.目前,达沙替尼被批准用于治疗耐药或者不耐受伊马替尼的慢性髓系白血病患者[12].c-Src作为一种受体络氨酸激酶,是Src激酶家族中的一员,在肝细胞癌中高表达.选用强有力的络氨酸激酶抑制剂Das, 可抑制多种肝癌细胞的生长[13],由于HCC细胞株亚群类别不同,对Das的药物敏感性不同,其中HepG2属于低敏感性细胞株,因此,本研究创新性提出将DHA与Das联合用药,探究DHA能否增强HepG2对Das的敏感性,让两种药物在较低剂量联合用药时达到协同作用,从而对肝癌细胞系HepG2产生显著的抑制,同时探索二者单独及协同用药时的分子机制,为临床治疗晚期HCC患者提供了一种新的方案.
1 材料和方法
1.1 材料
1.1.1 细胞株
人肝癌细胞HepG2购自中国科学院细胞中心,置于DMEM高糖配方培养基中(含质量分数为10%的胎牛血清),37 ℃,体积分数为5% CO2培养箱内培养,取对数期生长的细胞进行实验,并根据实验的需求进行分组.
1.1.2 药物与主要试剂
DHA购于普菲德,货号D3793;Das购于Apexbio公司,货号IR-53351;结晶紫、草酸铵购于天津大茂化学试剂厂;CCK8试剂盒购于Dojindo公司;吖啶橙/溴化乙锭(AO/EB)购于碧云天公司;线粒体膜电位检测试剂盒(JC-1)、Annexin V-FITC/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒购买于凯基公司;c-Myc、cyclin E1、E2F1、GAPDH,Bim、Bcl-2、Cleaved-Caspase 9、β-actin、PARP、Cleaved-PARP和Nrf2抗体购买于Cell Signaling Technology 公司.
1.2 方法
1.2.1 CCK-8 检测药物对HepG2细胞的活力的影响
取对数期生长的HepG2细胞以5 000/孔的密度接种于96孔板中,培养过夜使细胞贴壁,根据实验分组加入DHA,Das,培养24 h,然后丢弃旧培养液,每孔加入100 μL培养液和10 μL CCK8试剂,37 ℃孵育3 h,用酶标仪检测在450 nm波长处的光密度(OD)值.
1.2.2 平板克隆集落形成实验
取对数期生长的HepG2细胞分别以400/孔、600/孔和800/孔的密度接种于6孔板中,总体积为2000 μL,每个组设置4个复孔.培养6 d后换液并分别加入规定浓度的药物,再培养4 d,弃上清,用PBS洗两遍,加甲醇固定,然后用质量分数为0.1%结晶紫染液染色20 min,弃染液并再次用PBS洗2遍,干燥后拍照.
1.2.3 流式细胞技术检测细胞周期
取对数期生长的HepG2细胞,以105/孔的密度接种于6孔板中,置于培养箱中贴壁24 h,再加入药物应用48 h,收集细胞并用PBS洗2遍,用体积分数为70%乙醇4 ℃过夜固定细胞,PBS洗涤、离心,加入含有质量分数0.1% RNase的PBS 100 μL,37 ℃水浴30 min,加入500 μL的 PI染液孵育30 min,用流式细胞仪检测.
1.2.4 形态学观察和AO/EB染色法检测细胞凋亡
细胞应用同上,在倒置显微镜下观察药物应用48 h后,细胞的数目和形态的变化,然后收集细胞,离心去上清,用PBS洗两次,加入AO/EB染液500 μL混合均匀,将细胞涂片,用荧光显微镜进行观察拍照.
1.2.5 Annexin V-PI法检测细胞凋亡
分别收集药物应用24 h和48 h的细胞,弃上清,用PBS洗2遍,加400 μL结合缓冲液重悬细胞,分别加入5 μL异硫氰酸荧光素(FITC)标记的 Annexin V和5 μL PI充分混匀,避光室温孵育15 min,即刻用流式细胞仪进行分析.
1.2.6 检测细胞中活性氧(reactive oxygen system, ROS)水平
收集药物应用48 h的细胞,用PBS洗3遍,接着用500 μL DHE重悬细胞,于培养箱中避光孵育20 min后,离心弃上清,加300 μL预冷的PBS重悬细胞,用流式细胞仪检测.
1.2.7 JC-1染色流检测线粒体膜电位变化
药物作用36 h后,收集细胞,用PBS洗3遍,加入500 μL JC-1染色工作液,重悬细胞吹打均匀,避光37 ℃孵育20 min,离心弃上清,加400 μL的缓冲液,即刻在流式细胞仪上检测线粒体膜电位的下降比例.
1.2.8 Western blotting 检测蛋白水平的表达
药物应用细胞48 h,收集细胞,经120 μL的RIPA蛋白裂解液冰上裂解30 min,4 ℃, 12,000 r/min,离心10 min,收集上清.BCA法进行蛋白定量,取25 μg蛋白样品进行常规电泳并转移到PVDF膜,置于质量分数为5%脱脂奶粉封闭液中封闭1 h,切割目标条带,加入一抗4 ℃过夜,TBST缓冲液清洗3次,加二抗室温孵育2 h,TBST洗膜3次,滴加化学发光显色液在凝胶成像系统曝光显影,使用Image J分析软件对蛋白条带的灰度值进行分析.
1.2.9 统计分析
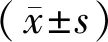
2 结果
2.1 DHA和Das联合应用显著抑制HepG2的细胞增殖
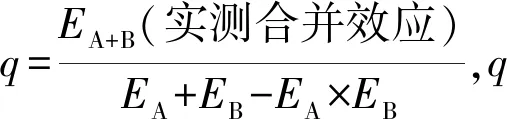
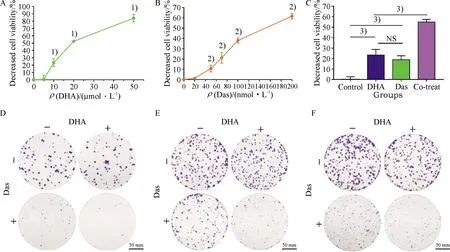
A:CCK8法检测DHA对HepG2细胞毒性,1)与DHA浓度为0 μmol/L组比较P<0.001;B: CCK8法检测Das对HepG2细胞毒性,2)与Das浓度为0 nmol/L组比较P<0.001;C:CCK8法检测DHA(10 μmol/L)和Das(70 nmol/L)联合应用对HepG2细胞毒性,组间比较NS为差异无统计学意义,3)P<0.001;D-F:克隆形成实验,DHA和Das单独及联合应用对HepG2集落(400,600,800/孔)形成的影响(标尺=50 mm)
A: HepG2 were cultured in medium with DHA and cell viability was measured by CCK-8 assay,1)P<0.001vs0 μmol/L DHA; B: HepG2 were cultured in medium with Das and cell viability was measured by CCK-8 assay, 2)P<0.001vs0 nmol/L Das; C: HepG2 were cultured in medium with Co-treatment of DHA(10 μmol/L) and Das(70 nmol/L ) and cell viability was measured by CCK-8 assay. 3)P<0.001,NS means no significance; D-F: Colony formation assay.Different density (400,600,800 per well) HepG2 cells were treated with the indicated groups(scale=50 mm).
图1 DHA和Das联合应用显著抑制HepG2的细胞增殖
Fig.1 Combination-treatment of DHA and Das significantly inhibited the proliferation of HepG2 cells
克隆形成实验结果显示,与对照组相比,DHA单独应用对3个接种不同密度细胞(400、600和800/孔)的克隆形成的抑制作用差异无统计学意义;Das单独应用可抑制HepG2克隆形成;DHA协同Das作用时对HepG2克隆形成显著抑制,以上结果说明, DHA可增加HepG2的化疗敏感性,DHA协同Das可明显抑制了HepG2细胞的增殖活性和克隆形成.
2.2 DHA和Das联合应用增强HepG2细胞周期阻滞
流式结果显示,与对照组相比,在G0/G1期, DHA单独应用组没有差异变化,Das单独应用出现了HepG2细胞的G1期阻滞,联合用药组的G1期的上升比例较Das单独应用组更为明显,由此可得,DHA和Das联合给药后HepG2肝癌细胞出现更加显著的G1期阻滞(图2A).
Western blot证明周期相关蛋白的变化,与对照组相比,DHA组和Das组分别单独作用细胞时c-Myc、Cyclin E1和E2F1蛋白的表达水平均有所下降,二者联合应用3个蛋白表达水平较单独应用组降低更为明显,结果提示DHA协同Das作用可显著下调周期和增殖蛋白c-Myc、Cyclin E1和E2F1的表达水平(图2B).
2.3 DHA和Das联合应用增强诱导HepG2细胞凋亡
细胞形态学实验结果显示,DHA和Das单独应用均造成HepG2细胞的形态学改变和抑制生长,二者联合应用时效果更为显著,表现为大部分贴壁细胞脱落,悬浮在培养基中.AO/EB染色结果显示,与对照组的细胞呈现出均匀的绿色相比较,DHA和Das单独应用组中,部分细胞呈现橙色或者红色,部分呈聚缩的亮绿色的核,提示DHA和Das单独应用可诱导HepG2凋亡,而两者联合应用时,显示出正常的绿色核更少,大部分表现出聚缩的橙色、红色的核和聚缩的亮绿色的核,提示HepG2的凋亡增加.由此可得DHA和 Das的联合用药促使HepG细胞凋亡增加(图3A,B).

A:流式细胞术检测周期,1)与对照组比较P<0.01,2)与联合应用组比较P<0.01;B:Western blot检测周期相关蛋白.
A: Flow cytometry and statistical analysis of cell cycle,1)P<0.01vsControl, 2)P<0.01vsCo-treat; B:Western blot analysis of G1/S transition-related proteins after indicated treatment.
图2 DHA和Das联合应用对HepG2细胞G1期阻滞
Fig.2 Combination-treatment of DHA and Das induces G1 arrest in HepG2 cells
流式细胞术结果显示,与对照组和单独应用组相比,DHA和Das联合应用组HepG2细胞的凋亡比例显著上升;应用24 h和应用48 h相比,随着药物联合作用时间的延长,细胞的凋亡率也不断增加.JC-1流式结果显示, DHA和Das单独应用均可降低HepG2细胞的ΔΨm,药物联合应用可使降低更加显著.以上结果提示DHA和 Das联合作用可增强通过由线粒体介导的HepG2细胞的凋亡(图3C,D).
Western blot结果显示,与对照组相比,DHA和Das单独作用HepG2细胞,上调促凋亡蛋白Bim, Cleaved-Caspase 9,Cleaved-PARP表达水平,下调抗凋亡蛋白Bcl-2以及DNA修复酶PARP表达水平,联合应用组可增强单独用药效果,使得促凋亡蛋白的表达水平显著增加,抗凋亡蛋白的表达水平显著减少.这些结果提示DHA协同Das作用可促使线粒体介导的凋亡途径的激活,抑制细胞增殖(图3E,F).
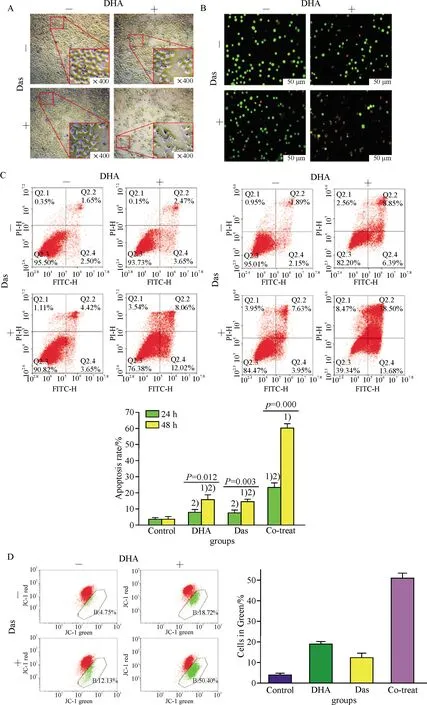
A-B:荧光显微镜及AO/EB染色检测药物对HepG2凋亡的形态学变化,A荧光显微镜(×400),B标尺=50 μm;C:流式细胞术检测药物对HepG2凋亡的作用,1)与对照组比较P<0.01,2)与联合应用组比较P<0.01;D:JC-1染色法检测线粒体膜电位
A-B: Morphological changes of apoptotic nuclei were observed by fluorescence microscopy and detected by AO/EB staining, scale, A:HE×400,B:scale=50 μm; C: Cell apoptosis induced by indicated groups was detected by flow cytometry, 1)P<0.01vsControl, 2)P<0.01vsCo-treat; D: Mitochondrial membrane potentials were measured using JC-1 staining and flow cytometry;
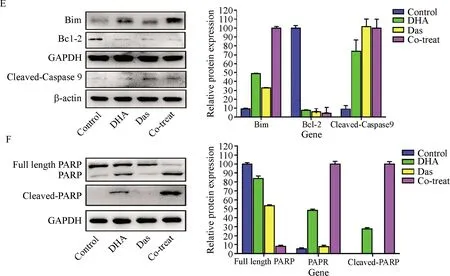
E-F: Western blot 检测凋亡相关蛋白表达.E-F: Western blot analysis of apoptosis-related proteins.
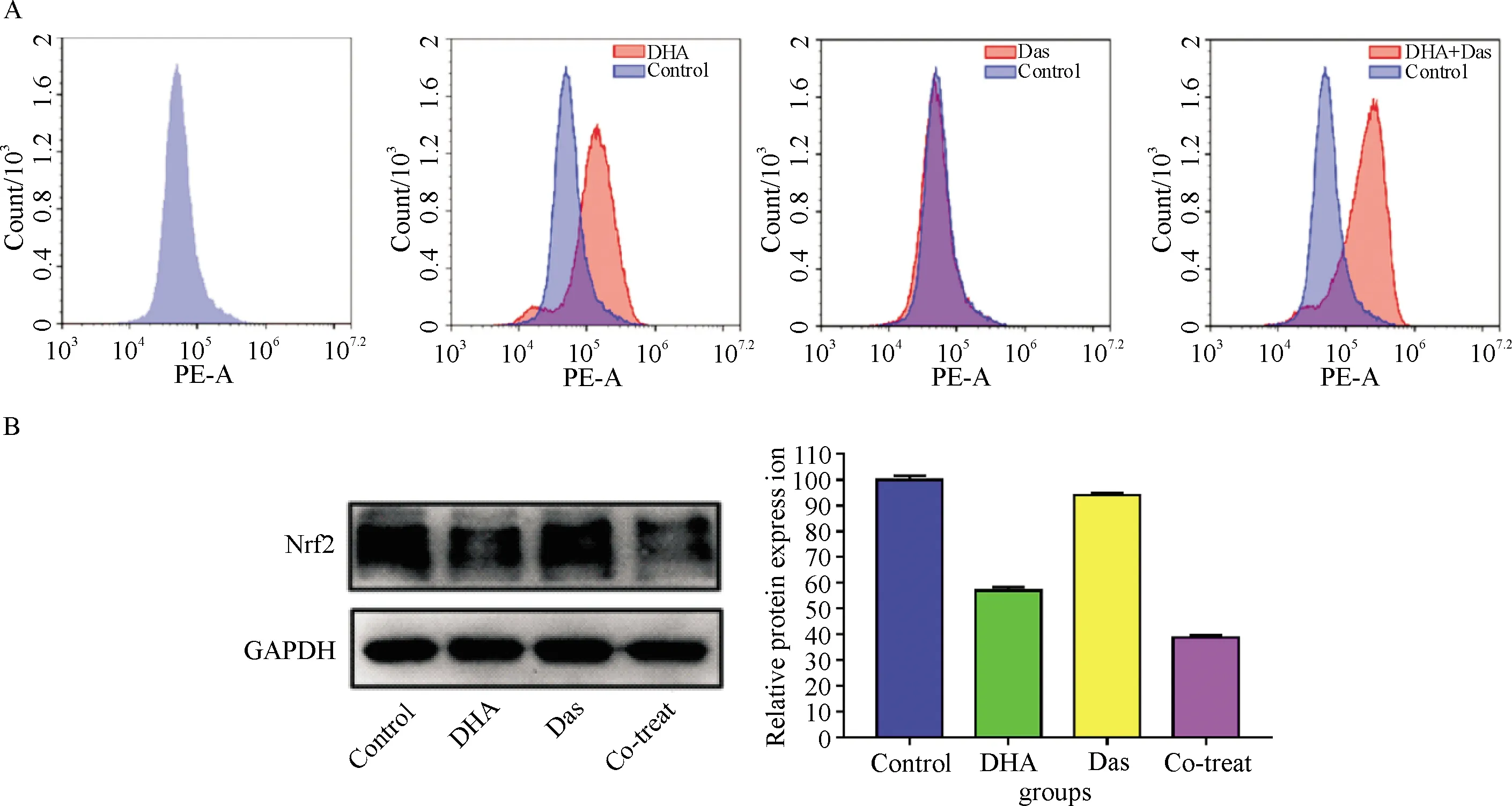
A:流式细胞技术检测药物应用时胞内超氧化物阴离子含量;B:Western blot 检测抗氧化蛋白.A: ROS levels induced by indicated groups was detected by flow cytometry; B: Western blot analysis of antioxidant proteins.
Fig.4 Treatment of HepG2 cells by DHA and Das alone or in combination increases the production of ROS and decreases the expression of related antioxidant proteins
2.4 DHA和Das单独及联合应用对HepG2细胞中ROS及抗氧化相关蛋白表达的影响
检测胞内ROS含量的流式结果显示,与对照组相比,DHA组胞内ROS含量增加,Das组的胞内ROS含量则无变化;联合应用组与DHA应用组比较,胞内ROS含量增加更为显著.以上结果说明,DHA通过促进胞内ROS的产生增加HepG2细胞对Das的敏感性.
Western blot结果显示,对照组、DHA和Das单独应用以及联合应用组比较,联合应用组的Nrf2(抗氧化蛋白)的表达量最低,提示DHA可通过增加胞内ROS含量,抑制Nrf2表达,增加HepG2对于Das敏感性,促进细胞凋亡.
3 讨论
肝细胞癌作为一种人类最常见的恶性肿瘤之一,其发病率和死亡率居高不下[15].由于其起病的隐匿性,难以早期诊断,多发展为晚期肝癌,使得化疗成为主要治疗手段之一,部分化疗药的出现,延缓了肝癌的进展,缓解了病情,但是肝癌化疗药物的耐药现象的出现严重限制了其治疗效果和应用[16].
DHA作为由青蒿素还原后得到的一种人工半合成衍生物,近些年在抗炎、免疫调节、抗癌等方面得到了广泛的关注,因为其副作用小,高效且有一定的特异性,所以在肿瘤治疗领域探索也越来越深入[4].研究发现,DHA能够增强肺腺癌细胞A549和SPC-A-1的对GEF(络氨酸激酶抑制药)药物的敏感性,DHA和GEF联合应用能够显著抑制细胞增殖、迁移和促使周期阻滞[17],在结肠癌细胞HCT116中,通过DHA和奥沙利铂的联合使用可显著提高对癌细胞的抑制率,促进DNA损伤,抑制肿瘤生长[18],DHA和阿霉素的联合应用也可以增强对乳腺癌细胞的抑制作用,为阿霉素治疗乳腺癌提供了一个有效的新方案[19].因此利用毒性较低的具备抗肿瘤活性的化合物,提高癌细胞对化疗药物的敏感性,从而减少化疗药物的用量,是一种提高抗肿瘤药物化疗作用而降低毒性的重要方法.
Das作为一种广谱的络氨酸激酶抑制剂,不仅可以作为临床慢性粒细胞白血病的常用化疗用药,而且越来越多的研究表明,Das可通过血液/肿瘤细胞的免疫调节对实体肿瘤进行生长调节[20-22],通过对不同的肝癌细胞株的研究发现,Das对于肝癌的细胞株的敏感性具有明显差异,为了进一步探究其作用机制,本研究选取Das低敏感性HepG2肝癌细胞,观察Das单独用药及与DHA联合用药对HepG2细胞的抑制作用,探究相关分子机制,为Das和DHA进入肝癌的临床治疗提供依据.
本研究证实了Das和DHA单独及联合使用对HepG2肝癌细胞活性均有抑制作用,且联合用药时对癌细胞的抑制率大于单独用药,根据金氏公式分析可得,联合用药药效为协同作用,并非单纯的相加结果.观察DHA和Das的联合使用对HepG2细胞的周期和凋亡发现,与单药组相比,联合用药组HepG2的细胞凋亡率和G0/G1期细胞比例显著提高,在细胞周期G1/S期的转变过程中扮演着重要角色周期相关蛋白c-Myc、Cyclin E1和E2F1,凋亡相关蛋白Bim、Bcl-2、cl-caspase9、cl-PARP和PARP也随之发生变化, 联合用药促使周期蛋白、Bcl-2和PARP表达量显著降低,Bim、cl-caspase9和cl-PARP表达量显著提升,线粒体膜电位也显著降低.以上结果提示,DHA协同Das可通过对HepG2的G1期阻滞,诱导线粒体相关凋亡通路,增强抑制癌细胞增长.ROS作为从氧气分子中产生的一组活性氧化剂分子和自由基,可引起DNA双链的断裂,诱导细胞周期的重新分布和凋亡[23],DHA作用癌症细胞后可诱导ROS明显提高[24],本研究也证明了这一点,在DHA协同Das 增加HepG2细胞内的ROS含量增加,降低抗氧化蛋白Nrf2的表达.
综上,本研究发现了双氢青蒿素和达沙替尼抑制HepG2肝癌细胞的增殖,二者在一定浓度下联合应用可发挥协同作用,显著提高对癌细胞的抑制率.通过显著下调c-Myc、Cyclin E1、E2F1、Bcl-2和PARP,上调Bim、cl-caspase9和cl-PARP的表达水平,诱导细胞凋亡和G0/G1周期阻滞比例的显著提升,为DHA和Das治疗肝癌提供了理论和实验依据.然而,本研究仍存在诸多不足,后续将进行更多的动物实验和作用机制探索,进一步提供完善的科学依据.
——青蒿素

