实时荧光定量PCR 法鉴别川贝母掺伪
杨 健 李 靖 薛维娜王爱民何 彬王永林李勇军席晓岚∗刘 亭∗
(1.贵州医科大学,贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室,贵州贵阳550004; 2.贵州医科大学,民族药与中药开发应用教育部工程研究中心,贵州 贵阳550004;3.贵州医科大学医药卫生管理学院,贵州 贵阳550025; 4.贵州医科大学药学院,贵州 贵阳550025)
川贝母Fritillariae CirrhosaeBulbus 是百合科贝母属川贝母Fritillaria cirrhosaD.Don、甘肃贝母Fritillaria przewalskiiMaxim.、暗紫贝 母Fritillaria unibracteataHsiao et K.C.Hsia、瓦布贝母Fritillaria unibracteataHsiaoet K.C.Hsia var.wabuensis (S.Y.Tang et S.C.Yue) Z.D.Liu,S.Wang et S.C.Chen、梭砂贝母Fritillaria delavayiFranch.或太白贝母Fritillaria taipaiensisP.Y.Li 的干燥鳞茎[1-2],有化痰止咳、清热润肺、散结消痈之功效[3-5]。由于川贝母的药用价值高、疗效显著、市场需求量大,故常有用其他贝母类药材混充川贝母的现象,如浙贝母、平贝母、伊贝母、湖北贝母等。
目前川贝母鉴别中最常用且最准确的是由2015 年版《中国药典》 收录的PCR-RFLP 法,该法是一种鉴别单个川贝母真伪的方法,并不能反应样品的整体情况,不能准确反应样品的掺伪程度[6-7]。按制药企业一次购买川贝母200 kg 以上计算,按2015 年版《中国药典》 规定[8-9],至少需要抽取25~50 g 左右川贝母样品进行检测,需要进行50~100 次PCR-RFLP 反应,工作量较大,耗时较长且成本高昂。所以在生产中,常常只取10 g左右川贝母进行真伪鉴别,但是这种取样方法并不能反应样品的整体情况,不能准确反应样品的掺伪程度。尤其是在临床上,川贝母常以粉末形式使用,这更方便了不法分子使用混伪品冒充或掺入川贝母;而混合样品由于DNA 不纯,很难用药典PCR-RFLP 法来检测混合粉末样品中的掺伪程度。实时荧光定量PCR 法是一种基于特异性基因序列的快速准确、灵敏度高的定性定量方法[10]。本研究利用川贝母ITS1 区序列的特点[11-13],设计了2 条特异性鉴别真川贝母的正向引物以及2 条特异性鉴别常见的伪川贝母的正向引物,配合设计的反向引物分别组成引物对进行实时荧光定量PCR扩增,以期开发一种可检测川贝母样品掺伪程度的实时荧光定量PCR 法。
1 材料
DNA 提取试剂盒 (货号AP-MN-MS-GDNA-50) 购自美国Axygen 公司;GelRed (货号41003)购自美国Biotium 公司;DNA Marker Ⅰ (货号MD101) 和50 bp DNA Ladder (货号MD108) 均购自北京天根生化科技有限公司;SYBR 荧光定量PCR 试剂(货号RR820Q)、6×Loading Buffer (货号9156) 均购自日本Takara 公司;KOD-plus 酶(货号F0 934 K) 均购自日本Toyobo 公司;Sma I酶(货号ER0661) 购自美国Thermo 公司。G:BOX ChemiXL1.4 型凝胶成像仪(英国Syngene 公司);CFX-96 型荧光定量PCR 仪、PowerpacTMBasic 电泳仪型(美国BIO-RAD 公司);Fresco 17型高速冷冻离心机(美国Thermo 公司);TMC 振荡恒温孵育器(合肥艾本森科学仪器有限公司)。PCR 引物由英潍捷基(上海) 贸易有限公司合成,信息见表1。
对照品川贝母(批号121000-201108)、平贝母(批号120924-201410)、伊贝母(批号120929-201005)、湖北贝母(批号120962-201005)、浙贝母(批号120972-201405) 均购自中国食品药品检定研究院。市售川贝母10 批,分别于贵阳市各药店购买,标号依次为CBM-1 至CBM-10。

表1 引物序列Tab.1 Primer sequences
2 方法
2.1 基因组DNA 提取 称取样品粉末0.5 g 于5 mL 离心管中,按基因组提取试剂盒说明提取DNA,最后加入20 μL 双蒸水洗脱,得到样品基因组DNA,-20 ℃保存备用。
2.2 PCR-RFLP 反应 引物使用PCR-RFLP 引物,按2015 年版《中国药典》 方法进行操作。30 μL PCR 体系为 10 × PCR 缓冲液 3 μL,MgCl2(25 mmoL/L ) 2.4 μL,dNTP (10 mmoL/L )0.6 μL,正向引物(30 μmoL/L) 0.5 μL,反向引物(30 μmoL/L) 0.5 μL,基因组DNA 200 ng,KOD-plus 酶(5 U/μL) 0.2 μL,无菌双蒸水补足至30 μL。PCR 反应程序为95 ℃预变性4 min;扩增30 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸5 min。
取PCR 反应液置于1.5 mL 离心管中,利用SmaⅠ酶对其进行酶切。反应体系为10×酶切缓冲液2 μL,PCR 反应液6 μL,SmaⅠ酶(10 U/μL)0.5 μL,无菌水补足至20 μL。反应在30 ℃水浴中进行2 h。样品利用1.5%琼脂糖凝胶进行电泳,电压5 V/cm;电泳时间30 min,使用凝胶成像仪拍照并保存图像。
2.3 荧光定量PCR 反应 2×SYBR PCR 缓冲液2 μL,正向引物(10 μmoL/L) 0.3 μL,反向引物(10 μmoL/L) 0.3 μL,基因组DNA 200 ng,无菌双蒸水补足至20 μL。94 ℃预变性4 min;扩增40个循环,每个循环包括以下步骤,94 ℃ 30 s,68 ℃30 s,读板获取荧光信息。
2.4 考察引物对1~4 鉴别川贝母的准确性
2.4.1 鉴别川贝母、平贝母、湖北贝母、浙贝母、伊贝母 取川贝母、平贝母、湖北贝母、浙贝母和伊贝母对照品的基因组DNA。分别用引物对1~4,按“2.3” 项下方法进行PCR 扩增,并用琼脂糖凝胶电泳检测PCR 产物。电泳条件为恒压,电压为5 V/cm;电泳时间30 min。结果与PCR-RELP 法进行比较。
2.4.2 鉴别市售川贝母 取市售川贝母样品(CBM-1 至CBM-10) 各50 g,依次用灭菌水、75%乙醇和双蒸水清洗,置于超净工作台晾干,转至另一个研钵中,研磨成细粉。按“2.1” 项下方法提取基因组DNA。分别用引物对1~4,按“2.3” 项下方法进行PCR 扩增,并用琼脂糖凝胶电泳检测PCR 产物。电泳条件为恒压,电压为5 V/cm;电泳时间为30 min。结果与PCR-RELP法进行比较。
2.5 川贝母样品掺伪程度检测
2.5.1 对照品混合样品制备 取川贝母、浙贝母、平贝母、伊贝母和湖北贝母对照品(粉末),分别按表2 混合川贝母真品和伪品。
2.5.2 市售样品混合样品制备 分别取市售川贝母样品中鉴别为川贝母真品和川贝母伪品的样品,在研钵中研磨成细粉,分别按表2 混合川贝母真品和伪品。
2.5.3 PCR 检测 利用真川贝母鉴别引物(引物1 或引物2),进行实时荧光定量PCR 扩增,得到Ct值(Ct真)[14];利用伪川贝母鉴别引物(引物3或引物4) 配合反向引物,进行实时荧光定量PCR扩增,得到Ct值(Ct伪),则川贝母混合样品的掺伪比例=1/ [(1+2-(Ct真-Ct伪)] × 100%。
进行荧光定量PCR 反应时,引物对1 和引物对3 配合使用,引物对2 和引物对4 配合使用。

表2 川贝母和伪品混合比例Tab.2 Mixed proportion of F.Cirrhosae and counterfeit
3 结果
3.1 PCR-RFLP 反应鉴别 利用PCR-RFLP 引物,按《中国药典》 方法对川贝母、平贝母、湖北贝母、浙贝母和伊贝母对照品进行PCR-RFLP 反应,结果见图1。经SmaⅠ酶切后,川贝母对照品在100~250 bp 之间出现了2 条酶切条带,与药典规定相符;浙贝母、平贝母、伊贝母和湖北贝母对照品在100~250 bp 之间没有酶切条带,均符合药典。
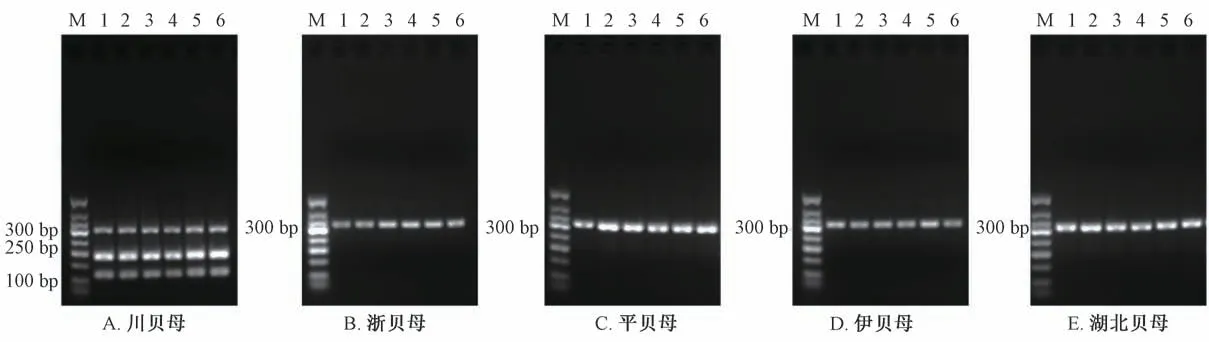
图1 各对照品PCR-RFLP 反应电泳图谱Fig.1 PCR-RFLP electrophoresis of various reference samples
3.2 PCR 鉴别结果 利用特异性引物对1~4,对川贝母对照品的基因组DNA 进行PCR 扩增,结果见图2。在引物对1~2 的作用下,川贝母对照品扩增出了200 bp 左右的条带,而引物对3~4 不能引发PCR 扩增,符合理论预期。这一检测结果与药典PCR-RFLP 结果相符,表明当PCR 反应模板为川贝母真品时,本研究所述的引物对1~2 可以引发PCR 扩增,得到200 bp 左右的产物;而引物对3、4 不能引发PCR 扩增。
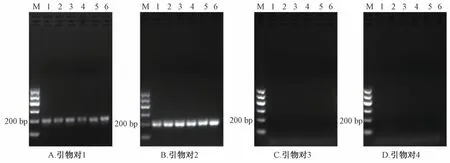
图2 引物对1~4 对川贝母对照品进行PCR 扩增的电泳图谱Fig.2 PCR electrophoresis of primers pairs 1-4 of F.Cirrhosae reference samples
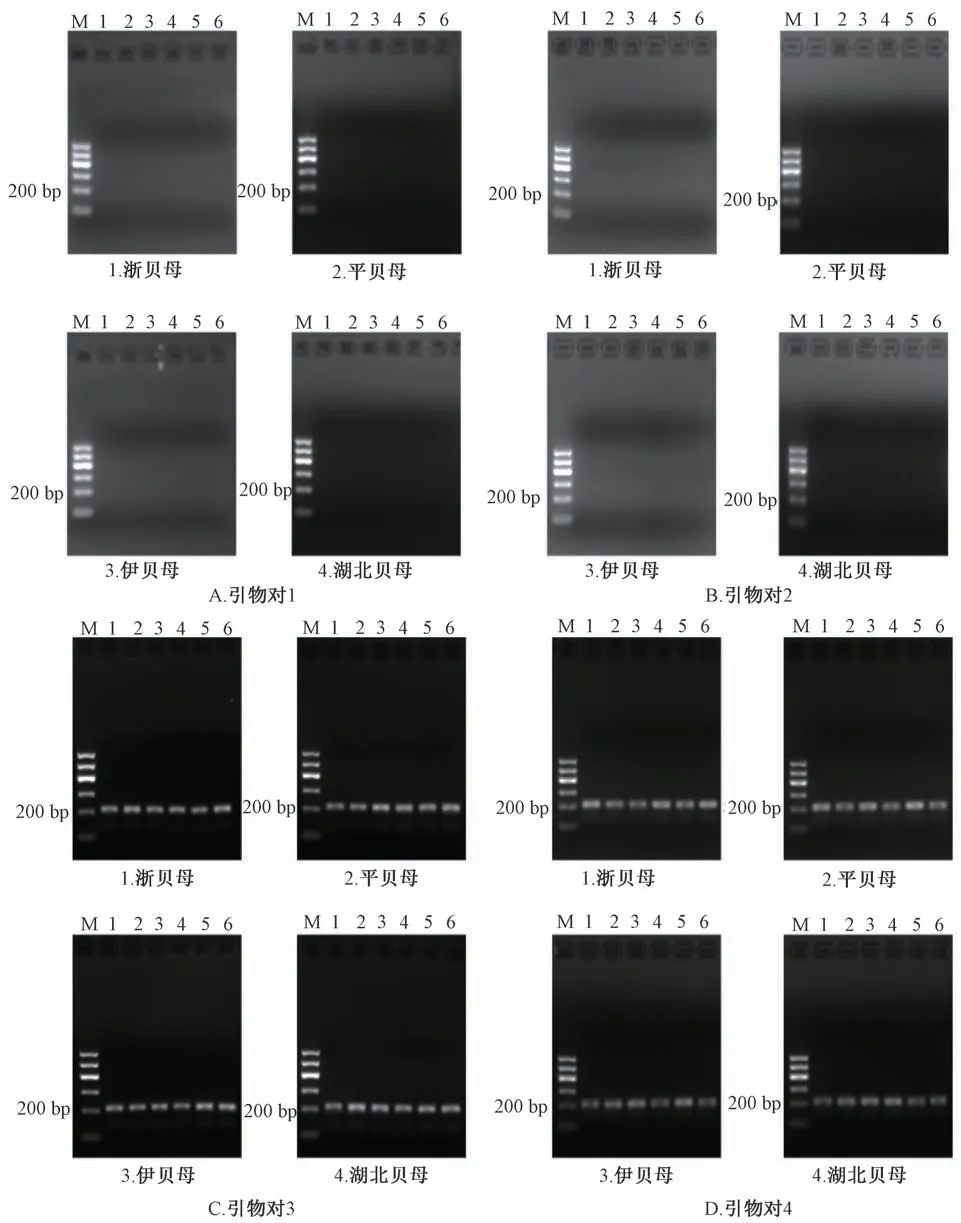
图3 引物对1~4 对各样品进行PCR 扩增的电泳图谱Fig.3 Electrophoresis of PCR amplification of various samples with primers 1-4
3.3 引物对1~4 鉴别 利用特异性引物对1~4,对浙贝母、平贝母、伊贝母、湖北贝母的基因组DNA 进行PCR 扩增,结果见图3。当PCR 反应模板为川贝母伪品(浙贝母、平贝母、伊贝母和湖北贝母) 时,本研究所述的引物对1~2 不能引发PCR 扩增;本研究所述的引物对3~4 能引发PCR扩增,得到200 bp 左右的产物。
3.4 PCR-RFLP 反应鉴别市售川贝母 按2015 年版《中国药典》 规定,川贝母真品经SmaⅠ酶切后,产生2 条新的条带且大小在100~250 bp 之间。由酶切后的电泳图见图4,CBM-1、CBM-2、CBM-5、CBM-6、CBM-8、CBM-10 6 批药材和川贝母对照品一样,在100~250 bp 之间有2 条带,表明均为真品;而CBM-3、CBM-4、CBM-7、CBM-9 4 批药材和平贝母对照品一样没有条带,表明均为伪品。
3.5 引物对1~4 鉴别市售川贝母 根据本研究所得结论,川贝母真品经引物对1~2 PCR 扩增后,应该出现一条200 bp 左右的条带;而川贝母伪品经引物对3~4 PCR 扩增后,应该出现一条200 bp左右的条带。结果见图5,市售川贝母样品经引物对1~4 扩增后的实验结果与“3.4” 项一致,表明本研究所设计的特异性引物可用于鉴别川贝母真伪。

图4 PCR-RFLP 法鉴别市售川贝母的电泳图谱Fig.4 Electrophoresis of F.Cirrhosae samples identified by PCR-RFLP
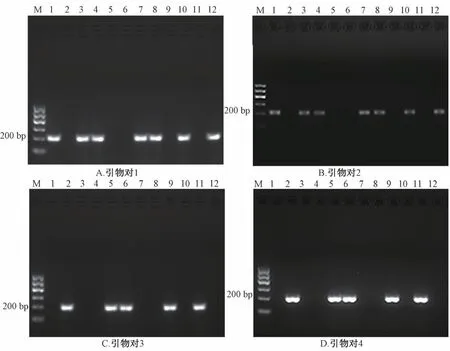
图5 市售川贝母样品荧光定量PCR 产物电泳图谱Fig.5 Electrophoresis of PCR samples of F.Cirrhosae
3.6 荧光定量PCR 法鉴别川贝母及常见伪品的混合样品掺伪 川贝母对照品及常见川贝母伪品对照品的混合样品经真川贝母鉴别引物对1~2 进行实时荧光定量PCR 扩增得到Ct值记为Ct真;经伪川贝母鉴别引物对3~4 进行实时荧光定量PCR 扩增得到Ct值记为Ct伪,经计算得到相应的混合样品的掺伪比例,结果见表3~4。结果显示,计算所得川贝母掺伪比例与实际的伪品含有量接近。
3.7 荧光定量PCR 法检测市售川贝母混合样品掺伪 市售川贝母混合样品经引物对1~4 进行实时荧光定量PCR 扩增后,分别得到Ct真和Ct伪,经计算得到相应的混合样品的掺伪比例,结果见表5。计算所得川贝母掺伪比例与实际的伪品含有量接近。
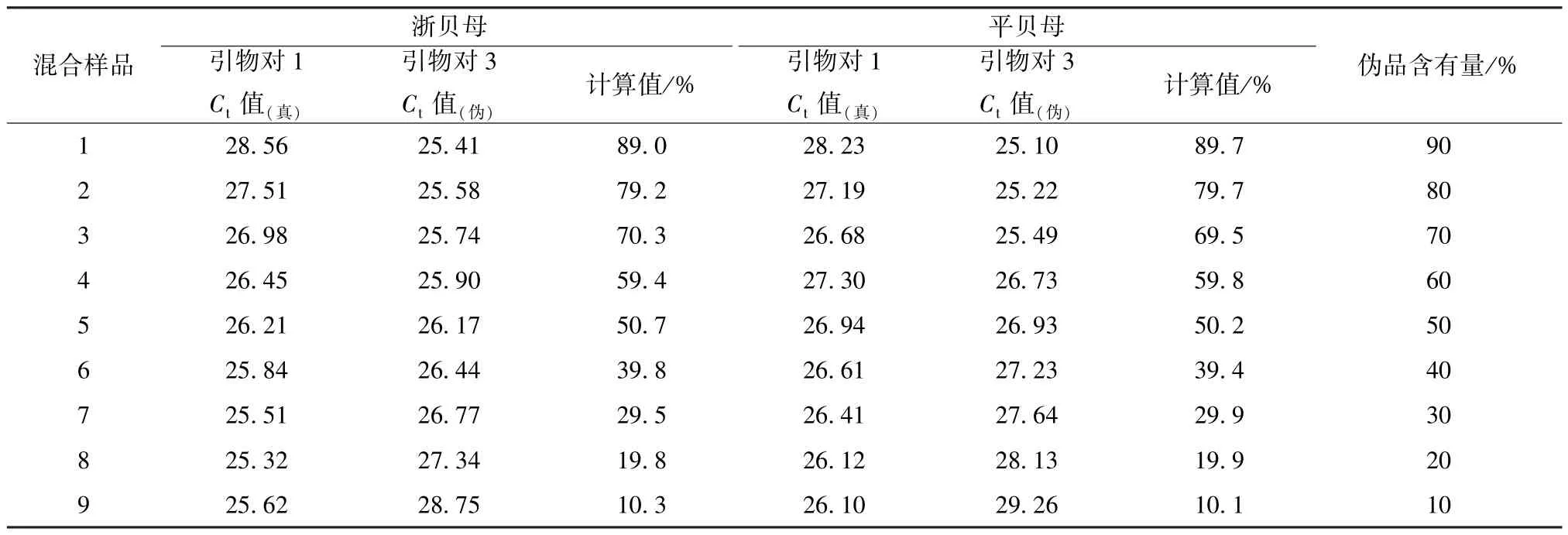
表3 引物对1~3 混合川贝母样品的掺伪程度检测结果Tab.3 Degree results of detecting the adulteration of mixed samples by primers 1-3

表4 引物对2~4 检测混合川贝母样品的掺伪程度结果Tab.4 Degree results of detecting the adulteration of mixed samples by primers 2-4
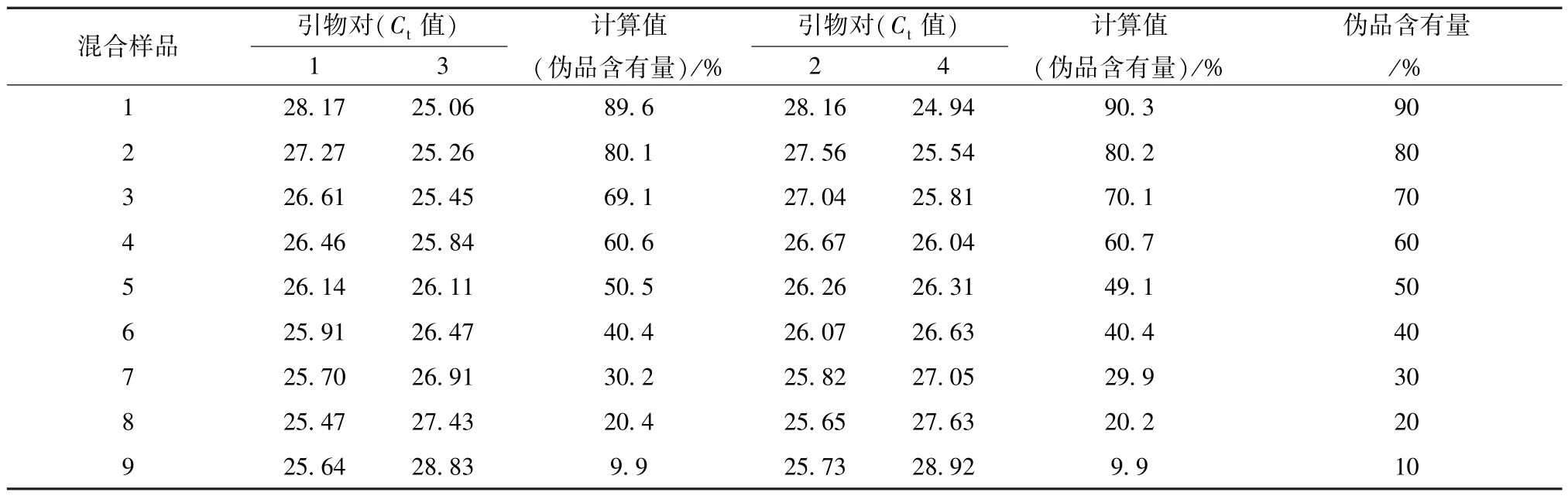
表5 引物对1、3,2、4 检测市售川贝母混合样品掺伪程度结果Tab.5 Degree results of detecting the adulteration of mixed samples by primers 1,3 and primers 2,4
4 讨论
本研究设计的真川贝母鉴别引物以川贝母ITS1 区的第75 位碱基“C” 为3′未端,伪川贝母鉴别引物以伪川贝母ITS1 区的第75 位碱基“T”为3′未端[11]。2 种引物的3′端的第3 个碱基处,都引入了碱基错配,增加了鉴别的特异性和准确性。本研究所述的引物对1~4 可以用于鉴别川贝母真品和浙贝母、平贝母、伊贝母、湖北贝母等常见川贝母伪品,准确率与2015 年版《中国药典》收录的PCR-RELP 法一致,不会出现假阳性扩增;且可用于市售川贝母的真伪鉴别,同样,无假阳性扩增出现。
本研究首次利用荧光定量PCR 法实现对川贝母掺伪品的相对定量检测,利用设计的川贝母真品鉴别引物对1~2,进行实时荧光定量PCR 扩增,得到Ct 值(Ct真);利用川贝母伪品鉴别引物对3~4,进行实时荧光定量PCR 扩 增,得到Ct 值(Ct伪)。只需同时进行2 次实时荧光定量扩增,再通过简单计算即可检测川贝母样品中常见伪品的掺伪程度,无需进行酶切,且该法允许大量取样,这极大减少了工作量,缩短了检测时间,并且准确度高,从而能更好的推广川贝母的分子鉴定。与传统的PCR-PFLP 法相比,消除了有毒有害试剂对试验人员的影响,并且能够实时监测试验结果,操作更加便捷,大大缩短检测周期[15],以期为川贝母的检测提供参考。

