体素内不相干运动扩散成像及血氧水平依赖成像评估碘对比剂致兔急性肾损伤
王荣甲,任 克,王永芳
(中国医科大学附属第一医院放射科,辽宁 沈阳 110000)
碘对比剂诱导的急性肾损伤(contrast-induced acute kidney injury, CIAKI)已成为不容忽视的临床问题。碘对比剂所致急性肾损伤(acute kidney injury, AKI)为医源性肾损伤的第3位[1]。血肌酐(serum creatinine, Scr)是CIAKI的主要标志物[2],常在注入碘对比剂后3~5天达峰值,1~3周内恢复基线值[3],导致部分患者错过治疗时间而发生AKI或延长住院时间。血氧水平依赖(blood oxygenation level-dependent, BOLD)成像能够无创评价组织氧利用度[4]。血液中顺磁性脱氧血红蛋白含量增多导致周围磁场不均匀,T2缩短,T2WI低信号,其表观横向弛豫率(R2*=1/T2*)是组织氧分压的敏感指标[5]。基于体素内不相干运动(intravoxel incoherent motion, IVIM)的DWI(IVIM-DWI)使用多个b值对成像数据进行双指数拟合,将水分子扩散信息和血液微循环灌注信息分离开来,对于肾脏病变具有潜在临床应用价值[6-7],且IVIM技术对肾脏水分子扩散和血液灌注早期变化很敏感[8]。缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)积累可作为缺氧体内测定的内源性指标[9],而血红素加氧酶1(heme oxygenase-1, HO-1)对组织氧化损伤有重要保护作用[10]。本研究尝试以IVIM-DWI联合BOLD成像早期无创观察注射碘克沙醇后兔AKI期间肾组织水扩散、灌注及氧合变化,并与肾脏组织学和HIF-1α和HO-1表达水平相对照。
1 材料与方法
1.1 实验动物及分组 新西兰雄性兔25只,体质量均为2.5 kg,随机分为基线组和实验组(1、24、48、72 h组),每组5只。实验前12 h停饲、4 h停水。按照5 gI/kg体质量[11]经耳缘静脉注射碘克沙醇320建立AKI模型,基线组注射等量生理盐水,之后依次于1、24、48、72 h对相应实验组行BOLD和IVIM-DWI扫描。
1.2 仪器与方法 采用GE Twin Speed 3.0T MR扫描仪,8通道阵体线圈,麻醉(3%戊巴比妥钠1 mg/kg体质量)后仰卧位保定动物,头先进,置于线圈中。BOLD采用多梯度回波序列成像,层数5层,层厚3 mm,视野16 cm×16 cm,矩阵256×256,TR=96.2 ms,TE=4.4 ms。IVIM采用单次激发自旋回波扩散加权平面回波成像,b值取0、10、20、50、100、200、400、600、800、1 200 s/mm2,层数5,层厚3 mm,视野16 cm×16 cm,矩阵160×160,TR=4 050 ms,TE=95.5 ms。扫描结束后将图像上传至 GE Adw 4.4工作站,手动于右侧肾脏避开肾窦部脂肪及血管选择ROI(30~35 mm2),分别在肾皮质、髓质测量ADC值、D值、D*值、f值及R2*值,重复测量3次,取平均值作为结果。
1.3 生化指标及组织病理学检测 对各组兔经耳缘静脉进行采血,离心15 min后取上清检测Scr和尿素氮(blood urea nitrogen, BUN)。扫描结束后以过量戊巴比妥处死动物,立即取出肾脏,行HE染色及免疫组织化学染色,参考文献[12]评分标准对肾脏损伤进行半定量评估,参考文献[13]方法对HIF-1α和及HO-1在胞浆、胞核中的表达区域进行半定量分析。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布和方差齐性测值,采用单因素方差分析进行多组比较,两两比较采用LSD方法; 对非正态分布测值采用Kruskal-Wallis检验。以Pearson相关分析观察fMRI参数与免疫组织化学评分的相关性,0.40≤|r|≤0.69为中度相关,0.70≤|r|≤0.89为高度相关。P<0.05为差异有统计学意义。
2 结果
2.1 BOLD参数值变化 相比基线组,1 h组肾皮质、髓质R2*值升高,24 h组均达峰值(P均<0.05),72 h组肾皮质、髓质R2*值仍未恢复(P均<0.05)。髓质R2*值始终高于皮质。见表1、图1。
2.2 IVIM各参数值变化 相比基线组,1 h组肾皮质、髓质ADC值及D值下降,24 h组降至最低(P均<0.05),72 h组肾脏皮质、髓质ADC值、皮质D值仍未恢复基线水平,但差异无统计学意义(P均>0.05),而髓质D值仍低于基线组(P<0.05)。1 h组肾皮质、髓质D*值降低,72 h组基本恢复至基线水平(P均>0.05)。24 h组肾皮质、髓质f值最低(P均<0.05),72 h组肾髓质f值仍未恢复基线水平(P<0.05)。见表2、图2。
2.3 生化指标 相比基线组,1 h组Scr及BUN升高,72 h组达到峰值(P均<0.05)。见表3。
2.4 病理学改变 实验组肾组织细胞核脱落,肾脏皮质空泡化,肾小球萎缩,近曲小管内可见管腔碎屑形成,以24 h最重。免疫组化染色显示,1 h组肾小管上皮细胞核即有HIF-1α及HO-1表达,胞浆、细胞核中均可见到阳性染色,24 h组表达最显著,切片染色最深,48h组及72h组表达水平下降,染色渐浅。见图3~5。
表1 各组肾脏皮、髓质R2*值比较(s-1,±s)
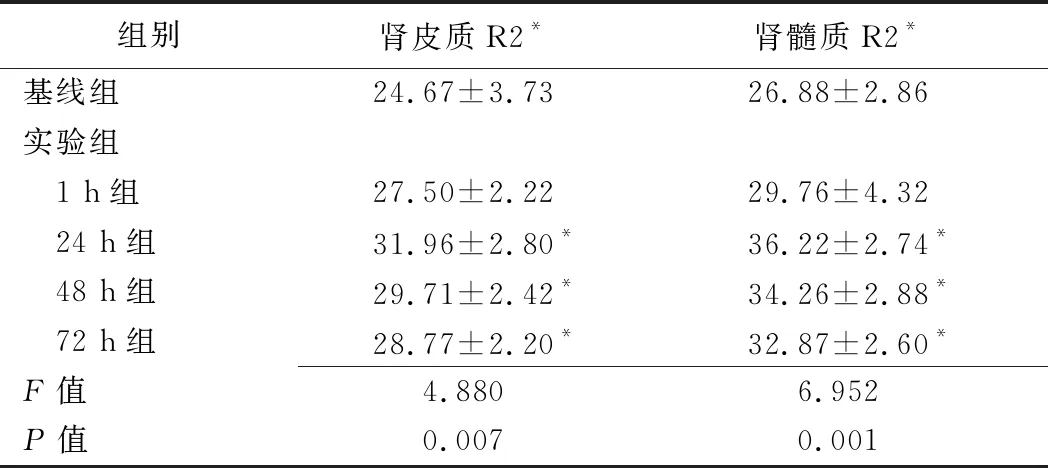
表1 各组肾脏皮、髓质R2*值比较(s-1,±s)
组别肾皮质R2*肾髓质R2*基线组24.67±3.7326.88±2.86实验组 1 h组27.50±2.2229.76±4.32 24 h组 31.96±2.80*36.22±2.74* 48 h组29.71±2.42*34.26±2.88* 72 h组28.77±2.20*32.87±2.60*F值4.8806.952P值0.0070.001
注:*:与基线组比较,P<0.05
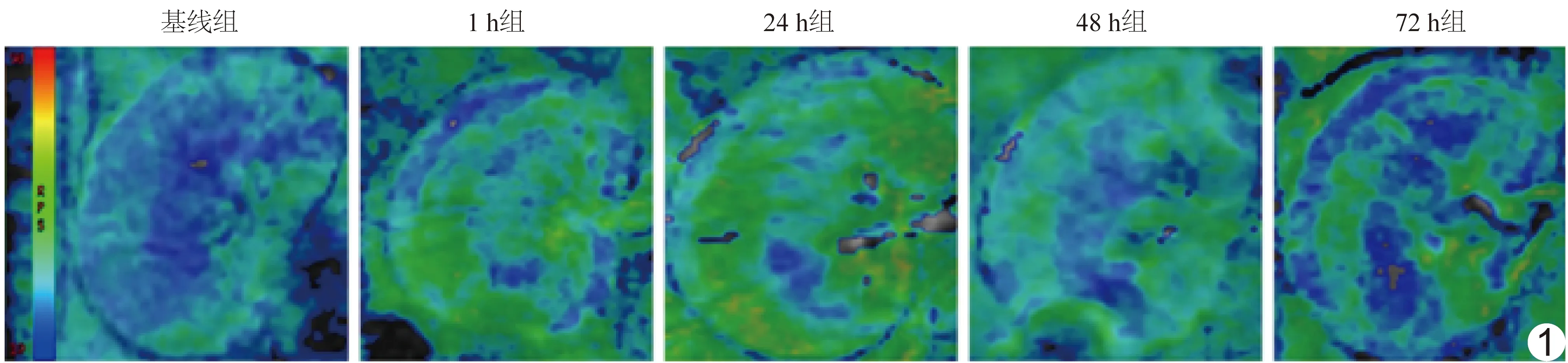
图1 各组代表性BOLD图像
表2 各组肾脏IVIM参数值(±s)
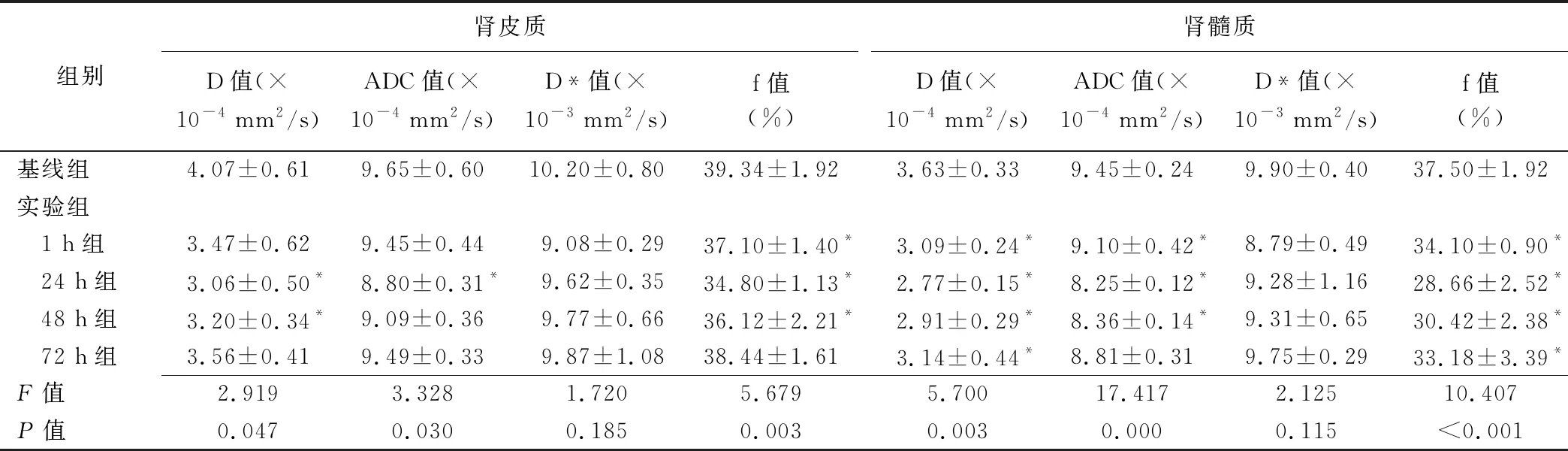
表2 各组肾脏IVIM参数值(±s)
组别肾皮质D值(×10-4 mm2/s)ADC值(×10-4 mm2/s)D*值(×10-3 mm2/s)f值(%)肾髓质D值(×10-4 mm2/s)ADC值(×10-4 mm2/s)D*值(×10-3 mm2/s)f值(%)基线组4.07±0.619.65±0.6010.20±0.8039.34±1.923.63±0.339.45±0.249.90±0.4037.50±1.92实验组 1 h组3.47±0.629.45±0.449.08±0.2937.10±1.40*3.09±0.24*9.10±0.42*8.79±0.4934.10±0.90* 24 h组 3.06±0.50*8.80±0.31*9.62±0.3534.80±1.13*2.77±0.15*8.25±0.12*9.28±1.1628.66±2.52* 48 h组3.20±0.34*9.09±0.369.77±0.6636.12±2.21*2.91±0.29*8.36±0.14*9.31±0.6530.42±2.38* 72 h组3.56±0.419.49±0.339.87±1.0838.44±1.613.14±0.44*8.81±0.319.75±0.2933.18±3.39*F值2.9193.3281.7205.6795.70017.4172.12510.407P值0.0470.0300.1850.0030.0030.0000.115<0.001
注:*:与基线组比较P<0.05
表3 各组生化指标(±s)
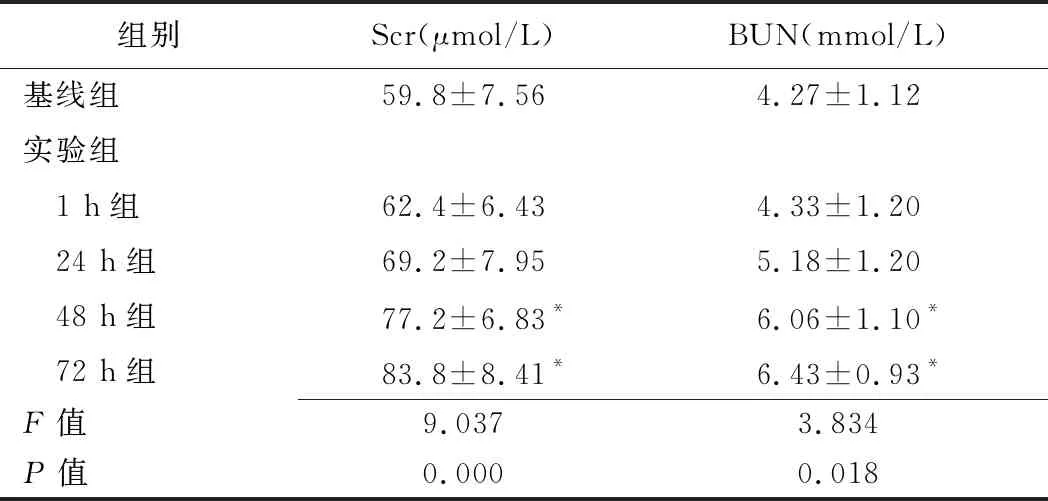
表3 各组生化指标(±s)
组别Scr(μmol/L)BUN(mmol/L)基线组59.8±7.564.27±1.12实验组 1 h组62.4±6.434.33±1.20 24 h组69.2±7.955.18±1.20 48 h组77.2±6.83*6.06±1.10* 72 h组83.8±8.41*6.43±0.93*F值9.0373.834P值0.0000.018
注:*:与基线组比较P<0.05
2.5 fMRI各参数与HIF-1α、HO-1的相关性 HIF-1α及HO-1与肾皮质R2*、ADC值、D值及f值呈中等相关,与D*值无明显相关;HIF-1α及HO-1与髓质R2*及D值与呈中度相关,ADC值及f值高度相关,与D*值无明显相关。见图6、7。
3 讨论
目前对于CIAKI的发生机制尚未完全清楚。以往研究[4,6]多单独采用BOLD或IVIM技术评估肾功能。本研究联合应用此二种fMRI技术,以BOLD监测注射碘对比剂后早期肾脏血氧代谢的改变,IVIM观察肾组织内水分子运动和血流灌注的变化信息,相互印证,以从多方面、多角度准确显示注射碘对比剂后肾功能变化,并探讨其病理生理学机制。
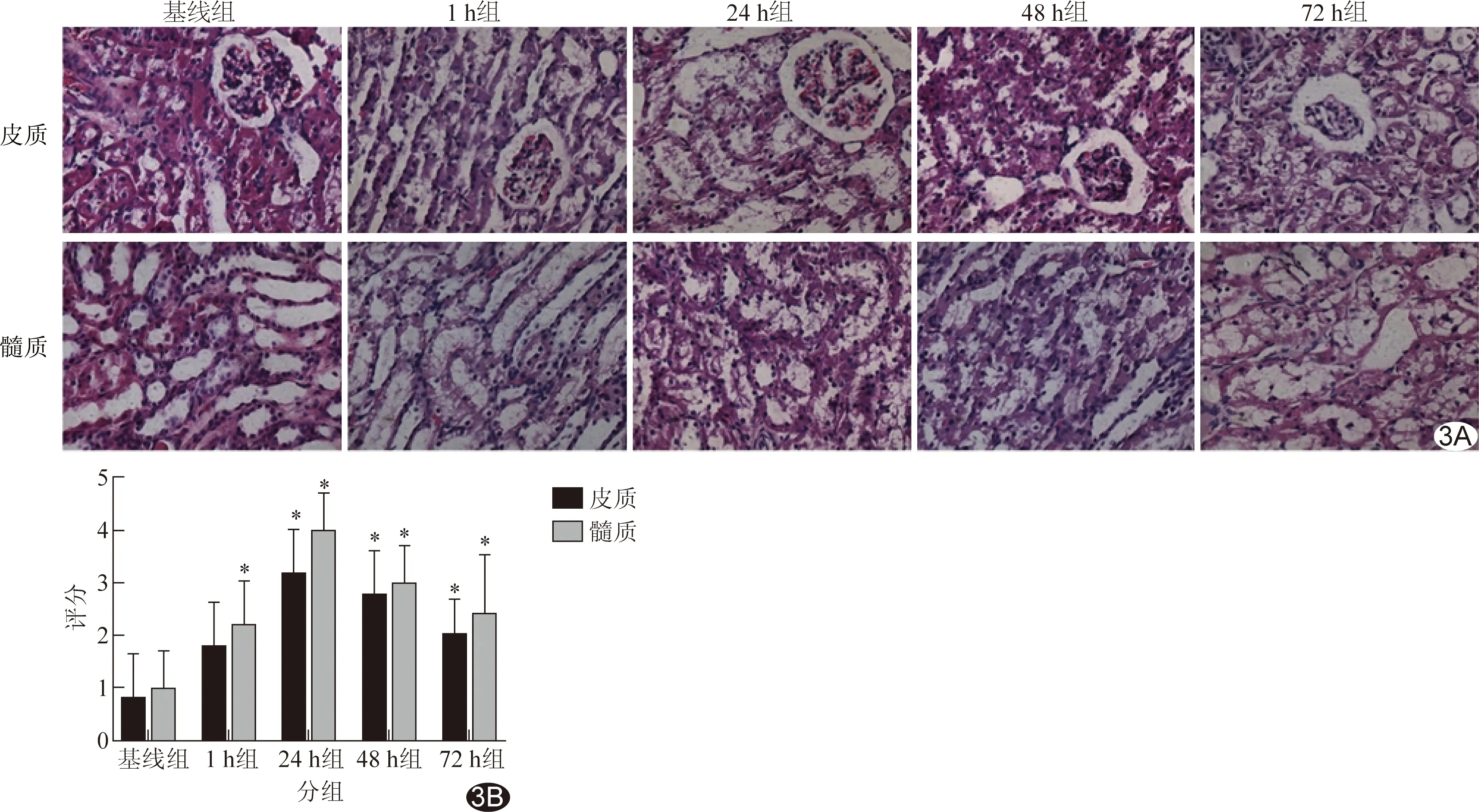
图3各组肾脏病理(HE,×400) A.病理图; B.病理评分比较 (*:与基线组相比P<0.05)
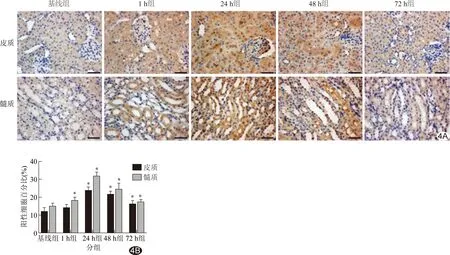
图4各组HIF-1 α表达(×400) A.HIF-1 α免疫组织化学; B.HIF-1 α表达比较 (*:与基线组相比P<0.05)
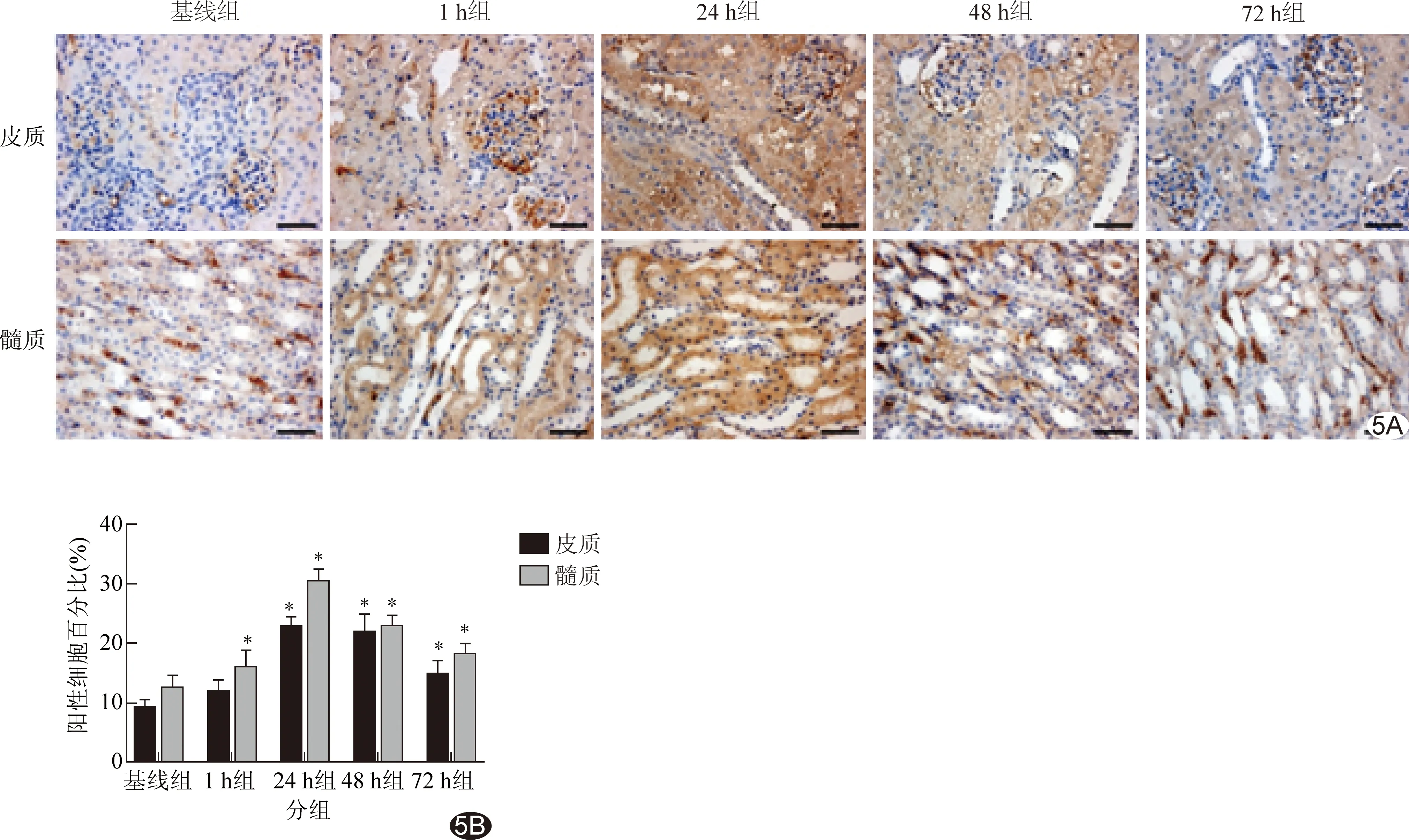
图5各组HO-1表达(×400) A.HO-1免疫组织化学; B.HO-1表达比较 (*:与基线组相比P<0.05)
肾脏低灌注、缺氧及氧化应激是CIAKI发生发展的关键病理因素[1]。R2*值升高表明局部组织内氧含量降低,反之提示氧含量升高。b值<200 s/mm2时IVIM-DWI代表组织灌注信息,b值>200 s/mm2时则反映水分子扩散程度。本研究以BOLD观察注射碘克沙醇后72 h内兔肾脏R2*值的动态变化过程,发现注入碘克沙醇后1 h肾脏R2*值即开始升高,24 h达峰值;注射碘克沙醇后1 h兔肾脏D*值下降,可能由于肾小血管收缩导致肾脏血流微灌注减少[14],进而引发肾脏缺氧;至72 h肾皮质、髓质R2*值仍未恢复至正常水平,推测原因在于碘克沙醇的高黏度特性可减缓肾内血流速度,延长其在肾内滞留时间[15];碘对比剂经肾小球滤过,不仅被肾小管重吸收,且其浓度在流经肾小管段时进一步浓缩,加重肾小管损伤,最终导致肾脏不可恢复的缺氧损伤。
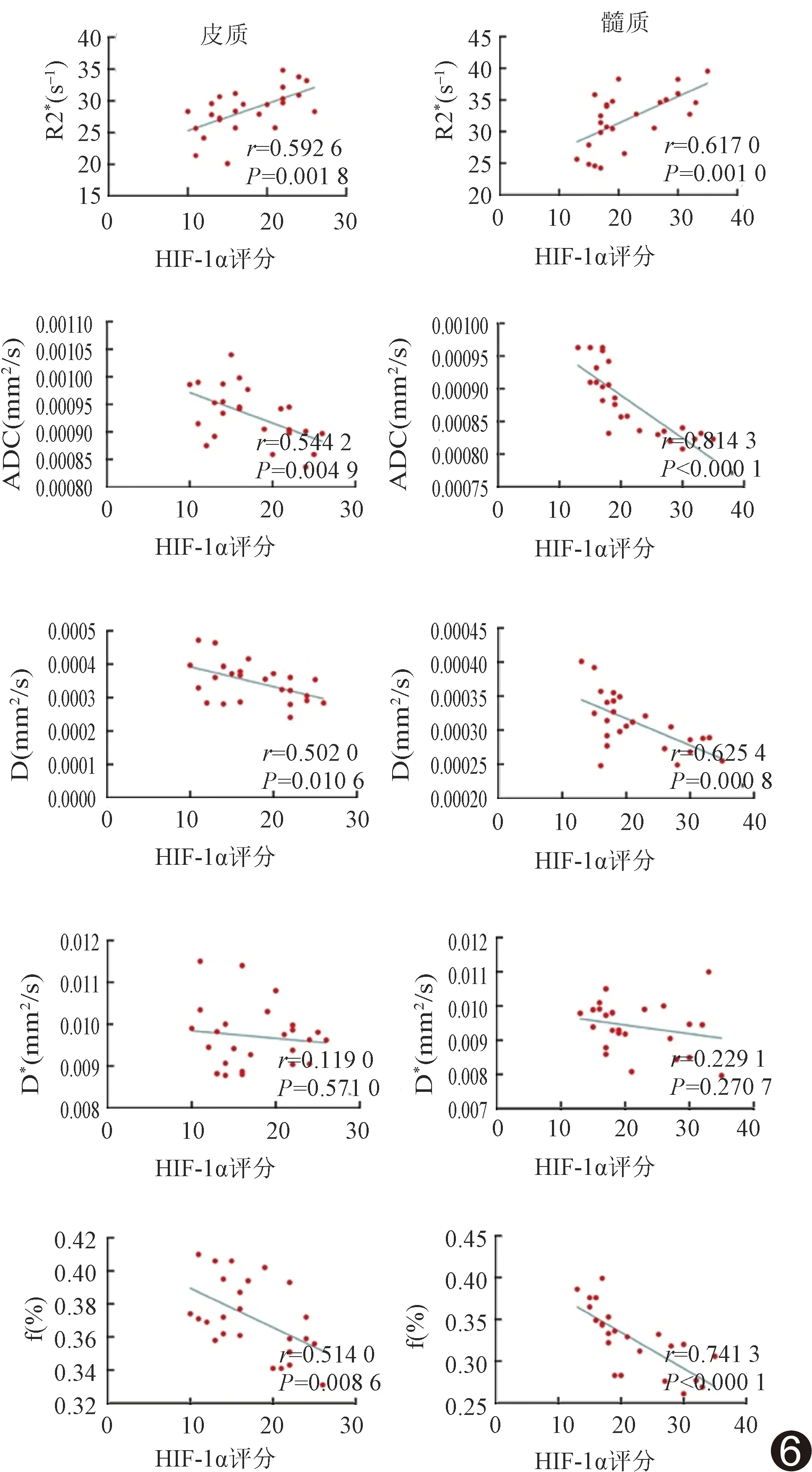
图6 肾脏fMRI参数与HIF-1α评分相关性散点图
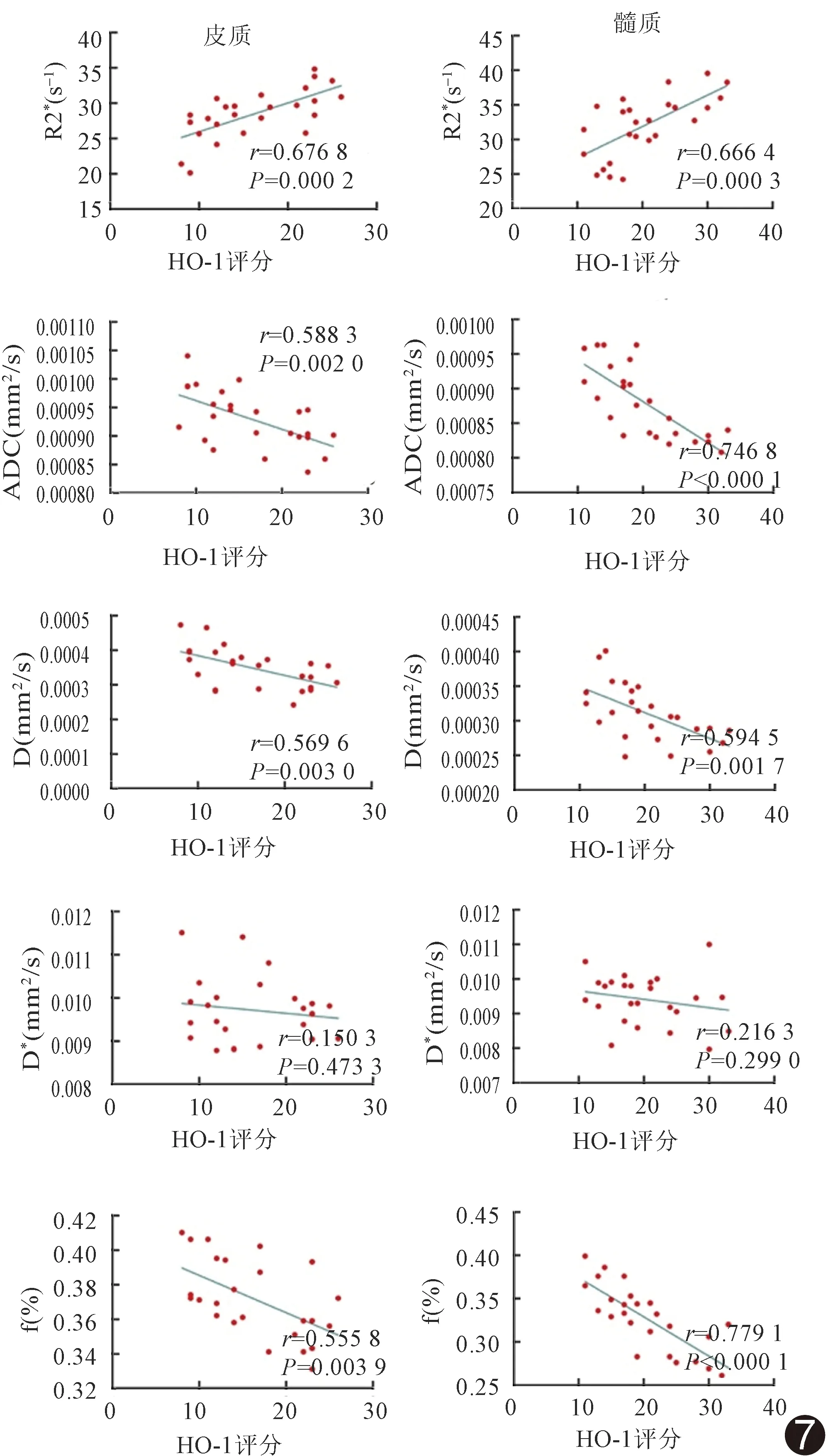
图7 肾脏fMRI参数与HO-1评分相关性散点图
ADC值同时包含水分子扩散和血液微循环灌注双重信息。真实扩散系数D值是真实的水分子扩散运动的表现;灌注相关扩散系数D*值代表血液微循环灌注,取决于毛细血管的收缩或舒张状态;而灌注分数f值则是组织内液体负荷状态的体现。本研究中肾脏皮、髓质ADC值大于D值,这是由于ADC值同时包含水分子扩散和血流灌注信息。注射碘克沙醇后,兔肾脏ADC值及D值降低,可能与碘克沙醇对肾小管上皮细胞的毒性作用或延迟的细胞凋亡致肾内组织扩散减少有关[16]。另外,碘克沙醇虽为等渗对比剂,进入体内后其高黏度使之与肾小管的接触时间延长,引起细胞水肿,组织内水分子扩散受限。光镜下观察病理切片显示肾小管细胞水肿及炎性细胞浸润,肾小球萎缩,肾脏间质纤维化,进一步证实了上述影像学结果。本研究提示碘克沙醇所致肾脏灌注减少早于肾脏组织扩散降低,与既往研究相符[17]。注射碘克沙醇后1 h肾脏D*值及f值下降为肾脏血管持续收缩所致,随后血管舒张,D*值渐渐回升,而f值回升略晚于D*值,表明血管舒张后引起肾血容量增加,提示D*值和f值可区分肾脏功能性血管舒张和液体负荷增加。碘克沙醇对肾脏皮质血流灌注的影响是一过性的,本研究72 h组肾皮质IVIM各参数基本恢复至正常水平,而肾髓质各参数仍低于正常值,考虑原因在于肾皮质血运丰富,而髓质生理性低氧,碘克沙醇更易对其造成不可逆损伤。
HIF-1α是缺氧条件下的重要氧依赖性核转录因子,参与红细胞生成以及铁代谢和能量代谢等,为血红素分解代谢中的限速酶,可被各种氧化应激所诱导。本研究发现兔肾脏皮、髓质R2*值与HIF-1α和HO-1有较好的相关性,提示R2*值可较好地反映局部肾组织氧含量;细胞毒性作用和肾小管细胞凋亡所致肾内扩散降低可加重肾小管损伤,而肾小管损伤亦可引起肾脏缺氧,此点为ADC值、D值和f值与HIF-1α及HO-1良好的相关性所证实。因此,利用BOLD和IVIM技术可监测CIAKI的发生和发展,应用价值较好。
本研究的主要局限性:扫描过程中实验兔处于自由呼吸状态,图像可能受呼吸及肠气伪影干扰;采用手动勾画ROI进行分析,可能影响数据的准确性; T2*对组织氧合敏感,亦受血管体积分数和局部红细胞压积的影响,测量准确性和图像质量均有待提高。

