全身放疗联合自体外周血造血干细胞移植治疗7例T淋巴母细胞淋巴瘤的临床效果
侯户婷,陈清江,张旭东,钱思宇,胡俊霞,王欣,王泽元,尹美凤,吴少旋,董萌,丁梦杰,张明智
(1.郑州大学第一附属医院 肿瘤科,河南 郑州 450052;2.河南省淋巴瘤诊疗中心,河南 郑州 450052)
T淋巴母细胞淋巴瘤(T lymphoblastic lymphoma,T-LBL)具有相对罕见性、高侵袭性、高复发率等特点[1-2]。临床上缺乏标准的治疗方案,成人缓解后的巩固策略包括化疗、自体干细胞移植(autologous peripheral blood hematopoietic stem cell transplantation,auto-HSCT)或同种异体干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)。在化疗中,相比于非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)型化疗方案,使用急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)型化疗方案,T-LBL的预后显著改善,但高复发率仍然降低了患者的总体生存率[3-4]。来自欧洲的一项随机试验结果证明,auto-HSCT巩固治疗3 a无病生存率(disease-free survival,DFS)为55%,相对于化疗(22%)有明显生存获益[5]。因此,诱导治疗达到临床缓解后,建议尽快行造血干细胞移植[6]。目前临床多采用allo-HSCT进行巩固治疗,可使患者获得更低的复发率,但高移植物抗宿主病发生率、较高的移植相关死亡率使其并未达到理想的生存获益[2],同时高昂的移植费用限制患者选择。近些年,少量研究行全身放疗(total body irradiation,TBI)联合auto-HSCT治疗NHL,提示有较好的治疗潜力,考虑与TBI最大限度杀灭残留肿瘤细胞相关[7]。联合TBI的allo-HSCT已被广泛用于治疗成人ALL,但对应用于联合auto-HSCT治疗T-LBL,临床报道很少。本研究分析2015年12月至2018年4月在河南省淋巴瘤诊疗中心接受TBI联合auto-HSCT的7例T-LBL患者的资料,并行相关文献总结。
1 材料和方法
1.1 病例资料及诱导方案根据WHO(2016版)淋巴造血系统肿瘤分类标准结合免疫组化结果进行病理诊断,患者均经淋巴组织活检,同时行免疫组织化学染色、流式细胞术检测确诊为T-LBL。确诊后完善相关检查,如骨髓病理学检查、肿瘤全身断层显像,进行AnnArbor分期。7例患者移植前均签署知情同意书。7例患者中,男4例,女3例,中位年龄22(15~54)岁,Ⅱ期1例,Ⅲ期2例,Ⅳ期4例。合并纵隔肿物者5例;结外侵犯者4例,骨髓侵犯者3例,弥漫性心包膜侵犯者1例;均无中枢神经系统侵犯。4例无骨髓侵犯患者,3例单独接受Hyper CVAD诱导方案,1例接受Hyper CVAD达完全缓解(complete remission,CR)后又接受其他化疗巩固治疗。3例骨髓侵犯者单独接受BFM90诱导方案,化疗期间鞘内注射。移植前均达到CR,且无进展与反复。见表1。
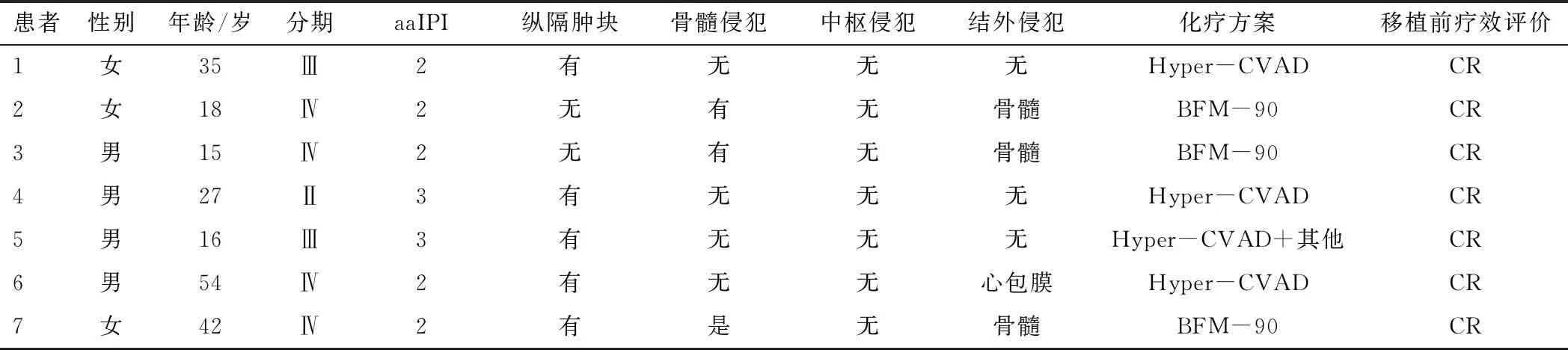
表1 7例T-LBL患者的临床资料
注:aaIPI—年龄调整的国际预后指数;CR—完全缓解。
1.2 动员方案及干细胞采集采集前行骨髓流式细胞学、病理学活检和全身影像学检查,确保患者处于CR状态。采用大剂量CHOP(环磷酰胺1 g·m-2,静脉滴注,第1~2天;长春地辛4 mg,静脉滴注,第1天;表柔比星60 mg·m-2,静脉滴注, 第1天;强的松100 mg,口服,第1~5天)方案动员。移植所需外周血单个核细胞数(mononuclear cells,MNC)>2×108kg-1,CD34+细胞数>2 ×106kg-1,以后者为主。
1.3 预处理方案预处理方案采用TBI联合环磷酰胺(CTX)(TBI共10 Gy,3 d,上午2 Gy,下午2 Gy,第3天上午2 Gy,下午入仓休息;CTX 60 mg·kg-1,静脉滴注,入仓第1~2天)方案,结束后休息2 d开始回输干细胞。
1.4 安全护理和造血重建感染:干细胞回输后第3天常规加用造血刺激因子。当患者体温>38.5 ℃时,及时行血培养、C反应蛋白、降钙素原、真菌D-葡聚糖监测等,根据病原学依据调整抗生素。口腔溃疡、恶心的防治:加强口腔护理,如果出现口腔溃疡用康复新液、表皮生长因子局部治疗促进溃疡愈合,并给予保肝、护胃、止吐治疗。以外周血中性粒细胞(absolute neutrophil count,ANC)绝对值>0.5×109L-1,持续3 d,未输注血制品情况下,血小板(platelet,PLT)>20×109L-1,持续3 d,为造血功能重建,以前者为主。无进展生存期(progression-free survival,PFS)时间:自诊断至疾病复发/进展或发生因为任何原因引起的死亡时间。总生存(overall survival,OS)时间:自诊断后至任何原因引起的死亡时间或末次随访时间。
2 结果
2.1 植入情况输注MNC中位数1.85(0.51~4.18)×108kg-1,CD34+细胞中位数2.10(1.51~6.40)×106kg-1,对所有患者移植后造血干细胞均植入成功,ANC植入的中位时间11(10~13)d,PLT植入中位时间12(11~42)d。见表2。
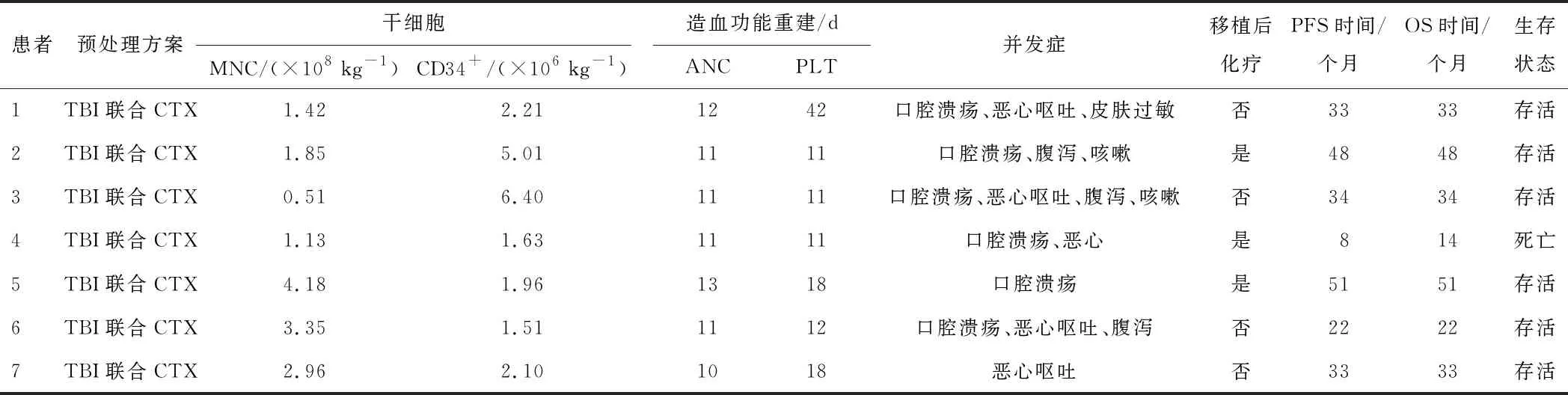
表2 7例T-LBL患者移植后临床资料
注:TBI—全身放疗;CTX—环磷酰胺;MNC—单核细胞;ANC—中性粒细胞;PLT—血小板;OS—总生存;PFS—无进展生存期。
2.2 移植并发症7例患者在移植过程中均出现轻中度的不良反应,口腔溃疡6例,恶心呕吐5例,腹泻3例,咳嗽咳痰2例,皮肤过敏1例。其中,以消化道反应和口腔溃疡为主,予以止吐止泻及药物口腔漱口等治疗后缓解。其余并发症均能较好耐受,对症处理后症状消失。未发现出血性膀胱炎、继发第二肿瘤和慢性肾衰竭等。
2.3 维持治疗完全缓解的6例患者中2例接受维持治疗,(维持1:异环磷酰胺2.0 g,静脉滴注,第1~3天;长春地新2 mg,第1天;地塞米松6 mg·m-2,口服,第1~5天;鞘内注射。维持2:依托泊苷100 mg,静脉滴注,第1~3天;米托蒽醌10 mg,第1天;鞘内注射。院外口服甲氨蝶呤20 mg·m-2,每周1次;6-巯基嘌呤50 mg·m-2,每天),两种方案交替治疗,21 d为1个周期,2例患者维持治疗5个周期。所有患者治疗结束后第1年每3个月复查1次,第2~3年每6个月复查1次[8]。
2.4 治疗费用费用统计为患者自体外周血造血干细胞动员、采集和回输住院总费用。其中,自体外周血干细胞动员前骨髓流式细胞学、病理学和全身影像学检查以及入仓前心、肺、肝、肾等重要器官的全面检查也包括在内。自体外周血造血干细胞移植总费用中位数162 421(137 177~186 535)元,均在200 000元以下。
2.5 随访结果随访截止至2020年3月15日,中位随访时间为33(14~51)个月。6例存活患者,全部处于无进展生存状态。1例患者死亡,造血重建后1个月内再次出现纵隔肿块复发,诱导治疗6个月后死亡。
3 讨论
T-LBL生物学特征与T-ALL类似,2008版WHO分类将二者定义为同一种疾病,骨髓受累<25%(依据WHO的20%)正式划分为LBL与ALL[9]。T-LBL患者年龄越小,纵隔肿瘤或骨髓受累的发生率就越高[10]。一些回顾性研究证实对于化疗敏感的T-LBL患者,auto-HSCT可作为一种合理选择,且allo-HSCT的高移植相关死亡率抵消任何潜在的生存益处[11-12]。最近国内发表的一项多中心前瞻性研究提出双次auto-HSCT为治疗T-LBL的最佳选择,3年PFS率达73.5%[13],表明auto-HSCT治疗T-LBL的一种趋势。T-LBL患者复发后的长期存活率差,接受强化疗和造血干细胞移植也是如此[14]。因此,探索治疗T-LBL的有效策略,目前仍是临床工作重点。
来自中国单中心的分析认为ALL患者auto-HSCT联合维持治疗可以在移植前微小残留病灶(minimal residual disease,MRD)阴性时提供长期存活率[15]。可见MRD中肿瘤细胞增殖浸润是auto-HSCT后复发并影响长期存活的重要原因。本研究患者化疗后经全身断层显像、骨髓流式细胞学及病理学活检均达到CR。移植前行TBI联合大剂量CTX,最大限度地杀灭残存肿瘤细胞,进一步减小移植前MRD,降低复发率。1例复发患者因干细胞回输距采集时间较长,期间口服甲氨蝶呤和6-巯基嘌呤维持,未及时行auto-HSCT,提示T-LBL患者达CR后尽快移植,避免MRD阴性转为阳性。本研究6例患者持续缓解存活的结果,证实以TBI联合大剂量CTX为预处理的auto-HSCT的可行性、有效性。
7例患者造血干细胞均植入成功,ANC植入的中位时间为11(10~13)d,PLT植入中位时间为12(11~42)d。移植相关并发症中,消化道反应和口腔溃疡发生率最高,考虑大剂量CTX和TBI引起的消化道不良反应,对症处理后患者均可耐受,未影响整个治疗过程。至随访结束,无甲状腺功能减退、白内障、性功能障碍、继发性肿瘤和慢性肾衰竭等TBI相关不良反应的发生,证实以TBI联合大剂量CTX为预处理的auto-HSCT的安全。
本研究中,对2例患者移植后进行了维持治疗,已有数据表明,ALL自体移植后维持化疗有助于降低复发率及提高生存率[16],但对于T-LBL患者,auto-HSCT后行维持化疗尚无固定方案,对于移植前未达CR者,结外侵犯者(尤其骨髓侵犯者)维持治疗可能获益[17]。对于行auto-HSCT后复发患者,也可以考虑再次行allo-HSCT。对于复发难治患者,近几年国际上开展了如Notch1抑制剂、奈拉滨、单克隆抗体等新型药物的临床试验,获得明显治疗效果,但现在还处于临床试验阶段[18]。
值得注意的是,7例患者中以年龄<35岁(4例)为主,单独应用Hyper CVAD和BFM90均很快达到CR,诱导治疗期间均无进展与复发,即患者对化疗均敏感。此外,患者行auto-HSCT治疗总费用均低于200 000元,远低于allo-HSCT治疗的高昂费用,也避免allo-HSCT治疗后长期药物抗排异治疗,提高生活质量。
在针对T-LBL的巩固治疗多以allo-HSCT为主情况下,auto-HSCT仍处于试验阶段,而本研究提示初次缓解、对化疗敏感的T-LBL患者,含TBI预处理方案的auto-HSCT有一定的治疗潜力,可作为一种合理的选择,并应尽快进行。本研究为auto-HSCT治疗T-LBL提供一定证据支持,但该发现仍需要扩大病例数,并进一步行随机前瞻对照研究证实。

