1 株耐铜、锌离子土霉素降解菌的筛选鉴定及特性
刘姗姗,陈玉立,洪 文,吴奇霞,卢存龙,刘爱民
(安徽师范大学 生命科学学院/生物环境与生态安全安徽省高校省级重点实验室/基因疾病与健康生物医学安徽省高校重点实验室/皖江城市带退化生态系统的恢复与重建协同创新中心,安徽 芜湖 241000)
四环素类抗生素包括四环素、土霉素、金霉素等,是一类广谱抗生素。近年来畜牧业和水产养殖业发展迅速,大量四环素类抗生素以饲料的形式用于其中。四环素类抗生素已成为我国畜禽业抗生素中使用量最大的一类抗生素[1]。据报道,2007 年我国各类抗生素的年生产量为21 万t,其中约46.1%应用于畜牧养殖业中[1],而2013 年我国的四环素类抗生素使用量达到1.2 万t[2]。无论人用或是兽用抗生素进入动物或人体内后,有质量分数约30%~90%是以母体化合物的形式直接被排出体外[3],最终又通过施肥等方式进入土壤环境或者通过渗漏和污水排放进入水体环境。我国土壤[4]、水产养殖[5]、地下水[6]、牛奶[7]中都有监测到土霉素的残留。环境中残留的抗生素对土壤微生物的群落结构和微生物活性[8]、植物生长[9]都会产生影响,同时也会对人体健康造成危害。当人体内的四环素类抗生素积累到一定程度时会造成肝和肾脏的损伤,引起过敏或中毒反应,还会引起牙釉质发育不全、牙齿发黄[10-11]。因此开展土霉素残留降解的研究很有必要。
生物降解抗生素是当下的研究热点,相对于物理、化学方法降解抗生素,生物降解方法具有环保、简单、高效等特点[12]。孟应宏等[13]从堆肥中筛选出1 株土霉素降解菌,经鉴定为假单胞菌Pseudomonas sp.。翟辉[14]从土壤中筛选出1 株土霉素降解菌,鉴定为曲霉菌Aspergillus sp.,但国内外关于酵母菌降解土霉素的报道较少。同时铜和锌离子作为最常用的饲料添加剂多数随畜禽粪便排出体外,流入自然环境中。环境中的重金属元素对微生物抗生素抗性的形成起到了协同选择作用,进一步促进抗生素抗性基因库的稳定、扩大和抗性基因的传播[15]。因此本研究旨在筛选出具有耐铜锌离子的土霉素降解菌,并研究其降解特性,为该菌在土霉素污染环境治理中的应用奠定基础。
1 材料与方法
1.1 样品与试剂
试验样品为安徽省芜湖市水产养殖废水;盐酸土霉素(C22H24O9N2·HCl)标准品购自于Solarbio公司;甲醇、乙腈和草酸购自于上海麦克林生化科技有限公司;五水硫酸铜购自于上海市试剂一厂综合经营公司;七水硫酸锌购自于上海麦克林生化科技有限公司。
EDTA-Mcllvaine 缓冲液:将0.1 mol/L 的柠檬酸溶液1 000 mL 和0.1 mol/L 的磷酸氢二钠溶液625 mL 混合,制得Mcllvaine 缓冲液,并向Mcllvaine缓冲液中加入EDTA-Na260.05 g。配制EDTAMcllvaine 缓冲液所需药品均购自于上海麦克林生化科技有限公司。
1.2 培养基
基础培养基:牛肉膏蛋白胨、高氏1 号、PDA 培养基[16]。筛选培养基:在灭过菌的基础培养基中加入土霉素母液(1 000 mg/L)。
1.3 试验方法
1.3.1 土霉素降解菌的筛选 取10 mL 样品装入含有90 mL 液体基础培养基的250 mL 三角瓶中,30 ℃、150 r/min 富集培养24 h,吸取0.1 mL 菌液涂布在含微量铜锌离子、土霉素质量浓度为50 mg/L的基础固体培养基上,30 ℃培养2 d,将上述平板上生长的菌落挑出接种在100 mg/L 的固体基础培养基上,按50 mg/L 的梯度逐渐提高培养基中土霉素的质量浓度至 200 mg/L,培养步骤同上。经驯化后将长势良好、菌落规则、耐高浓度土霉素的菌株挑出,接种于含50 mg/L 土霉素的筛选培养基上,检测其降解土霉素的效果,同时设置不接菌的培养基作为对照。挑选出5 d 降解效率最高的菌株,划线纯培养,菌株编号,保存于4 ℃冰箱,备用。
1.3.2 降解菌降解效果的测定 将土霉素母液用甲醇稀释至0.5、1.0、5.0、10.0、20.0、40.0、80.0、100.0 mg/L 等系列质量浓度,作标准曲线;向不接菌的PDA 液体培养基中添加土霉素标准液,制得土霉素质量浓度为10 和40 mg/L 的溶液,同时用流动相制得相应浓度的标准工作液,采用岛津Prominence LC-20A 型高效液相色谱仪对土霉素含量进行检测。取2 mL 培养液,向其中加入6 mL EDTAMcllvaine 缓冲液,然后分别相继加入1 mL 正己烷,1 mL 三氯甲烷,旋涡混匀1 min,超声30 s 使溶质均匀,5 000 r/min离心10 min,上清液经0.22 μm微孔滤膜过滤,其滤液用于高效液相色谱(HPLC)分析。色谱条件为:色谱柱Zorbax C18(250 mm×4.6 mm,5 μm,美国)流动相: 0.01 mol·L-1草酸/乙腈/甲醇(体积比为70 /20/10);流速:0.8 mL.min-1;柱温:30 ℃;检测波长:350 nm;进样量:20 μL。回收率的计算公式为:回收率=A/As×100%(A 和As分别对应培养基和相应标准工作液中的土霉素峰面积)。1.3.3 降解菌的鉴定 对筛选出的降解效果较好的菌株进行形态观察和生理生化鉴定。利用基因组试剂盒提取酵母基因组,用10 g/L 的琼脂糖凝胶电泳对基因组进行验证分析,再送样测序。18S rDNA 序列鉴定由上海通用生物技术有限公司完成。所测得的1 8 S r D N A 序列在N C B I 进行BLAST 搜索找到相似度较高的菌株序列,利用MEGA6.0 软件构建系统发育树(邻接法)。
1.3.4 MIC 检测 检测所筛的菌株在土霉素质量浓度分别为50、100、200、300、…、1 000 mg/L 的液体培养基中被抑制的浓度,并用培养基平板进一步缩小其最低抑菌浓度(M i n i m u m i n h i b i t o r y concentration,MIC)的范围;同样的试验条件下,检测降解菌对四环素、金霉素、氯霉素、Cu2+、Zn2+的MIC 范围。
1.3.5 理化因素对菌株降解土霉素效果的影响 以pH、温度、接种量、装液量、底物质量浓度为研究对象,研究所筛的菌株对土霉素的降解效果。以下试验中每个处理均设置3 个重复。
1) pH:调节pH 分别为5、6、7、8 和9,接种量为1%(φ),装液量50 mL,30 ℃、150 r/min 摇床培养5 d,测定含50 mg/L 土霉素的培养液中土霉素的残留量。
2)温度:调节pH 为7,接种量为1%(φ),装液量50 mL,设置20、25、30、35 和40 ℃共计5 个温度梯度,150 r/min 摇床培养5 d,测定含50 mg/L 土霉素的培养液中土霉素的残留量。
在大多数情况下,Milk-run火车包括牵引车和挂靠拖车。为了实施车间Milk-run系统,必须选择适合自身的火车设备,因为不同公司和工厂的工艺设计多种多样,可以说市场上没有任何拖车设计是完全适合的,所以通常会使用非标准的特殊设计来运输料箱。选择配送设备时必须考虑以下问题。(1)运输条件:运输物品的多样性,公司政策(如重量)和工厂布局。(2)运输灵活性:装卸的必要灵活性,承运人/箱子的差异,路线规划的复杂性。(3)行驶特性:转弯周期,方向稳定性,噪音。(4)操作要求:维护费用,必要设备(叉车、手推车),操作简单。
3)接种量:调节pH 为7,装液量50 mL,接种量(φ)分别为0.5%、1.0%、2.0%、3.0%和4.0%,30 ℃、150 r/min 摇床培养5 d,测定含50 mg/L 土霉素的培养液中土霉素的残留量。
4)装液量:调节pH 为7,接种量为1%(φ),在250 mL 三角瓶中的装液量分别为25、50、75、100和125 mL,30 ℃、150 r/min 摇床培养5 d,测定含50 mg/L 土霉素的培养液中土霉素的残留量。
5)底物质量浓度:调节pH 为7,装液量50 mL,接种量为1%(φ),土霉素的质量浓度分别为25、50、100、150 和200 mg/L,30 ℃、150 r/min 摇床培养5 d,测定含不同质量浓度底物的培养液中土霉素的残留量。
1.3.6 铜、锌离子对菌株降解土霉素的影响 在含低(50 mg/L)和高(200 mg/L)质量浓度土霉素的最适选择培养基中分别添加50 mg/L 的Cu2+和Zn2+,以空白培养基为对照,30 ℃、150 r/min 摇床培养5 d。测定培养液中土霉素残留量,计算土霉素的降解率。每个处理设置3 个重复。
1.3.7 数据分析 数据处理使用EXCEL 2010 程序和SPSS 19.0 等统计分析软件。采用新复极差法(Duncan’s 法)对试验数据结果进行多重比较。
2 结果与分析
2.1 降解菌株的形态特征
经驯化、纯化后从基础培养基上分离出1 株土霉素的高效降解菌,编号记为DJ1。在PDA 平板上DJI 菌落呈圆形,乳白色,湿润,黏稠,易挑起(图1a)。菌体呈椭圆形,出芽生殖(图1b),为酵母菌。
2.2 DJ1 菌株18S rDNA 序列鉴定及遗传学分析

图 1 菌株DJ1 的菌落形态(a)和显微形态(b)Fig. 1 Colonial and microscopic morphology of strain DJ1
2.3 HPLC 法检测土霉素的残留量
在所建立的HPLC 方法下,土霉素的保留时间为4.96 min。结果表明在土霉素质量浓度为0.5~80.0 mg/L 的范围内,各质量浓度与其对应的色谱峰面积具有良好的线性关系,进行相关性分析后得出土霉素的回归方程y=38 086x-14 224,决定系数R2=0.999 9。空白PDA 液体培养基中经预处理后,在10 和50 mg/L 土霉素质量浓度下的平均回收率为101.20%和91.97%,变异系数为4.93%和4.92%。
2.4 MIC 的检测
DJ1 菌株对四环素类抗生素具有很高的耐受性,MIC 检测均超过700 mg/L,且对土霉素、四环素和氯霉素的MIC 均在1 000 mg/L 以上。同时在铜、锌离子质量浓度分别为400 和500 mg/L 时才抑制生长,说明DJ1 菌对铜锌离子也具有较高的耐受性。且在重金属铜锌离子与土霉素共存的二元交叉培养基平板上能生长,具有重金属铜锌与抗生素的交叉耐性。

图 2 DJ1 菌株的18S rDNA 系统发育树Fig. 2 The 18S rDNA phylogenetic tree of strain DJ1
2.5 理化因素对DJ1 菌株降解土霉素的影响
2.5.1 pH pH 对DJ1 菌株降解土霉素效果的影响如图3 所示。在pH 5~9 的范围内,DJ1 对土霉素的降解率呈现先增大后减小的趋势,其降解率分别为pH7>pH6>pH5>pH9>pH10。pH7 为最适pH,该pH 条件下降解率最高,达67.36%。这表明DJ1 菌株适宜生长的环境是中性偏酸,且酸性环境中的土霉素降解率高于碱性环境中,这可能是因为土霉素在酸性条件下结构不稳定,部分土霉素C 环破裂,形成内酯型异构体,无法被检测出[13]。同时,水体、土壤等环境的pH 范围大多都是中性,与本试验的最适pH 一致,本试验对于环境中污染修复具有一定的意义。

图 3 pH 对DJ1 菌株降解土霉素的影响Fig. 3 Effect of pH on the degradation of oxytetracycline by strain DJ1

图 4 接种温度对DJ1 菌株降解土霉素的影响Fig. 4 Effect of incubation temperature on the degradation of oxytetracycline by strain DJ1
2.5.2 温度 温度对DJ1 降解土霉素的效果如图4所示。DJ1 菌株对温度较为敏感,当温度在20~25 ℃时,降解率均不超过45%,之后降解率逐渐增大。当温度达到40 ℃时,降解率急剧增加到90% 以上,这可能是因为高温加剧了土霉素的自然分解[17]。在温度30 和35 ℃时,土霉素降解率分别为67.36%和71.30%,但当温度升高至35 ℃时,DJ1 菌株的生长量逐渐减少,因此在此范围内选择30 ℃作为DJ1 菌株生长的最适温度。
2.5.3 接种量 不同接种量(φ)对DJI 菌株降解土霉素效果的影响如图5 所示。在0.5%~4.0%的范围内,当接种量为1.0%时,降解率最高,为68.67%。随着接种量的增加,DJ1 的降解率出现了先增加后减小的趋势,但差异并不显著。赵永斌[18]报道的四环素降解菌也表现出了相似的现象,其在0.5%~4.0%的范围内,选择2.0%作为最佳接种量,对土霉素的降解率达66.33%。这可能因为菌体会竞争培养液中的营养物质所致。故在此范围内选取1.0%为最适接种量。
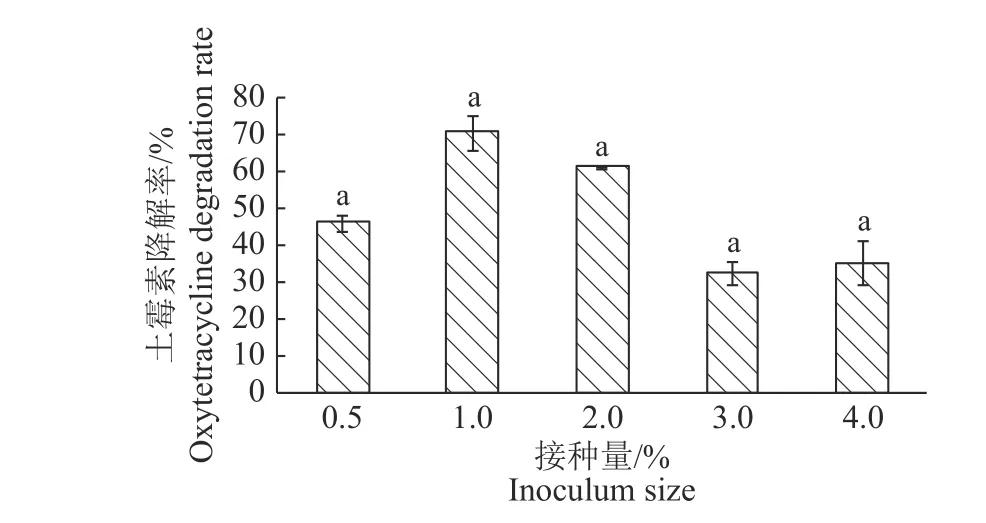
图 5 接种量对DJ1 菌株降解土霉素的影响Fig. 5 Effect of inoculum size on the degradation of oxytetracycline by strain DJ1
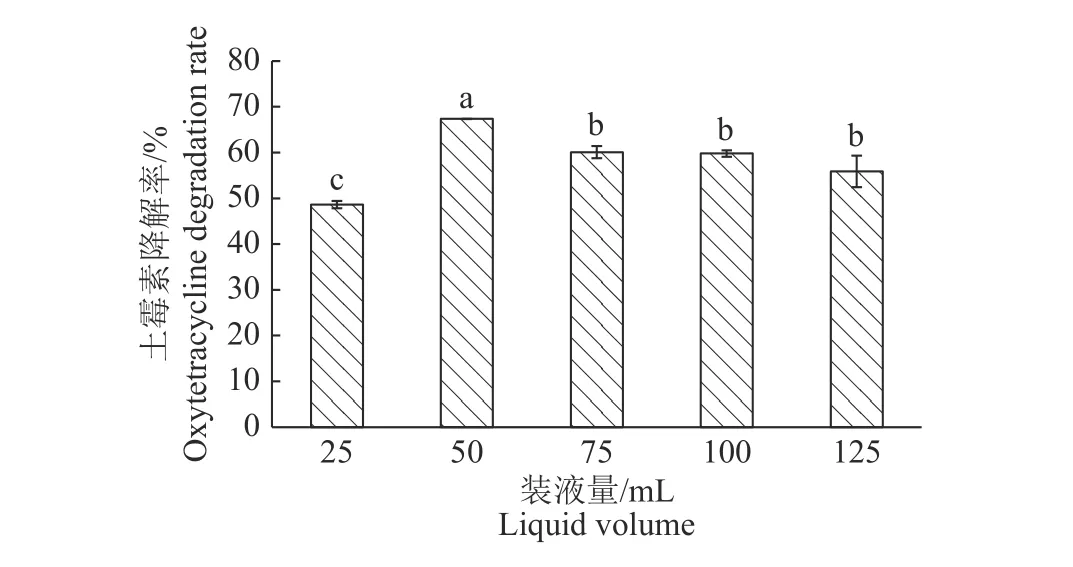
图 6 装液量对DJ1 菌株降解土霉素的影响Fig. 6 Effect of substrate volume on the degradation of oxytetracycline by strain DJ1
2.5.4 装液量 装液量实际反映的是细胞混合的均匀度和需要量的多少[19]。装液量对DJI 菌株降解土霉素的效果如图6 所示。不同装液量对土霉素的降解率具有一定的差异,降解率大小分别为50 mL>75 mL>100 mL>125 mL>25 mL。即在250 mL 三角瓶中装液量为50 ~100 mL 的条件下,DJ1 降解率较高,降解率在67.36%~59.80%。初步表明该菌是兼性厌氧菌,且选取50 mL 为最适装液量。
2.5.5 土霉素质量浓度 兽药国际协调委员提出土壤中的抗生素生态毒害效应的触发值达到100 μg/kg 时,具有一定的生态风险。有研究表明中国农业土壤中残留土霉素的含量范围为0~8 400 μg/kg[20],而水体残留土霉素的浓度一般在μg/kg,甚至是ng/kg 级别。本研究中的DJ1菌对土霉素具有较高的耐受性,但综合环境中土霉素残留量的因素,本试验选取在0~200 mg/L 的底物质量浓度范围内,探索DJ1 降解土霉素的效果。如图7 所示,土霉素的降解率呈现一个随底物浓度增加而逐渐升高的趋势,当土霉素质量浓度为25 mg/L 时,降解率为63.14%,说明DJ1 菌株能够耐受高质量浓度的土霉素。且当土霉素质量浓度为200 mg/L 时,降解率最高,为78.83%。因此在0~200 mg/L 的范围内,选择200 mg/L 为最适底物质量浓度。
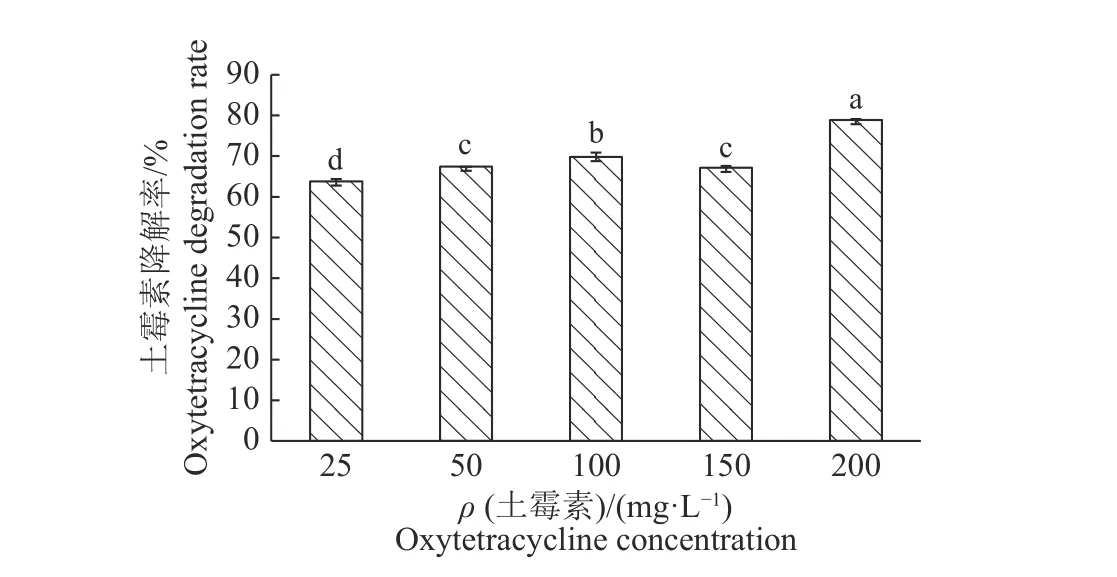
图 7 土霉素浓度对DJ1 菌株降解土霉素的影响Fig. 7 Effect of oxytetracycline concentration on the degradation of oxytetracycline by strain DJ1
2.6 铜、锌离子对DJ1 菌株降解土霉素的影响
由图8 可知,在含有50 mg/L 土霉素的培养基中,与没有加铜、锌离子的空白对照相比, Cu2+稍微促进了DJ1 对土霉素的降解,降解率为71.58%,但效果不显著,Zn2+则抑制了DJ1 对土霉素的降解;在含有200 mg/L 土霉素的培养基中, Cu2+抑制了土霉素的降解。因重金属对微生物的生长起着重要的作用,尤其铜、锌离子是饲料中主要的重金属,因此这在实际应用中很有意义。
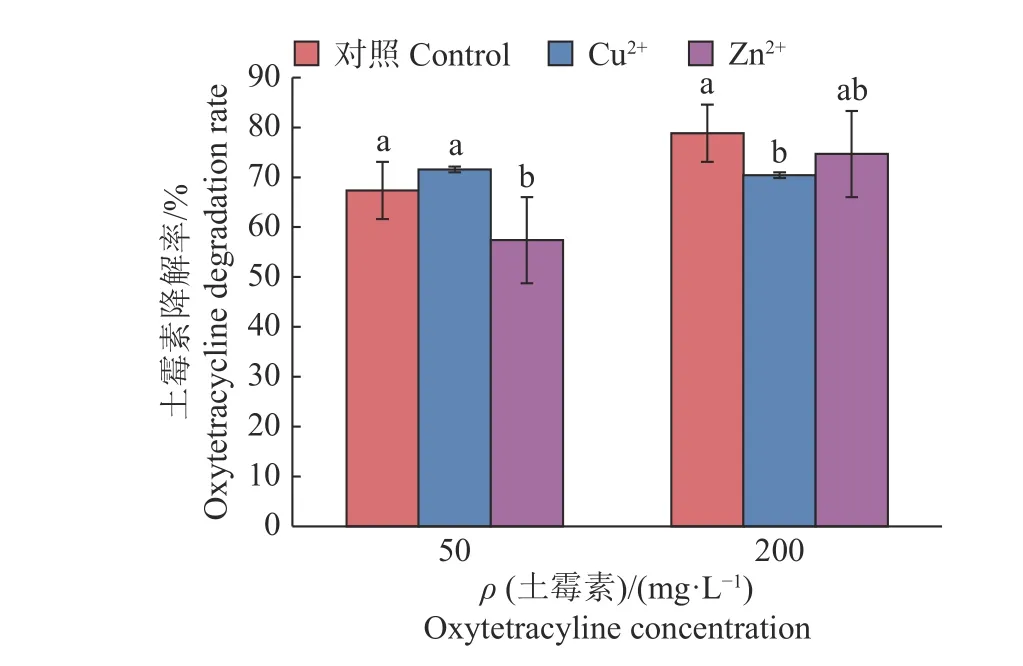
图 8 铜、锌离子对DJ1 菌株降解土霉素的影响Fig. 8 Effect of Cu2+ and Zn2+ on the degradation of oxytetracycline by strain DJ1
3 讨论
环境中存在的重金属离子会改变抗生素污染物的生态危害,并最终影响环境污染的治理和防护。本文从养殖废水中筛选出1 株耐重金属铜、锌离子的土霉素降解菌C. cutaneum。从养殖废水中筛选降解菌,是因为这类污染物残留的抗生素会对繁殖的微生物产生胁迫,只有具有强耐受抗生素性质的微生物才能得以生存,故更能从其中筛选出降解菌。有研究表明,光解抗生素产生的产物毒性高于亲本化合物[21],相比之下,利用真菌漆酶降解的抗生素则毒性较低[22]。故从环境角度来看,微生物降解抗生素比物理化学的过程更可取,因为它降低了抗生素的生物活性。目前关于四环素类抗生素降解菌,国内外已有些报道。Huang 等[23]从药厂分离出降解四环素高效酵母菌,对600 mg/L 的四环素降解率最高可达83.63%。王志强等[24]从某污水池底泥中分离出土霉素降解菌蜡样芽孢杆菌Bacillus cereus。黄建凤等[25]研究装液量对蜡样芽孢杆菌降解土霉素的影响时发现,在250 mL 三角瓶中采用100 mL 的装液量时的降解率比50 mL 和150 mL的都要高,此时降解率为56.2%。Qi 等[26]研究了Cu2+、Fe2+对土霉素降解的影响,结果表明Fe2+显著促进了土霉素的降解,而Cu2+并不明显。而于浩等[27]研究发现Cu2+能促进短波单胞菌属Brevundimonas sp.对土霉素的降解。有研究报道C. cutaneum 是一种产油酵母,具有降解木质素来源抑制物及弱酸、呋喃醛、酚醛等的能力[28],而鲜见C. cutaneum 降解土霉素的报道。本研究从pH、温度、接种量、装液量、底物质量浓度等方面研究了DJ1 菌株的降解特性,探寻最适的降解条件。但在实际应用中受到的影响因素更多,还需进一步探讨其影响机制和降解机理。本文还检测了DJI 菌株的MIC,发现其对抗生素和重金属都有较强的耐受性,在后续的研究中初步检测到DJI 菌株具有tet(A)、tet(c)、tet(M)、tet(Q)这4 种耐药基因,使其对四环素类抗生素表现出较强的抗性(未发表数据),因此,DJ1 可作为研究抗生素和重金属复合污染的模式菌株。
综上所述,菌株DJ1 是一种新发现的能降解土霉素的微生物资源,对于保护生态平衡及对畜牧业的可持续发展均具有重要的科学意义和应用价值。
4 结论
1)本研究在铜、锌离子的胁迫下筛选出1 株降解土霉素的菌株DJ1,经18S rDNA 鉴定后为酵母菌Cutaneotrichosporon cutaneum,GenBank 登录号为MN809497。
2)菌株DJ1 在pH7、温度30 ℃,装液量50 mL(使用250 mL 三角瓶),底物质量浓度200 mg/L,接种量为1%(φ)的条件下,培养5 d 后对土霉素的降解率为78.83%。在含50 mg/L 土霉素的培养基中,添加Zn2+抑制了土霉素的降解,在含200 mg/L 土霉素的培养基中,添加Cu2+抑制了土霉素的降解。
3) 菌株DJ1 对四环素类抗生素和铜、锌离子有较高的耐性,具有重金属铜、锌与抗生素的交叉耐性。

