猪丹毒丝菌spaA 基因的敲除及其致病作用的初步研究
陈富海,林晓君,凃彦芳,刘博婷,余 璐,蔡巩林,林锦铨,彭 凌
(韶关学院 英东生物与农业学院,广东 韶关 512005)
猪丹毒丝菌(Erysipelothrix rhusiopathiae)可使猪患一种急性、热性、败血性传染病,即猪丹毒.临诊症状急性型表现为败血症,亚急性表现为皮肤上出现疹块.慢性病猪表现为心内膜炎和关节炎.各国研究人员对丹毒丝菌的研究已有一百多年,然而对其致病机制及毒力因子目前还未研究清楚[1].从众多研究可知丹毒丝菌属各种菌株的毒力差别很大,有66%的红斑丹毒丝菌会使动物致病,也有将近96%的扁桃体丹毒丝菌对动物无害.1882 年,Pasteur 首次从猪体内分离到此菌,对引起猪丹毒的病原进行精确描述是由Loffler 完成的,同时他还描述了猪感染该菌后出现的临床症状,这是第一个描述这种有机体作为传染性病原体引起猪的疾病.1883 年,Pasteur 和Thuillier 首次使用猪丹毒疫苗,此后,这种弱毒活疫苗和菌苗被长期用于控制猪和火鸡的丹毒病症[2].猪丹毒丝菌在养殖业、食品卫生安全以及人体健康等方面带来了极大的威胁[3-4].猪丹毒丝菌感染会引起热性或急性人畜共患的传染病,主要的传染源是病猪以及各种带菌动物(最主要是带菌猪)[5].灭活疫苗、弱毒疫苗是现有的预防手段,但仍存在缺点,如保护周期短、保护率低等[6],而新一代的亚单位疫苗也存在免疫谱窄的弱点.现发现反向疫苗可以用细菌的毒力因子作研究的重要线索,同时探索毒力因子的种类并研究其功能,还将在研制安全高效的疫苗方面提供重要的理论基础.因此对丹毒丝菌毒力因子的研究为了解各毒力因子相互关联及其致病机制提供证据,并为有效减少猪丹毒对养殖业所造成的经济损失做出贡献.
笔者以临床分离的猪丹毒丝菌野生强毒株为材料,采用DNA 重组技术构建spaA 基因敲除载体,并利用该敲除载体结合同源重组技术敲除强毒株上的spaA 基因.然后比较强毒株和敲除株小鼠毒力的差异来揭示SpaA 在致病中的初步作用,并为进一步揭示SpaA 在致病中的作用机制奠定基础.
1 材料与方法
1.1 材料
1.1.1 实验材料
猪丹毒丝菌野生株SG7、大肠杆菌DH5α(由本实验室保存).
1.1.2 实验试剂
氨苄青霉素、琼脂糖、HindⅢ酶 、Pst Ⅰ酶、XbaⅠ酶、SmaⅠ酶、T4 DNA 连接酶、2×Pfu PCR Mix、SanPrep 柱式质粒小量抽提试剂盒、质粒载体pUC18、SanPrep DNA 抽提取试剂盒、SanPrep 柱式PCR 产物纯化试剂盒等均购买于生工生物工程(上海)股份有限公司.
1.1.3 仪器
2720Thermal Cycler(美国Applied biosystem 公司)、JS-680 凝胶成像分析系统(上海培清科技有限公司)、HZQ-F 恒温振荡培养箱、3K18 高速冷冻离心机(美国Sigma)、Ultrospec2000 紫外/可见分光光度计(美国Amersham Pharmacia Biotech)、DYY-6B 型稳压温流电泳仪(北京市六一仪器厂).
1.1.4 培养基
TSB 培养基:酵母粉0.5%,牛肉粉2.5%,胰蛋白胨1.5%,大豆蛋白胨0.5%,氯化钠0.5%,琼脂粉1.2%,Tween 80 0.05%;LB 培养基: 胰蛋白胨1%,酵母提取物0.5%,氯化钠1%.
1.2 方法
1.2.1 引物的设计与合成
根据spaA 基因序列的上下游序列、Amp 抗性基因序列和载体pUC18 的多克隆位点,采用Primer Premier 5.0 软件设计引物Up-s/Up-As、DOWN-s/DOWN-As 和Amp-s/Amp-As,分别根据spaA 基因设计和spaA 基因上下游区域设计内引物IN-1/IN-2 和外引物OUT-1/OUT-2,由生工生物工程(上海)股份有限公司合成.引物信息见表1(斜体加粗部分为酶切位点).

表1 引物序列和位置
1.2.2 目的片段的制备
以猪丹毒丝菌基因组DNA 作为模板,用表1 的引物分别扩增上游片段L、下游片段R 和Amp 抗性基因A. PCR 产物经琼脂糖凝胶电泳检测、回收后分别用Hind Ⅲ+Pst Ⅰ、Xba Ⅰ+Sma Ⅰ、Pst Ⅰ+Xba Ⅰ.双酶切反应体系:目的片段或质粒载体(1~3μg),10×Tango Buffer(10μL),酶(2.5μL),用ddH2O 补足至总体积100μL. 37 ℃温育3 h,65 ℃热水浴15 min 使酶灭活,并回收酶切产物.
1.2.3 L、R 和A 片段的克隆
质粒载体经Hind Ⅲ+Pst Ⅰ双酶切后与经同样酶切处理的上游片段L 连接并转化至大肠杆菌DH5α感受态细胞,涂布于含有氨苄青霉素的LB 培养基,37℃培养过夜,挑取单菌落进行扩培,经质粒提取、双酶切和测序鉴定筛选出阳性克隆子pUC18-L.pUC18-L 经Pst Ⅰ和Xba Ⅰ酶切后与经同样酶切处理的Amp 抗性基因A 段相连,经转化、筛选和鉴定后获得正确重组质粒pUC18-LA.pUC18-LA 经过Xba Ⅰ和Sma Ⅰ双酶切后与同样酶切处理的下游片段R 相连,经转化、筛选和鉴定最终获得敲除载体pUC18-LAR.
1.2.4 敲除载体pUC18-LAR 的鉴定
用SanPrep 柱 式 质 粒 小 量 抽 提 试 剂 盒 提 取 质 粒,用Hind Ⅲ+Pst Ⅰ、Hind Ⅲ+Xba Ⅰ、HindⅢ+SmaⅠ进行交叉双酶切鉴定.双酶切体系:DNA(8.5μL),两种酶(各0.5μL),10×Tango Buffer(1μL),37 ℃酶切1h.酶切产物经65 ℃热水浴15 min 使酶失活.经酶切鉴定正确的阳性克隆子,送生工生物工程(上海)股份有限公司进行测序.
1.2.5 猪丹毒丝菌感受态制备
挑选猪丹毒丝菌单菌落接种于TSB 液体培养基(10 mL)中30℃培养16 h,取菌液(0.1 mL)转接于TSB 液体培养基(10 mL),37 ℃培养至对数期(OD600=0.4),菌液经30 min 冰浴后,分装于预冷的离心管中,4 ℃离心(6 000 g/min)15 min 后,去上清,用预冷超纯水重悬菌体沉淀,4 ℃离心(8 000 r/min)15min,重复两次后,用500μL 14%预冷甘油溶液重悬细菌.
1.2.6 基因敲除菌的构建
将鉴定正确的敲除载体pUC18-LAR(10 µL)与猪丹毒丝菌感受态(100 µL)置于冰上轻柔的混匀10 min.混合物在1.25 kv、600 Ω、25 µF 的电转参数下进行电转化.电转化后,用37 ℃预温的TSB 培养基(950 µL,含马血清5%)悬浮细菌,37 ℃振荡培养3 h,离心(4 000 r/min)5 min 后涂布于TSB 琼脂培养基(含5 µg/mL 氨苄青霉素).
1.2.7 基因敲除株的鉴定
为检测spaA 基因片段是否被抗性基因替换而缺失,挑取氨苄青霉素平板上的单菌落为模板,用表1的内引物IN-1/IN-2 和外引物OUT-1/ OUT-2 分别进行PCR 鉴定.反应体系:2×PCR Mix(5μL),引物(各0.5μL),猪丹毒丝菌野生株SG7 基因组DNA 或疑似菌DNA(1μL),ddH2O(8μL).反应条件:94 ℃预变性 5 min,95 ℃变性30 s,57 ℃退火45 s,72 ℃延伸4 min,30 个循环后终延伸72 ℃ 10 min.将引物OUT-1/OUT-2 PCR 扩增产物进行测序鉴定,获得的基因敲除株暂命名为SG7ΔspaA.
1.2.8 小鼠毒力试验
根据预试验结果,将55 只BALB/c 小鼠随机分成2 个大组,野生株SG7大组分5 个小组,敲除株SG7ΔspaA分为6 小组,每小组5 只.将两种菌株培养后,采用10 倍梯度进行稀释后攻毒,每只小鼠腹腔注射0.5 mL 梯度浓度菌液,对照鼠注射0.5 mL TSB液体培养基.对小鼠进行连续观察并记录小鼠发病及死亡情况,用Reed-Muench 法计算2 个菌株对小鼠的半数致死量.
2 结果分析
2.1 目的片段的扩增
目的片段的PCR 扩增结果见图1,结果显示上游片段L 长度大小为(1 107 bp),下游片段R 片段长度大小为(924 bp),Amp 抗性基因A 长度大小为(861 bp),与设计的片段大小一致.
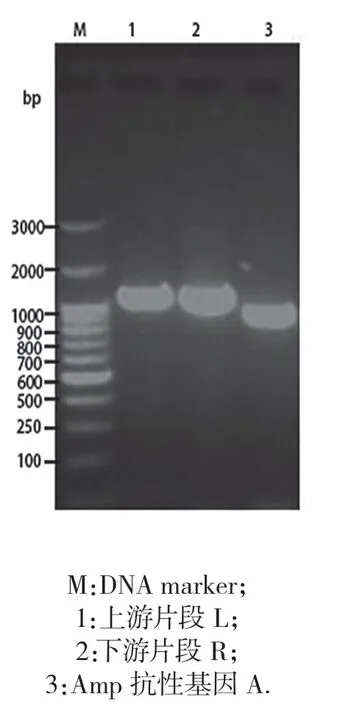
图1 目的片段的PCR扩增
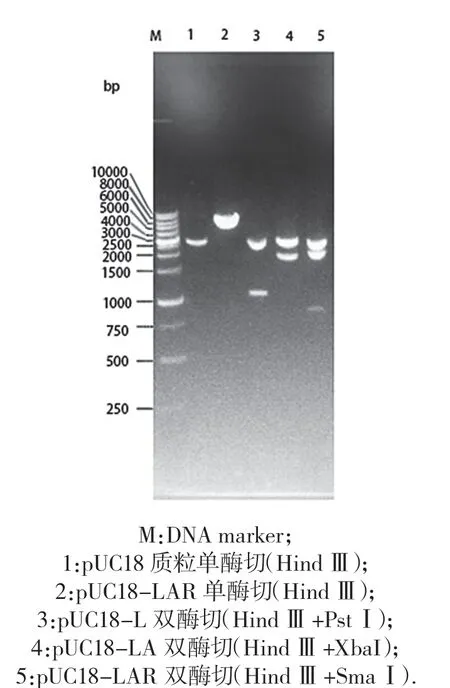
图2 重组载体pUC18-LAR 酶切鉴定电泳图
2.2 敲除载体pUC18-LAR 的鉴定
pUC18-LAR 的酶切鉴定见图2,结果显示pUC18-L 用Hind Ⅲ+Pst Ⅰ双酶切后获得2 686 bp 和1 107 bp 两 个 片 段,pUC18-LA 用Hind Ⅲ+Xba Ⅰ双 酶 切 后 获 得2 686 bp 和1 968 bp 两 个 片 段,pUC18-LAR 用Hind Ⅲ+Sma Ⅰ双酶切后获得2 686 bp、2 892 bp 两个片段表明L、A、R 片段连接正确,测序结果表明3 个片段连接顺序正确,无发生突变.
2.3 突变菌株的鉴定
基因敲除载体pUC18-LAR 电转猪丹毒丝菌感受态细胞后,平板上长出若干单菌落,采用内引物IN-1/IN-2 进行菌落PCR 鉴定,结果见图3,野生株能扩增出符合预期大小(1 402 bp)的条带,有3 个菌落没有扩增出条带,可能为疑似敲除株,以这3 个疑似菌为模板用引物外引物OUT-1/OUT-2 鉴定,结果见图4,以pUC18-LAR 作为阳性对照,结果显示,只有一个疑似菌株扩增出与阳性对照一致大小的片段(2 365 bp),送生工生物工程(上海)股份有限公司进行测序,测序结果说明此菌敲除成功.
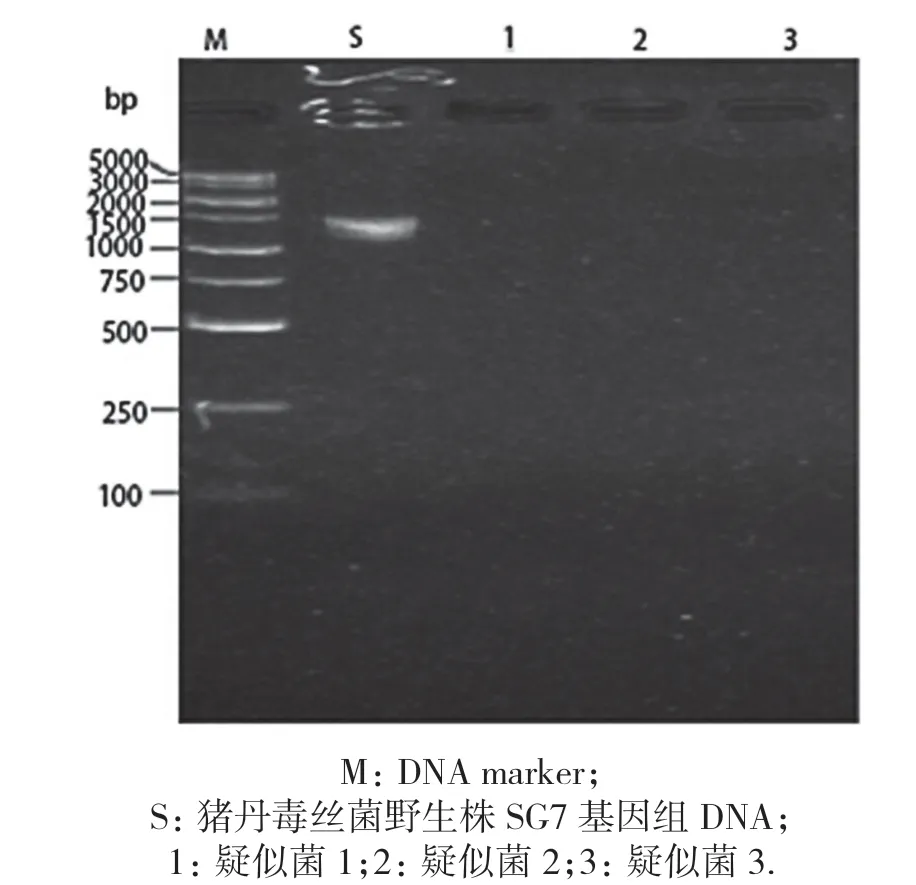
图3 内引物IN-1/IN-2 菌落PCR 鉴定结果

图4 引物OUT-1/OUT-2 菌落PCR 鉴定结果
2.4 小鼠毒力试验结果
野生株SG7 和敲除株SG7ΔspaA.对小鼠LD50(半数致死量)的测定统计数据见表2 和表3.根据Reed-Muench 法计算2 个菌株的半数致死量,野生株SG7 和敲除株SG7ΔspaA.对小鼠LD50 的分别为7.3×103CFU/mL 和7.45×105CFU/mL,与野生株相比敲除株SG7ΔspaA. 对小鼠的毒力降低102 倍.

表2 野生株SG7 株对小鼠LD50 的测定

表3 敲除株SG7ΔspaA 对小鼠LD50 的测定
3 讨论
猪丹毒为散发性或地方流动性传染病,有时也出现爆发性流行,各种年龄和品种的猪均易感,给全球各地的养殖业带来影响.有研究通过对比不同年代菌株的基因发现spaA 基因为保守基因,同源性近100%[12-13].SpaA 是猪丹毒丝菌的主要免疫保护性抗原,几乎存在于所有毒力较强的菌株中,主要的保护功能核心区段为氨基端,且是由抗体介导的免疫保护[14-17].SpaA 本实验构建了spaA 基因敲除载体,与spaA 基因上下游序列有部分同源序列,通过同源重组使得spaA 基因被敲除.电穿孔转化具有转化率高,几乎所有的细菌都有一套与之匹配的电穿孔操作条件的优点,故本实验利用该方法将猪丹毒丝菌spaA 基因敲除载体pUC18-LAR 导入野生株SG7 获得基因敲除株SG7ΔspaA.敲除株SG7ΔspaA 相较于野生株对小鼠的毒力降低了102 倍,与猪丹毒丝菌的致病性有关.为其致病机制和相关的疫苗研发奠定了一定的基础.
4 结论
测序结果表明猪丹毒丝菌敲除株SG7ΔspaA 构建成功.通过小鼠毒力实验证明,敲除株SG7ΔspaA 相较于野生株对小鼠的毒力降低了102 倍,证实SpaA 确实与猪丹毒丝菌的致病性有关,为后继的相关实验提供一定的参考.

