新型冠状病毒肺炎实验室诊断技术研究进展
王建军,赵 平,吴 亮,徐 哲,王福生,程勇前
(解放军总医院第五医学中心 1. 国际肝病诊疗中心; 2. 感染性疾病诊疗与研究中心,北京 100039)
2019年12月,湖北省武汉市发生以肺部病变为主的新发传染病,张永振团队首次从患者收集的支气管肺泡灌洗液中分离得到病原体并进行全基因组测序,发现该病毒基因组与蝙蝠体内发现的严重急性呼吸综合征冠状病毒(SARS-CoV)(GenBank登录号AY278488.2)有79.5%的核苷酸相似性[1]。2020年1月11日世界卫生组织(World Health Organization,WHO)将这种病毒暂命名为2019-nCOV,2020年2月11日WHO宣布由新型冠状病毒引发的疾病正式名称为2019新型冠状病毒病(coronavirus disease 2019,COVID-19),该病毒称为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)[2]。COVID-19短时间内扩散到全国,3月11日WHO宣布COVID-19已构成全球大流行。实验室检测是确诊COVID-19的重要依据,对于该病的治疗和防疫工作至关重要。本文对COVID-19实验室临床诊断技术相关进展进行整理综述。
1 病原学检测
1.1 病毒分离 病原体鉴定主要包括病毒分离和病毒核酸检测,其中病毒分离是实验室诊断病毒感染的“金标准”。国内有多个团队报道病毒分离结果,高福院士团队获得COVID-19患者的支气管肺泡灌洗液,将其接种至人气管上皮细胞中进行分离培养,通过透射电镜观察到病毒颗粒,将培养上清液进行全基因组测序,并与基因库比对确定分离出正确序列的SARS-CoV-2[3]。伍桂珍教授团队也选择COVID-19支气管肺泡灌洗液和咽拭子标本接种至特殊致病性的人气管上皮细胞(human airway epi-thelium, HAE)进行病毒分离,应用电子显微镜观察病毒的形态,通过科赫法则初步鉴定病毒[4]。病毒分离耗时较长,对实验室条件要求高,不适合用于临床患者的早期诊断,但准确性高,对病毒鉴定、致病机制研究、疫苗研发和抗病毒药物研制具有重要意义。
1.2 病毒核酸检测
1.2.1 基因测序技术 高通量测序结合生物信息学分析可以快速识别病原体。2020年1月12日,我国学者将从患者体内分离的SARS-CoV-2基因组序列提供给WHO[1]。对患者标本病毒基因进行测序,可以对病原体进行准确鉴定,并可以分析不同SARS-CoV-2病毒株基因组序列的同源性,但基因测序的成本相对较高,耗时较长,无法用于暴发流行期间大量疑似患者的快速诊断。病毒基因测序的重要意义在于病毒溯源、遗传学进化分析,以及病毒变异的研究,并可以作为确诊SARS-CoV-2的病原学诊断依据之一。
由于病毒的高度变异性及病毒与参考基因组的偏差,对病毒数据分析鉴定速度的要求越来越高。Genome Detective是一个基于互联网的软件应用程序[5],可以快速、准确地从第二代测序数据集中组装所有已知的病毒基因组,允许以FASTA格式从组装的基因组中鉴定系统发生簇和基因型。目前SARS-CoV-2的基因序列已在GeneBank中共享,Cleemput等[6]据此构建了基因组检测冠状病毒分型工具,该工具可以准确地识别世界各地分离的SARS-CoV-2序列,每次可接受2 000个序列的提交,对新的完整基因组序列的分析约需1 min。 该工具已对来自十种冠状病毒的数百个全基因组进行了测试和验证,并正确分类了所有与SARS相关的冠状病毒(SARSr-CoV)和所有可用于COVID-19的公共数据。随着疫情的蔓延,该工具还可以跟踪新的病毒突变,有助于加速新型诊断试剂、药物和疫苗的开发。
纳米孔分析技术起源于Coulter计数器的发明以及单通道电流的记录技术,与许多其他测序方法不同,纳米孔测序不需要通过常见的化学荧光或酶反应测试所检测的样品,而是采用测量分子通过纳米孔时的电流中断直接检测单链DNA/RNA分子序列[7]。对病原体核酸进行扩增后使用纳米孔测序仪进行测序,将获得的核酸序列与已知病原体序列对照以确定病原体类型,克服了传统高通量测序平台对样本制备、场地要求、运行时间长等不利因素,具备实时、运行时间短、文库构建简单等优势。武汉大学组建的联合团队创新性开发的纳米孔靶向测序检测方法,于2020年1月20日在临床开展测序工作,能大幅提升病毒阳性检出率,首次实现了在4 h内获得高敏感性、高准确性SARS-CoV-2序列,较实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qPCR)的阳性检测率提升了43.8%;实现了同时检测SARS-CoV-2和其他10类40种常见呼吸道病毒,以及监测突变病毒[8]。2020年1月30日,中国疾病控制预防中心报道,应用纳米孔技术获得了SARS-CoV-2的基因序列[4]。目前国内也有多家公司宣布完成基于纳米孔测序技术的SARS-CoV-2核酸全长检测试剂盒的开发,已经开始应用于临床COVID-19的快速诊断。SARS-CoV-2核酸基因测序技术的特征及应用情况见表1。
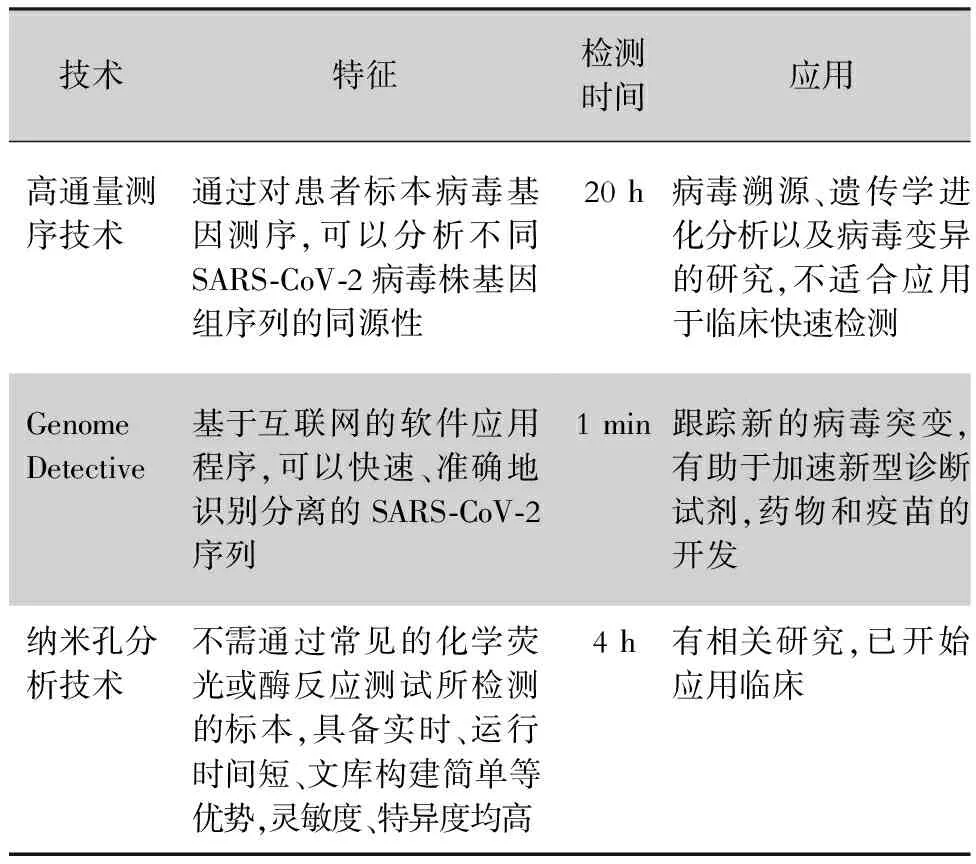
表1 三种SARS-CoV-2基因测序技术的特征及应用情况
1.2.2 PCR技术 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)是RNA逆转录(reverse transcription, RT)与cDNA聚合酶链反应(polymerase chain reaction, PCR)相结合的技术。2020年1月23日德国Corman等[9]基于我国张永振团队上传的SARS-CoV-2基因序列(GenBank MN908947)公布了SARS-CoV-2实时荧光RT-PCR(RT-qPCR)诊断测试方法和流程。此项工作被认为是首个SARS-CoV-2诊断测试方法,并成为WHO SARS-CoV-2分子检测试剂盒的基础。PCR检测方法主要针对SARS-CoV-2基因组中开放读码框1ab(open reading frame 1ab,ORF1ab)和核衣壳蛋白(nucleocapsid protein,NP)。SARS-CoV-2感染实验室确诊需满足以下两项条件中的一项:(1)同一份标本中SARS-CoV-2两个靶标(ORF1ab、N)RT-qPCR检测结果均为阳性,如果出现单个靶标阳性的检测结果,则需重新采样,重新检测;如果仍然为单靶标阳性,判定为阳性。(2)两种标本RT-qPCR同时出现单靶标阳性,或同种类型标本两次采样检测中均出现单个靶标阳性的检测结果,可判定为阳性。
RT-PCT技术是目前疫情暴发期间快速确诊SARS-CoV-2感染者的主要方法,但核酸检测结果阴性并不能排除SARS-CoV-2感染,需排除可能产生假阴性的因素。试剂盒的特异度、灵敏度和稳定性有待深入优化与验证,试剂盒质量也有待进一步提升。2020年1月24日国内首个商用SARS-CoV-2分子检测试剂盒由上海之江生物科技有限公司完成,其后共有50多家生物科技公司开发出RT-PCR检测试剂盒。有研究对多种国产SARS-CoV-2核酸检测试剂盒的检测性能进行了比较与分析,结果显示各试剂的检测结果存在一定的差异[10]。常规RT-PCR SARS-CoV-2核酸检测下限为50拷贝数/μL。最近,武汉大学蓝柯团队应用微滴式数字PCR(droplet digital, ddPCR)方法进行SARS-CoV-2核酸检测发现,ddPCR方法对SARS-CoV-2核酸检测下限值至少为RT-PCR 1/500,且临床检测的总体准确性为94.3%,提示ddPCR方法对COVID-19早期诊断及临床治愈的判断可能比常规RT-PCR检测有更高的敏感性[11]。
2020年1月17日WHO临时指导意见[12]建议,采集患者呼吸系统分泌物和血清标本进行SARS-CoV-2核酸检测。门诊患者可选择鼻咽或咽拭子,如果有痰可选择深咳痰,症状严重的患者可选择支气管或肺泡灌洗液。陈炜等[13]研究发现,痰标本中可检测出的SARS-CoV-2核酸量高于咽拭子标本,表明痰标本较咽拭子标本可更好地诊断COVID-19,究其原因可能与SARS-CoV-2侵袭感染下呼吸道有关。另外,咽拭子检测由于不易采集到足量、合格的标本,故应用咽拭子作为筛查SARS-CoV-2核酸的手段时,阴性检测结果不能作为排除SARS-CoV-2感染的依据。因此,采集深咳痰标本或者肺泡灌洗液,并以2个靶标同时显示阳性作为诊断标准为佳。2020年1月31日Holshue等[14]首次报道在确诊病例的上呼吸道和粪便标本中均检出SARS-CoV-2,近期国内有多项研究[15-16]发现患者粪便标本SARS-CoV-2核酸检测阳性。也有研究[17]发现感染后期肛门拭子阳性率高于咽拭子阳性率,提示SARS-CoV-2可能通过口-粪途径传播。检测粪便标本SARS-CoV-2核酸在确诊COVID-19中也有重要意义。
1.2.3 CRISPR技术 CRISPR技术发现于20世纪90年代初,并在发现7年后首次用于生物化学试验,迅速成为人类生物学、农业和微生物学等领域最流行的基因编辑工具。CRISPR系统具有靶向RNA的特性,可以鉴定检测标本中是否存在特定的序列,从而达到检测病原体的目的。2020年2月14日,麻省理工学院张峰团队[18]基于CRISPR-Cas13的检测技术,将检测方法开发成一种即时诊断产品。此诊断产品无需特定的检测设备,仅通过类似于pH试纸测试方法,在1 h内即可完成检测,具有很高的灵敏度,病毒载量10~100个拷贝/μL即可检测到。2020年3月2日Curti等[19]报道了基于CRISPR-Cas12技术开发的一种灵敏、快速、便携式的SARS-CoV-2检测技术。但国外开发的以上两种方法尚未在临床应用。国内Hou等[20]于2020年2月25日报道了基于CRISPR技术开发的一种快速检测SARS-CoV-2的方法,并与宏基因组测序和RT-PCR检测技术进行比较,发现CRISPR有接近单拷贝的敏感性,未发现假阳性情况,提示其有较高的敏感度和特异度;同时这种检测方法耗时最短,仅为40 min,而RT-PCR则大约需1.5 h,基因组测序需20 h。CRISPR技术有很好的临床实用性,可为COVID-19的诊断提供一种快捷、方便的方法。
1.2.4 其他分子诊断技术 (1)环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是日本学者Notomi 等[21]于2000年发明的一种新的DNA扩增技术,该方法可在等温条件下高效、特异、快速地完成。通过一系列的链置换扩增反应,能在1 h内将靶基因扩增109倍,当靶基因为RNA时,该方法还可通过在反应体系中添加反转录酶而实现对RNA的扩增。2020年2月24日国内尹秀山团队[22]报道了一种基于逆转录环介导等温扩增(reverse transcriptional loop-mediated isothermal amplification,RT-LAMP)技术的COVID-19检测方法iLACO,可在15~40 min内快速检测SARS-CoV-2,其灵敏度与qPCR检测方法相当,并且iLACO带有6个引物,能够特异性地识别ORF1ab靶区的8个不同区域,由于引物设计的高度特异性,故不会产生假阳性结果。RT-PCR技术需2~43 h运行时间,特殊的试验设备,可控的工作环境和训练有素的操作人员。与RT-PCR技术相比,iLACO方法快速、灵敏,利于病毒检测试验的广泛应用,特别是在设施有限的发展中国家。(2)核酸即时检测(point-of-care testing,POCT) 也可以解释为靠近患者床旁的核酸检测,医生、护士,甚至患者本人都可以操作,操作者可在短时间内完成核酸扩增、信号收集与结果分析,快速的现场检测避免了标本采集、送检等过多流程,缩短了病毒感染发现时间,可促进药物早期的合理应用,是目前检验医学中发展最快的领域之一。近年来,临床对更快速、更廉价、更准确检测技术的需求,推动这一市场不断发展,现场PCR等各类分子检测仪器设备也层出不穷。目前国内已经有企业应用核酸POCT技术研发出可用于快速筛查的核酸POCT产品。中科院苏州医工所研发出一套针对SARS-CoV-2的现场快速核酸检测系统,可定性现场即时检测SARS-CoV-2核酸,约45 min即可得出结果。这类产品的开发与应用,将大大提高COVID-19的诊断效率。SARS-CoV-2核酸检测技术的特征及应用情况见表2。
2 血清学检测
目前COVID-19诊断的金标准为病原学检查,临床最常见的为RT-PCR检测,尽管RT-PCR检测结果阳性可确诊COVID-19,但由于各种原因存在假阴性可能,临床出现过多次检测结果为阴性之后复诊为阳性的病例[23]。2020年1月17日WHO临时指导意见建议,选择血清检测作为核酸检测的补充,可选择感染急性期血清和恢复期血清,结合血清特异抗体免疫球蛋白G(immunoglobulin G,IgG)/免疫球蛋白M(immunoglobulin M,IgM)检测,可以明确患者近期或既往是否感染过SARS-CoV-2,有助于核酸检测阴性但临床症状疑似患者的进一步确诊[24]。通常在患者感染SARS-CoV-2后第7天血清中出现lgM,18 d后快速消失,其结果受限于抗体产生的时间和SARS-CoV-2载量。IgG特异性抗体在感染后18 d显著上升,且IgG阳性表明机体有感染,但不能区分是现症感染还是既往感染。即IgG阳性者可能是现症感染也可能是既往感染,但体内一旦产生抗体,就是感染过的标志。
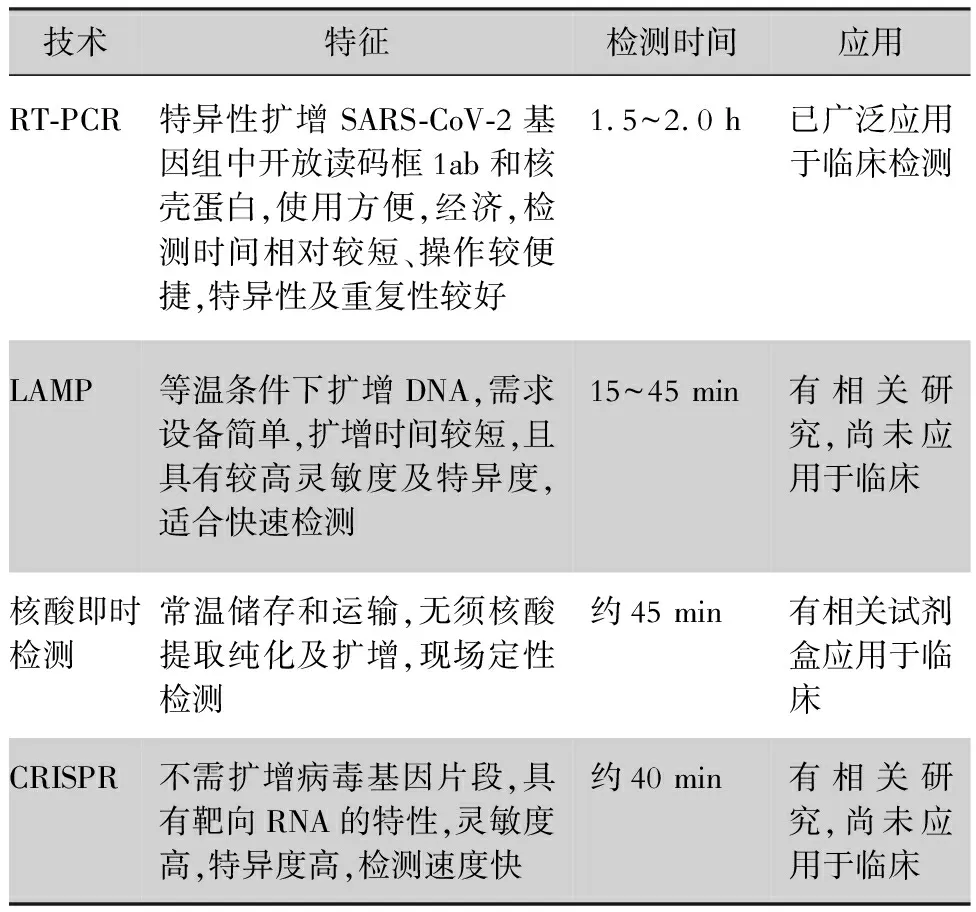
表2 几种SARS-CoV-2核酸检测技术特征及应用情况
目前国内上市的血清学检测试剂盒是根据酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、化学发光法、胶体金技术等研制。ELISA是利用酶标记抗原或抗体以检测相应抗原或抗体的一种免疫学标记技术,具有灵敏度高、特异性强、重复性好、检测速度快的特点,尤其适用于大批量标本检测,是国际认可的标准化诊断方法。Li等[25]应用相当于SARS-CoV-2的核蛋白(nucleoprotein, N)不同区域合成肽免疫动物获得多克隆和单克隆抗体,通过针对来自SARS-CoV-2、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)和SARS-CoV核蛋白的蛋白质印迹分析评估SARS-CoV-2抗体的特异性,抗体用于SARS-CoV-2感染患者组织切片的免疫组织化学染色,可作为潜在的诊断工具。结果显示多克隆抗SARS-CoV-2 NP抗体可以成功用作诊断SARS-CoV-2感染的工具。疫苗开发人员在制造参数优化过程中可用该研究建立的夹心法ELISA试剂盒检测培养物中的病毒表达水平。
化学发光法是通过标记病毒的重组蛋白,捕获血标本中的病毒抗体IgM或IgG,再使用偶联剂碱性磷酸酶特异抗原识别抗体。加入底物后会产生光信号,化学发光仪器通过高灵敏度的光电倍增管(photomultiplier tube,PMT)捕获光子,从而实现pg(皮克)级别的高灵敏度检测,具有可检测全血,标本采集感染风险低,操作简单,检测时间短,效率高及灵敏度高的特点。Cai等[26]报道了一种基于肽的磁性化学发光酶免疫法检测血清中SARS-CoV-2的IgG和IgM抗体,该方法基于从基因组序列推导的20种候选肽中筛选出的S蛋白肽。使用合成肽作为抗原有助于增强测定的稳定性和可重复性,并且理论上比使用SARS-CoV-2作为抗原更具特异性。这种肽在检测中显示出非常好的特异性:感染SARS-CoV-2以外其他病原体的患者血清均未与该肽产生反应,这种高特异性可归因于该区域与其他冠状病毒相对低的同源性。检测血清SARS-CoV-2特异性IgM和IgG抗体诊断COVID-19,结果发现,71.4%的患者检测到特异性的IgG抗体,57.2%的患者检测到特异性的IgM抗体,综合两种抗体,诊断阳性率提高至81.5%,此种检测方法的特点为:在COVID-19患者血清中可同时检测到特异性IgM和IgG。3月1日,由重庆医科大学联合企业研发的化学发光法SARS-CoV-2 IgM/IgG抗体检测试剂盒获得国家药品监督管理局正式批准,许可上市,正式投入临床应用。
胶体金技术检测原理是以胶体金作为示踪标志物标记鼠抗人IgM,同时硝酸纤维素膜上包被SARS-CoV-2抗原,利用胶体金免疫层析间接法的原理,检测人血清中SARS-CoV-2 IgM抗体。该方法的特点是10 min内即可出结果,且易于观察,仅凭肉眼即可判定是否阳性,适合大规模人群快速筛查。目前国内已有多家公司开发出胶体金技术检测血清中SARS-CoV-2 IgG和IgM抗体的试剂盒,并已经开始应用于临床。
血清抗体IgM/IgG结果联合病毒核酸检测可综合分析SARS-CoV-2感染状态,见表3。有助于COVID-19患者的早期发现和隔离,以及进一步快速确定其密切接触者是否感染,利于更好地了解患者感染SARS-CoV-2的全部病程。2020年3月4日国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[27]中,进一步明确了血清特异性IgM/IgG抗体联合病毒核酸检测在确诊SARS-CoV-2感染的重要意义。
表3 SARS-CoV-2病毒核酸联合血清特异性IgM/IgG抗体检测结果的临床意义

病毒核酸抗体IgM抗体IgG临床意义+--感染“窗口期”++-感染早期+-+感染中晚期+++感染活跃期,但已产生一定免疫力-+-可能感染急性期,需复查核酸--+既往感染,病毒已清除-++既往感染,病毒已清除或核酸假阴性
注:+为阳性,-为阴性。
COVID-19患者早诊断、早隔离,对控制疫情尤为重要。目前临床上确诊COVID-19的金标准是SARS-CoV-2核酸检测,但核酸检测可出现假阴性。迄今为止,许多新开发的技术逐渐应用于SARS-CoV-2的检测,这些新技术均有不同的优缺点,在实际应用中需根据特定检测目的,合理选用检测方法,以获得最经济、最优化的效果。如有必要也可将几种方法相结合,以避免单一方法的弊端。随着科学技术的飞速发展,相信未来将有更高效、更便捷、更精准的检测方法应用于SARS-CoV-2的检测,为临床医生和科研工作提供更多选择。

