呼吸道合胞病毒毛细支气管炎患儿中TREM-1/DAP12通路关键信号节点的表达
彭 程,黎金雨,赵 云,余 莉
(1. 四川省广安市人民医院儿科,四川 广安 638000; 2. 四川省遂宁市第一人民医院儿科,四川 遂宁 629000; 3. 成都儿童专科医院儿科,四川 成都 610015; 4. 四川大学华西第二医院儿科,四川 成都 610041)
呼吸道合胞病毒(respiratory syncytial virus,RSV)是小儿毛细支气管炎最常见的病原体,RSV感染患儿较副流感病毒、肺炎支原体等非RSV感染患儿的预后差,目前尚无有效的预防和治疗措施。RSV感染后炎症调节紊乱是影响病毒清除与疾病病程的重要原因,主要表现为炎症细胞的不断浸润以及细胞因子的大量分泌,在发挥抗病毒作用的同时,也会导致严重的肺损伤[1]。因此,深入探讨RSV感染后炎症紊乱的病理机制具有重要的临床意义。
髓系细胞触发受体-1(triggering receptor expressed on myeloid cells-1,TREM-1)可以与下游接头分子DNAX活化蛋白12(DNAX-activating protein 12,DAP12)相互作用,激活炎症信号通路[2-4]。TREM-1在不同种类微生物感染中可能发挥不同作用,如在流感病毒感染模型中TREM-1基因缺失可降低炎症水平[5];在铜绿假单胞菌感染中发现TREM-1基因缺失可促进炎症因子分泌[6]。但是,TREM-1在RSV毛细支气管炎患儿中的表达及作用目前尚无报道,因此,本文旨在探讨TREM-1、DAP12在RSV毛细支气管炎患儿中的表达,并构建RSV感染人支气管上皮(normal human bronchial epithelial cells,NHBE)细胞模型,以深入研究相关机制。
1 资料与方法
1.1 研究对象 选取2017年1月—2019年1月四川省广安市人民医院RSV毛细支气管炎患儿为病例组,共67例。纳入标准:(1)年龄≤2岁;(2)符合《毛细支气管炎诊断、治疗与预防专家共识(2014年版)》中的诊断标准[7];(3)采用鼻咽拭子采集呼吸道分泌物,病原学检查为RSV单一感染;(4)入院前1个月内未经糖皮质激素、免疫抑制剂等药物治疗;(5)入院前病程在3 d内。排除标准:合并肺结核、免疫缺陷病、先天性疾病等。
根据入院lowell评分,将病例组分为轻症组(临床评分≤9分,共39例)和重症组(临床评分≥10分,共28例)。选取同期体检的健康儿童作为对照组,共35例。本研究已获四川省广安市人民医院伦理委员会的批准,且研究对象监护人均已签署知情同意书。
1.2 血清中炎症因子含量的检测 治疗前,经肘正中静脉穿刺采集静脉血0.5 mL,分离血清,分装后保存于-80℃冰箱。使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(深圳欣博盛生物科技有限公司)检测血清中白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)、白细胞介素-17(interleukin-17,IL-17)、高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)含量。
1.3 外周血单个核细胞中TREM-1、DAP12 mRNA的检测 治疗前,经肘正中静脉穿刺采集EDTA抗凝静脉血2 mL,使用人外周血单个核细胞分离液(北京索莱宝科技有限公司)分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。使用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测PBMCs中TREM-1、DAP12 mRNA表达量。以GAPDH作为内参基因,引物序列为:TREM-1上游引物,5’-GAACTCCGAGCTGCAACTAAA-3’;下游引物,5’-TCTAGCGTGTAGTCACATTTCAC-3’。DAP12上游引物,5’-GAGACCGAGTCGCCTTATCA-3’;下游引物,5’-GTCATGATTCGGGCTCATTT-3’。
1.4 PBMCs中TREM-1、DAP12蛋白质的检测 蛋白质免疫印迹(Western blot,WB)检测PBMCs中TREM-1、DAP12蛋白质表达量。常规进行蛋白提取、电泳、转印等步骤,一抗(英国Abcam公司)稀释比例为:TREM-1(1∶1 000)、DAP12(1∶500)、GAPDH(1∶3 000)。上述试验均在四川省广安市人民医院完成。
1.5 细胞学试验
1.5.1 主要试剂 NHBE细胞、人喉癌上皮细胞(Hep-2细胞)均购自美国ATCC;RSV病毒(A亚型)购自广州博特生物工程有限责任公司;DMEM培养基、胎牛血清均购自美国Gibco公司;Lipofectin-2000TM购自美国Invitrogen公司。
1.5.2 细胞与病毒培养 NHBE细胞、Hep-2细胞均使用含10%胎牛血清的DMEM培养基,于37℃、5%CO2的培养箱中静置培养。将RSV病毒接种至Hep-2细胞,培养3~5 d后收集细胞,反复冻融获取病毒悬液,根据Reed-muench法测定半数组织培养感染剂量(50% tissue culture infective dose,TCID50)。细胞学试验均于四川大学华西第二医院完成。
1.5.3 RSV感染 将NHBE细胞接种于6孔板,待汇合度达到80%左右时,弃去培养基,PBS洗涤2次,依次加入滴度为0、50、100、500 TCID50的RSV病毒悬液,放置于37℃培养箱中吸附2 h,弃去上层悬液,PBS洗涤2次,加入培养基继续培养48 h,然后收集细胞,WB检测不同滴度RSV诱导时NHBE细胞中TREM-1蛋白质的表达。此外,在滴度为100 TCID50的诱导条件下,分别培养0、24、48、72 h,然后收集细胞,WB检测不同诱导时间NHBE细胞中TREM-1蛋白质的表达。
1.5.4 RNA干扰质粒的构建与转染 参照文献[8]报道,设计针对人TREM-1的siRNA序列,具体序列为:siRNA-TREM-1正义链,5’-CCGGTG GCAGATAATAAGGGACGGCTCGAGCCGTCC CTTATTATCTGCCTTTTTG-3’;siRNA-TREM-1反义链,5’-AATTCAAAAAGGCAGATAATA AGGGACGGCTCGAGCCGTCCCTTATTATCT GCCA-3’。siRNA-Control正义链,5’-CCGGTGG GAAGTACGGAGTAAACGCTCGAGCGTTTA CTCCGTACTTCCCTTTTTG-3’;siRNA-Control反义链,5’-AATTCAAAAAGGGAAGTACG GAGTAAACGCTCGAGCGTTTACTCCGTACT TCCCA-3’。将上述寡核苷酸单链退火后,克隆至pGenesil-1.1质粒。使用Lipofectin-2000TM将测序正确的siRNA-Control质粒和siRNA-TREM-1质粒转染至NHBE细胞。
1.5.5 试验分组 细胞学试验分为4组:对照组、RSV感染组、RSV+siRNA-Control组、RSV+siRNA-TREM-1组。对照组、RSV感染组使用未进行转染的NHBE细胞,RSV+siRNA-Control组和RSV+siRNA-TREM-1组分别使用siRNA-Control质粒和siRNA-TREM-1质粒转染的NHBE细胞。对照组不进行RSV感染,其余3组均使用滴度为100 TCID50的RSV感染,诱导时间为48 h。
1.5.6 检测指标 RSV感染48 h后,收集各组细胞及上清液,使用qRT-PCR检测各组细胞中TREM-1、DAP12 mRNA表达,使用WB检测各组细胞中TREM-1、DAP12蛋白表达水平,使用ELISA检测细胞上清液中炎症因子的含量,包括IL-1β、IL-6、IL-8、IL-17、HMGB1。
使用免疫荧光染色检测各组细胞中TREM-1蛋白表达水平,具体步骤为:4%多聚甲醛固定30 min,封闭1 h,滴加抗TREM-1抗体(1∶50)4℃过夜。二抗孵育、DAPI染色、封片等步骤后拍照。
1.6 统计学分析 应用SPSS 20.0软件进行统计分析。所有计量资料均采用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P≤0.05为差异具有统计学意义。
2 结果
2.1 基本资料 病例组共67例RSV毛细支气管炎患儿,其中轻症组39例,重症组28例。轻症组中男性21例,女性18例,平均年龄(9.16±4.22)个月;重症组中男性13例,女性15例,平均年龄(9.45±4.63)个月。对照组共35例健康儿童,其中男性18例,女性17例,平均年龄(9.28±4.06)个月。三组儿童性别、年龄比较,差异均无统计学意义(均P>0.05)。
2.2 各组儿童血清中炎症因子含量的比较 轻症组和重症组儿童血清中IL-1β、IL-6、IL-8、IL-17、HMGB1含量均高于对照组,且重症组IL-1β、IL-8、IL-17、HMGB1含量高于轻症组,差异均具有统计学意义(均P<0.05)。见表1。
2.3 各组儿童PBMCs中TREM-1、DAP12 mRNA及其蛋白的表达变化 轻症组和重症组儿童PBMCs中TREM-1、DAP12 mRNA及蛋白表达量均高于对照组,且重症组高于轻症组,差异均具有统计学意义(均P<0.05)。见图1、图2。
2.4 RSV诱导NHBE细胞表达TREM-1蛋白情况 随着RSV浓度和诱导时间的增加,NHBE细胞中TREM-1的表达量逐渐升高,RSV浓度为100 TCID50以及诱导时间为48 h时,TREM-1的表达量达到最高。见图3。

表1 各组儿童血清中炎症因子含量的比较(pg/mL)
注:a表示与对照组比较,P<0.05;b表示与轻症组比较,P<0.05。
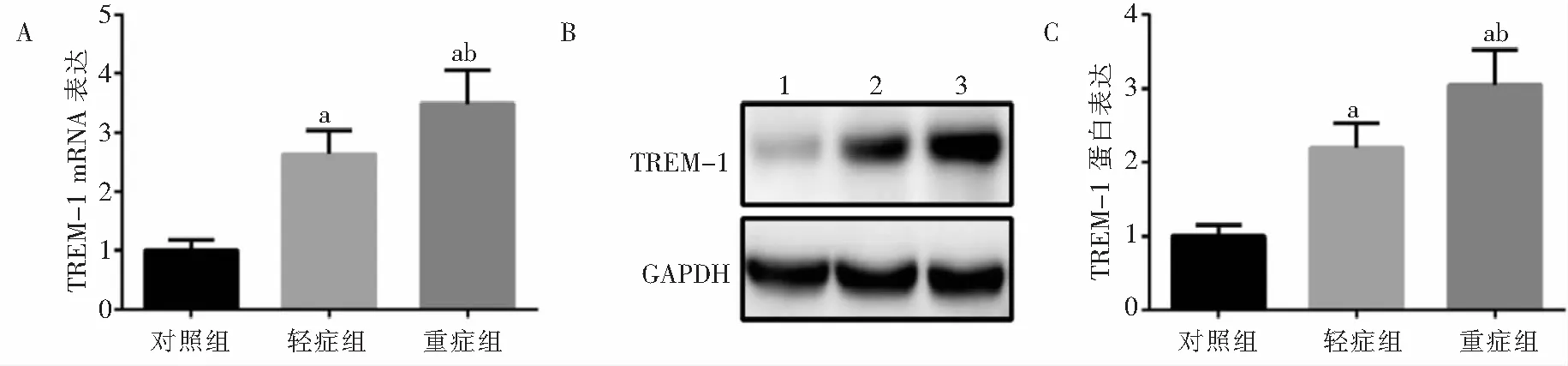
A:qRT-PCR检测TREM-1 mRNA表达;B、C:WB检测TREM-1蛋白表达。1:对照组;2:轻症组;3:重症组。a:与对照组比较,P<0.05;b:与轻症组比较,P<0.05。
图1 各组PBMCs中TREM-1 mRNA和蛋白表达水平
Figure 1 Expression level of TREM-1 mRNA and protein in PBMCs of each group

A:qRT-PCR检测DAP12 mRNA表达;B、C:WB检测DAP12蛋白表达。1:对照组,2:轻症组,3:重症组。a:与对照组比较,P<0.05;b:与轻症组比较,P<0.05。
图2 各组PBMCs中DAP12 mRNA和蛋白表达水平
Figure 2 Expression level of DAP12 mRNA and protein in PBMCs of each group

A:WB检测不同感染滴度下TREM-1的蛋白表达;B:WB检测不同感染时间下TREM-1的蛋白表达。a:与0 TCID50(或0 h)比较,P<0.05;b:与50 TCID50(或24 h)比较,P<0.05。
图3 RSV诱导NHBE细胞表达TREM-1蛋白水平
Figure 3 Expression level of TREM-1 protein in NHBE cells induced by RSV
2.5 TREM-1沉默对TREM-1表达的抑制效果 RSV感染组、RSV+siRNA-Control组中TREM-1 mRNA和蛋白量均高于对照组和RSV+siRNA-TREM-1组,差异均具有统计学意义(P<0.05),见图4。RSV感染组、RSV+siRNA-Control组的荧光强度强于对照组和RSV+siRNA-TREM-1组,见图5。

A:qRT-PCR检测TREM-1 mRNA转录水平;B、C:WB检测TREM-1蛋白表达。1:对照组;2:RSV感染组;3:RSV+siRNA-Control组;4:RSV+siRNA-TREM-1组。a:与对照组比较,P<0.05;b:与RSV感染组比较,P<0.05;c:与RSV+siRNA-Control组比较,P<0.05。
图4 各组NHBE细胞中TREM-1 mRNA转录和蛋白表达水平
Figure 4 Expression level of TREM-1 mRNA transcription and protein in NHBE cells of each group

1:对照组;2:RSV感染组;3:RSV+siRNA-Control组;4:RSV+siRNA-TREM-1组。
图5 免疫荧光染色检测各组NHBE细胞中TREM-1表达情况
Figure 5 Expression of TREM-1 in NHBE cells by immunofluorescence staining of each group
2.6 TREM-1沉默对DAP12表达的影响 RSV感染组、RSV+siRNA-Control组中DAP12 mRNA和蛋白表达量均高于对照组和RSV+siRNA-TREM-1组,差异均具有统计学意义(均P<0.05)。 RSV+siRNA-TREM-1组中DAP12 mRNA和蛋白表达量高于对照组,差异均具有统计学意义(P<0.05)。见图6。
2.7 TREM-1沉默对炎症因子分泌的影响 RSV感染组、RSV+siRNA-Control组细胞上清液中IL-1β、IL-6、IL-8、IL-17、HMGB1含量均高于对照组,差异均具有统计学意义(均P<0.05)。RSV+siRNA-TREM-1组的上述炎症因子含量均低于RSV感染组、RSV+siRNA-Control组,差异均具有统计学意义(均P<0.05)。RSV+siRNA-TREM-1组的IL-8、IL-17、HMGB1炎症因子含量高于对照组,差异均具有统计学意义(均P<0.05)。见表2。

A:qRT-PCR检测DAP12 mRNA表达;B、C:WB检测DAP12蛋白表达。1:对照组;2:RSV感染组;3:RSV+siRNA-Control组;4:RSV+siRNA-TREM-1组。a:与对照组比较,P<0.05;b:与RSV感染组比较,P<0.05;c:与RSV+siRNA-Control组比较,P<0.05。

图6 各组NHBE中DAP12 mRNA和蛋白表达水平
注:a表示与对照组比较,P<0.05;b表示与RSV感染组比较,P<0.05;c表示与RSV+siRNA-Control组比较,P<0.05。
3 讨论
TREM-1是Bouchon等人于2000年首次发现的跨膜糖蛋白,是炎症级联反应中的重要调节因子。尽管目前尚未明确鉴定出TREM-1配体,但间接证据表明损伤相关分子模式(DAMPs)和病原相关分子模式(PAMPs)可活化TREM-1,从而诱导炎症因子分泌[9]。此外,TREM-1其他功能的发现,如促进T细胞增殖,激活抗原呈递细胞,表明TREM-1蛋白在调节宿主对病原微生物的免疫反应中发挥更重要的作用[10]。
最初研究[11]认为TREM-1主要表达于巨噬细胞、中性粒细胞、树突状细胞、淋巴细胞等免疫细胞表面,仅在脓毒症等细菌感染疾病中发挥免疫效应。但近年研究[12-13]发现,TREM-1也表达于气道上皮细胞、软骨细胞等组织细胞表面,参与病毒感染以及无菌性炎症。Yuan等[14]在研究人类免疫缺陷病毒(human immunodeficiency virus,HIV)在巨噬细胞中的隐匿机制时发现,HIV可通过NFκB信号通路诱导巨噬细胞高表达TREM-1,增强其抗凋亡能力,而沉默TREM-1表达则可上调Caspase 3表达,下调Bcl-2表达,促进巨噬细胞凋亡,认为靶向沉默TREM-1可能提高HIV的清除率。然而,TREM-1在其他种类病毒感染中的作用仍知之甚少,在RSV毛细支气管炎患儿中的表达情况及作用机制尚无报道。
炎症因子的大量释放是RSV感染与机体免疫屏障相互作用的结果,也是加重肺部病理损伤的原因之一,血清中炎症因子含量与患儿预后密切相关[15]。因此,本文首先对RSV毛细支气管炎患儿血清中炎症因子含量进行检测,ELISA法检测结果表明RSV毛细支气管炎患儿血清中IL-1β、IL-6、IL-8、IL-17、HMGB1含量均显著升高,而且与病情程度有关。此外,本研究进一步发现TREM-1 mRNA和蛋白在PBMCs中的表达量也显著升高,与炎症因子的升高趋势一致,提示TREM-1可能参与RSV致炎机制。TREM-1的胞浆结构域缺乏信号基序,其功能效应主要依赖于下游接头分子DAP12传递[16],因此,TREM-1与DAP12的表达趋势常保持一致,本文研究结果显示,DAP12 mRNA和蛋白在PBMCs中高表达,也证实了上述结论。TREM-1/DAP12信号通路介导炎症因子释放的因果关系并不恒定,两者可能相互作用,共同诱导炎症级联扩大。部分研究结果可间接支持这一结论,例如:HMGB1可能是TREM-1的配体[17];NFκB不仅是TREM-1/DAP12诱导炎症因子释放的下游信号通路,也可上调TREM-1表达,沉默NF-κB p65可抑制HIV相关蛋白Tat或者gp120对TREM-1表达的诱导作用[14]。
为了进一步证实上述结论,本文构建了RSV感染NHBE的体外细胞模型,结果发现RSV可通过浓度和时间依赖的方式诱导TREM-1高表达。以往研究大多认为,TREM-1主要通过炎症细胞发挥生物学效应,如增强细胞迁移能力,促进炎症因子分泌等[18]。本文通过RNA干扰技术对TREM-1进行沉默,发现TREM-1沉默可以下调DAP12表达,降低炎症因子分泌,进一步证实TREM-1是RSV感染后炎症失调的关键分子,为RSV毛细支气管炎治疗提供了新的靶点。
综上所述,TREM-1/DAP12信号通路在RSV毛细支气管炎患儿中高表达。RSV诱导支气管上皮细胞高表达TREM-1,沉默TREM-1可以下调DAP12表达,降低炎症因子分泌。

