剖宫产术后腹壁瘢痕子宫内膜异位症癌变1例
唐庄艳,孔乔俊,王立岩,武寒茹,张萍萍,明 芳*
(1.柳州市人民医院,广西 柳州545000;2.吉林大学中日联谊医院 妇产科,吉林 长春130021;3.扬州妇幼保健院,江苏 扬州225000)
1 临床资料
患者,女性,41岁,因“发现腹部包块13年,加重1年”入院,患者既往2006年于当地医院行剖宫产术,术后3月自行触及下腹部术口瘢痕处一小包块(约0.5 cm),质硬,轻压痛,未突出皮肤表面,曾至医院就诊予消炎止痛对症治疗后缓解,后未定期复查未处理。13年来患者发现下腹壁肿块无消退,且逐渐增大,近1年来明显加重,包块突出体表,伴疼痛,有刺痛感,经期前后明显。考虑腹部瘢痕子宫内膜异位症。建议入院手术治疗。入院查体:腹平坦,下腹部剖宫产切口处见一横约10 cm陈旧性疤痕,左侧壁疤痕处可触及一大小约4*3 cm肿物,边界尚清,质硬,有触痛,不活动。妇检:外阴发育正常,阴道黏膜未见紫蓝色病灶,宫颈光滑,子宫及双附件未触及异常。辅助检查:体表包块B超:下腹部剖腹产术口皮下脂肪层内可探及一大小约32×25×27 mm实质性低回声肿块,边界清,形态不规则,内回声不均匀,后方回声增强。CDFI:低回声团内部及周边见树枝状血流信号;PW:肿块至周边及内部可测及低速高阻血流频谱,见图1。妇科彩超、肝胆胰脾肾彩超、乳腺彩超、胸片均未见明显异常。CA125: 20.87 U/ml。入院后2天在全麻下行腹壁肿物切除术,术中见:肿物位于前鞘与皮下之间的肌肉层,呈紫蓝色,大小约4×3 cm,质硬,与周围组织界限欠清,将肿物完整切除后,剖开肿物,可见巧克力样液体。术后病理回报:(腹壁切口肿物)低分化腺癌。免疫组化:CK(+)、CK7(+)、NapsinA(+)、p53小灶状(+)、p16小灶状(+);CK20、ER、PR、WT-1、SALL4、Arg-1、Hep均(-)。特殊染色:网染纤维组织增生;PAS无特殊。结合形态学及免疫表型,病变符合透明细胞癌改变,见图2。术后为排除其他部位的原发病灶,完善盆腔MR、胸部CT、全腹CT、胃肠镜均未提示异常,故结合患者临床表现、检查及术后病理检查结果,考虑腹壁透明细胞癌为内异症病灶恶变所致,若再次手术探查,损伤机会较大,与患者及家属沟通后,为防止复发,建议转入肿瘤科行局部放疗。
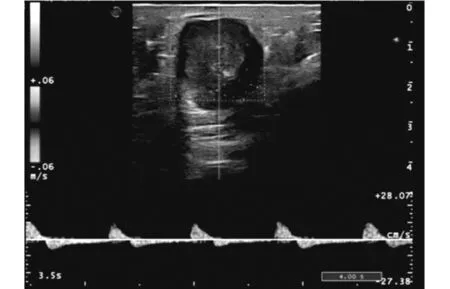
图1 腹壁瘢痕子宫内膜异位症超声图像
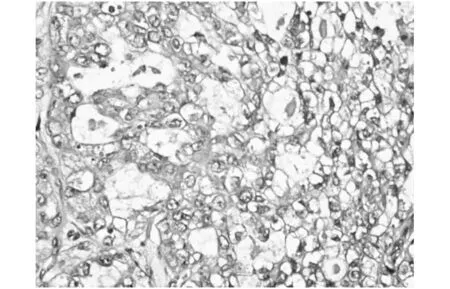
图2 苏木精和曙红(H&E)染色的组织病理
2 讨论
近年来,随着剖宫产率的升高,腹壁瘢痕子宫内膜异位症也并不罕见[1]。据报道,剖宫产后瘢痕子宫内膜异位症的发病率为0.2-0.8%,其恶变较为罕见,发病率为1%,最常见病理类型是透明细胞癌,其次是子宫内膜样癌[2]。虽然各种成像技术为其作出准确诊断提供了很大帮助,但缺乏特异性。根据Hensen等人的研究,超声是最简便易行的影像学检查方法,并在大多数情况下可以借助超声与腹壁切开疝,血肿,脓肿或皮脂囊肿进行鉴别[3]。对于某些疑难病例,可以借助计算机断层扫描(CT)或MRI等影像学检查,也可以通过细针穿刺细胞学检查(FNAC)明确诊断。目前瘢痕子宫内膜异位症最常见的治疗手段是药物治疗和手术[4]。虽然药物治疗能够减轻症状和控制病灶增长及复发,但是手术切除肿物仍是首选[5]。临床上为了防止复发及恶变,手术治疗时应切除距肿物切缘至少1 cm的手术范围,必要时可能需要进行皮瓣移植或聚丙烯网片植入以弥补筋膜缺损[6]。对于内异症癌变的患者,需术后辅助化放疗以防复发。
由于腹壁子宫内膜异位症的临床表现不同,比如有些患者表现为月经周期性疼痛典型症状,但有些患者可能完全没有症状,且其癌变缺乏特异性的肿瘤标志物。据报道,CA125在腹部内异症癌变病例中可表现为正常至轻度升高,其敏感性和特异性分别为87%和92%[7]。有研究报道,透明细胞癌是肾癌、胰腺癌和妇科肿瘤的代表性组织学类型,其相关免疫组织化学分析表明,通常在妇科肿瘤中CK7染色阳性,CK20染色阴性,而GPC-3在肝癌和肾癌中通常呈阳性。故对于免疫组化CK7/CK20呈阳性/阴性,而对GPC-3呈阴性,可以表明该肿瘤起源于妇科肿瘤[8]。本例患者既往只有剖宫产手术史,有伴随月经周期而出现周期性疼痛的典型症状,肿瘤标志物CA-125正常,腹壁肿物组织切片提示透明细胞癌,免疫组化:CK7/CK20呈阳性/阴性。基于以上证据,可以诊断出本例患者腹壁肿块为剖宫产术后腹壁子宫内膜异位引起的恶变。
综上所述,在临床上,腹壁内异症恶变病例较为罕见,目前对这类患者管理经验欠缺和诊断方法缺乏特异性,有时可能无法做出准确的判断而导致误诊或延误治疗。尽管如此,只要加强子宫内膜异位症患者的监测,也是可以早期诊断和治疗的,对于月经期间腹壁切口疼痛或者肿胀的需高度重视,因为这可能是恶变的早期征兆。

